替加環素腦室內注射治療廣泛耐藥鮑曼不動桿菌顱內感染的PK/PD和神經毒性分析
黃琪 楊志玲 黃琪 蔣宇 張興文 賈愛軍

摘要:目的 分析替加環素腦室內注射治療廣泛耐藥鮑曼不動桿菌顱內感染的藥動學/藥效學(pharmacokinetics/pharmacodynamics, PK/PD)和神經毒性,預測臨床有效性及安全性,為臨床治療方案提供可行的參考。方法 對1例實施腦室內注射替加環素的廣泛耐藥(extensively drug-resistant, XDR)鮑曼不動桿菌(Acinetobacter baumannii, A. baumannii)顱內感染患者進行藥物濃度監測(therapeutic drug monitoring, TDM),研究替加環素在腦脊液(cerebrospinal fluid, CSF)中的PK。濃度測定采用二維高效液相色譜法。結合最小抑菌濃度(minimum inhibitory concentration, MIC)評估替加環素的PD。用細胞計數試劑盒-8(cell counting kit-8,CCK-8)測替加環素對PC12細胞生長抑制、流式細胞術檢測細胞凋亡評估替加環素的神經毒性。結果 單次腦室內給藥5 mg替加環素后,峰濃度(Cmax)為37.894 mg/L,遠高于MIC值2 mg/L。AUC0-12h為200.6 mg·h/L。半衰期為2.73 h,提示每日至少需要給藥2次。模擬多劑給予替加環素的穩態Cmax為55 mg/L。替加環素抑制PC12細胞生長并誘導PC12細胞凋亡,IC50值約為51.35 mg/L。替加環素Cmax接近40 mg/L,該濃度對PC12細胞生長抑制率和誘導凋亡率分別為41.33%和4.58%。結論 腦室內注射替加環素是治療鮑曼不動桿菌顱內感染的一種很有前景的方法。但高濃度替加環素可能存在潛在神經毒性,替加環素單次劑量最好不超過5 mg。腦室內注射替加環素必須謹慎選擇,在TDM下進行。
關鍵詞:替加環素;腦室內注射;廣泛耐藥鮑曼不動桿菌;顱內感染;治療藥物監測
中圖分類號:R978.1 ?文獻標志碼:A
Analysis of pharmacokinetics/pharmacodynamics and neurotoxicity of tigecycline intraventricular injection for the treatment of extensively drug-resistant Acinetobacter baumannii intracranial infection
Huang Qi1, Yang Zhiling 1, Huang Qi2, Jiang Yu 3, Zhang Xingwen 4, and Jia Aijun 4
(1 Department of Pharmacy, Hunan Provincial Peoples Hospital (The First-Affiliated Hospital of Hunan Normal University), Changsha 410005; 2 Department of Pharmacy, Xiangya Hospital, Central South University, Changsha 410031; 3 Institute of Emergency Medicine, Hunan Provincial People's Hospital (The First-Affiliated Hospital of Hunan Normal University), Changsha 410005; 4 Emergency Intensive Care Unit, Hunan Provincial Peoples Hospital (The First-Affiliated Hospital of Hunan Normal University), Changsha 410005)
Abstract Objective To analyze the pharmacokinetics/pharmacodynamics (PK/PD) characteristics and neurotoxicity of tigecycline intraventricular injection and predict its clinical efficacy and safety to provide a feasible reference for a clinical therapeutic regimen. Methods ? The PK of tigecycline in cerebrospinal fluid (CSF) was investigated by performing therapeutic drug monitoring (TDM) for an extensively drug-resistant (XDR) Acinetobacter baumannii (A. baumannii) intracranial infection patients with intraventricular injecting tigecycline. The concentration of tigecycline was determined by two-dimensional high performance liquid chromatography (2D-HPLC). The PD of tigecycline was investigated with its minimum inhibitory concentration (MIC) against XDR A. baumannii. The CCK-8 assay was used to evaluate the cytotoxicity of different concentrations of tigecycline effect on PC12 cells, and the apoptosis assay was performed using flow cytometry. Results After a dose of 5 mg tigecycline, Cmax in CSF was 37.894 mg/L which was high above the MIC value of 2 mg/L. The area under the curve of 0 to 12 hours (AUC0-12h) was 200.6 mg·h/L. The t1/2 of tigecycline was estimated to be 2.73 hours, indicating the intraventricular injection frequency at least twice daily. Steady-state Cmax of simulated multi-dose tigecycline was 55 mg/L. Tigecycline significantly decreased cell viability as assessed and induced apoptosis of the PC12 cell. The IC50 value of PC12 cells treated with tigecycline was about 51.35 mg/L. When the concentration of tigecycline was 40 mg/L, close to Cmax, the growth inhibition rate and apoptosis induction rate of PC12 cells were 41.33% and 4.58%, respectively. Conclusion Intraventricular injection of tigecycline is a promising method for treating XDR A. baumannii intracranial infection. Since a high concentration of tigecycline in CSF may have potential neurotoxicity, each dose of tigecycline is better to be less than 5 mg. Intraventricular injection of tigecycline must be selected cautiously and best carried out under TDM.
Key words Tigecycline; Intraventricular injection; XDR A. baumannii; Intracranial infection; TDM
顱內感染是一種嚴重的、進展迅速、致死率高的難治性疾病。由于存在血腦屏障,大多數抗生素無法進入中樞神經系統(central nervous system, CNS)發揮有效的抗菌作用。近年來,神經外科手術后相關的鮑曼不動桿菌腦膜炎和腦室炎越來越多地被報道[1-3]。其高致殘率和致死率,以及可供選擇的敏感抗生素很少,為抗感染治療帶來了嚴峻挑戰。根據中國抗菌藥物監測網(China antimicrobial surveillance network, CHINET)的數據,約80%的鮑曼不動桿菌菌株對亞胺培南和美羅培南耐藥;大多數耐藥菌株僅對替加環素和多黏菌素B敏感[4]。然而,靜脈注射替加環素和多黏菌素B的腦脊液滲透性差,無法治療顱內感染。腦室內或鞘內給藥是一種繞過血腦屏障和其他限制藥物進入大腦的機制的方法[5]。
目前國際共識指南推薦治療XDR A. baumannii顱內感染僅有的方法為腦室內或鞘內注射黏菌素[6]。 其中甲磺酸黏菌素(colistin methanesulfonate, CMS)藥代動力學不穩定,多黏菌素B安全性和有效性循證依據相對較少。另一種敏感抗生素替加環素有可能成為腦室內或鞘內注射替代或聯用的選擇。靜脈注射替加環素在體內分布廣泛,尤其在肺部和腹腔中濃度較高,但難以透過血腦屏障。目前已有一些腦室內或鞘內注射替加環素治療顱內感染成功的案例報道[7-9],在這些案例中未發現嚴重不良反應。然而,腦室內或鞘內注射替加環素是超說明書用藥;給藥劑量和使用頻率沒有公認的指南推薦。由于缺乏大樣本研究,其有效性和安全性可能存在偏差。
腦室內或鞘內注射藥物必須謹慎,要充分考慮其有效性和安全性[5]。腦室內或鞘內注射抗菌藥物的療效與PK/PD有關,在評價替加環素治療肺部感染時,國內外文獻通常以游離AUC與MIC的比值(fAUC0~24h /MIC)作為PK/PD 參數,其中“f”為替加環素游離血藥濃度的系數[10-11]。由于血腦屏障的存在,腦室注射的PK與血藥濃度的關系較小,目前尚無公認的腦室注射PK/PD評價標準,故根據CSF中替加環素濃度是否高于MIC值來預測療效。腦室內或鞘內注射藥物的安全性很大程度與藥物的神經毒性相關。目前在少數成功的個案中有腦脊液替加環素PK的報道[12-13],但還沒有關于替加環素神經毒性的公開數據。因此,本研究為接受腦室內注射替加環素治療XDR A. baumannii顱內感染患者進行了TDM,根據濃度-時間曲線和MIC值評估腦室內注射替加環素的療效。同時通過CCK-8法檢測PC12細胞在不同濃度替加環素作用下的存活率和流式細胞儀測定凋亡率,評價替加環素的神經毒性。根據上述結果為腦室內注射替加環素治療顱內感染提出可行性建議。
1 材料與方法
1.1 替加環素在CSF中的PK
1.1.1 替加環素TDM
12歲男童既往體健,因突發顱內巨大動靜脈畸形破裂出血破入腦室患者接受雙側腦室鉆孔引流術+全腦血管造影腦血管畸形介入栓塞術,術后經痰培養及腦脊液細菌培養先后確診為肺部及顱內XDR A. baumannii感染,替加環素敏感(MIC值2 mg/L)。經靜脈注射替加環素50 mg q12 h治療3 d感染未控制,遂經腦室引流管注入替加環素5 mg,給藥后夾緊引流管1 h后打開,在給藥后1、6、8和12 h自引流管抽取腦脊液3 mL測定替加環素濃度。
1.1.2 腦脊液樣本處理
將腦脊液置于渦旋混合器(上海青浦西儀器廠XW-80A)離心5 min(3000 r/min),然后提取200 μL上清液,并將其放置在Eppendorf管和200 μL高氯酸(10%)中以沉淀蛋白質。將試管旋轉1 min并離心8 min
(14500 r/min),然后將上清液300 μL和醋酸銨(5.0 mol/L)
20 μL添加到注射瓶中,并旋轉60 s。最后將200 μL注入島津LC-20 A二維液相儀系統,使用外標法進行定量分析。
1.2 替加環素對PC12細胞的細胞毒作用
1.2.1 PC12細胞培養
PC12細胞為大鼠腎上腺棕色細胞瘤細胞系,從中國科學院細胞庫(中國上海)獲得,傳代數為10。PC12細胞在添加10%小牛血清、100IU/mL青霉素和100μg/mL鏈霉素的1640培養基中于37 ℃、含5% CO2的增濕空氣中培養。細胞單層接種于96孔板中[14]。
1.2.2 CCK-8測定
PC12細胞在100 μL 1640培養基中以每孔5×103個細胞的速度接種在96孔板中,在37 ℃(5% CO2)孵育24 h至對數生長期。加入適當濃度替加環素(Wyeth,AMSU/12)的新鮮培養基培養24 h。去除細胞上清液,加入100 μL CCK-8:PBS(1:9)稀釋液中培養1.5 h。使用微孔板讀取器測量450 nm波長處的光吸收率。細胞活力以檢測到的吸光度與不含替加環素的對照組比較的百分率表示。用倒置顯微鏡(日本Olympus)觀察細胞并拍照。
1.2.3 ?細胞凋亡測定
將PC12細胞(按底部面積20%計算)置于6孔板中,于37 ℃(5% CO2)培養過夜。當細胞生長到大約50%到60%時,加入不同濃度的替加環素并培養24 h。用PBS清洗細胞后,以1000 r/min的轉速離心5 min,并重復3次。收集細胞并在100 μL磷酸鹽緩沖液中重新懸浮,與2.5 μL Annexin V-FITC和5 μL PI(50 μg/mL)孵育5 min,并通過流式細胞術進行分析。
1.3 替加環素多劑給藥時的PK和細胞毒性預測
多劑PK預測:基于替加環素單劑量給藥數據,建立一房室模型。房室模型參數估算結束后,模擬多劑給予替加環素時的血漿PK。細胞毒性預測:首先根據1.2節數據建立S型Emax模型,描述替加環素濃度與PC12細胞活性之間關系。然后,將替加環素多劑 PK曲線數據代入S型Emax模型,從而獲得替加環素靜注5 mg q12 h方案下的全程PD曲線(PC12細胞活性-時間曲線)。用Phoenix WinNonlin軟件8.3版(美國Cetara公司)執行這些工作。
1.4 統計學方法
相關測量數據以平均差±標準差(x±s)表示,并使用SPSS軟件(17.0,美國IBM公司)進行分析。采用t檢驗對數據進行評估。P<0.05被認為具有統計學意義。
2 結果
2.1 替加環素在CSF中的PK
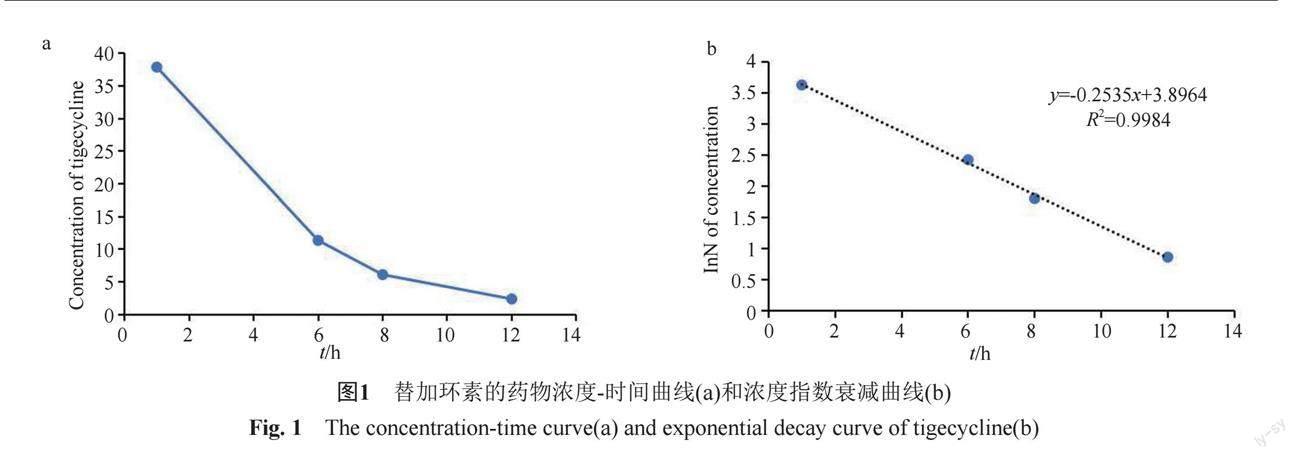
腦室內注射后1、6、8和12 h收集腦脊液中測得替加環素濃度分別為37.89、11.36、6.11和2.38 mg/L(圖1a),AUC0-12h為200.6 h·mg/L。根據Cmax計算CSF表觀分布體積約為132 mL。替加環素濃度隨時間的指數衰減曲線如圖1b所示。計算腦脊液中替加環素的t1/2為2.73 h。
2.2 替加環素對PC12細胞的細胞毒作用
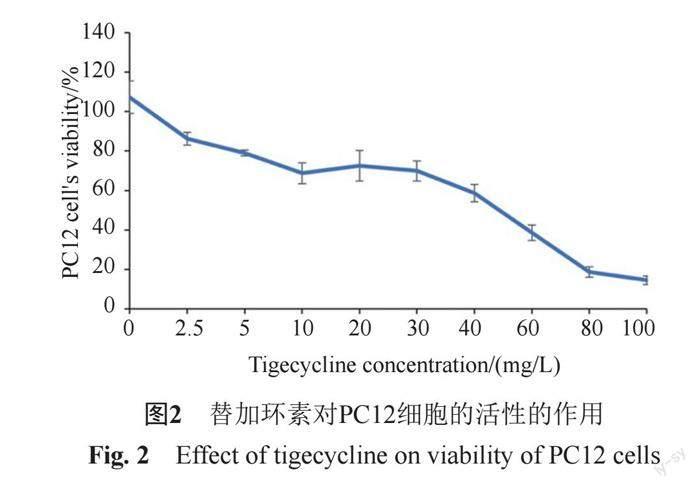
如圖2所示,在一定濃度范圍內,替加環素以劑量依賴性方式誘導PC12細胞的細胞活力顯著降低。在20~100 mg/L之間替加環素之間存在明顯的線性關系。經計算IC50值為51.35 mg/L,計算公式見圖3。
與對照組(圖4a)相比,替加環素組(圖4b)的細胞數量顯著減少。對照組細胞胞體成梭形、錐形或多角形,胞核明顯,突起較長,而對照組細胞皺縮,突起變短,可見細胞碎片。
如圖5所示,對照組PC12細胞也有一定比例的凋亡。不同濃度的替加環素處理24 h后,PC12細胞凋亡率均有不同程度的增加,與對照組相比差異有統計學意義(P<0.05)。相同濃度下替加環素凋亡率遠低于細胞生長抑制率。生長抑制率=(1-替加環素組吸光度/對照組吸光度)×100%。
2.3 替加環素多劑給藥對PC12細胞的藥動學和細胞毒性預測
2.3.1 多劑給藥時的PK曲線預測
如圖6所示,通過模擬5 mg q12 h連續3 d給藥后,替加環素在腦脊液中藥時曲線從第二劑給藥后就進入穩態。在穩態階段,替加環素Cmax約為55 mg/L,Cmin約為2.6 mg/L,AUC0-12h=195 h·mg/L,坪濃度Cav=16.3 mg/L,蓄積因子R為1.05,屬于輕度蓄積。Vss=0.10 L, CLss=0.026 L/h。
2.3.2 細胞毒性預測
由圖7可見,在穩態階段,給藥后,替加環素對PC12細胞毒性主要在給藥后3 h內,從給藥后4 h開始(此時替加環素仍有濃度,約為13 mg/L),PC12細胞活性基本恢復正常。
3 討論
替加環素是治療碳青霉烯類耐藥革蘭陰性桿菌,尤其是XDR A. baumannii的重要藥物。治療XDR A. baumannii感染通常需要2或3種抗菌藥物的聯合。根據美國傳染病學會和歐洲臨床微生物學和傳染病學會的建議,對于嚴重和高危碳青霉烯類耐藥A. baumannii感染的患者,建議使用包括多黏菌素、氨基糖苷、替加環素和舒巴坦鈉制劑等中的至少兩種體外活性抗生素的聯合治療(條件推薦,極低證據)[15-16]。一些研究表明,以替加環素為基礎,與舒巴坦復方制劑、碳青霉烯類抗生素或多黏菌素B聯合使用,對XDR A. baumannii具有協同抗菌作用[17-18]。然而,由于血腦屏障的限制,靜脈注射替加環素無法用于治療顱內感染。 根據神經外科中樞神經系統感染診治中國專家共識(2021版),建議靜脈注射結合鞘內或腦室內注射治療鮑曼不動桿菌引起的神經系統感染(強推薦,低證據)[19]。目前鞘內注射多黏菌素B 5 mg/d是國際公認的推薦劑量,然而替加環素并沒有公認的推薦劑量。根據中國專家共識,替加環素推薦劑量為每12 h 1~10 mg。這個劑量范圍比較大,不夠精確。循證學證據也只是基于少數病例報告,證據級別相對較低,給藥方案的安全性和有效性缺乏充分客觀依據。筆者希望通過一系列體內和體外研究,分析腦室內注射替加環素治療XDR A. baumannii顱內感染的可行性,以及安全、有效的給藥劑量和給藥頻率。
由于注射后1 h樣本為引流管打開的第一時間取樣,濃度最高,Cmax為37.894 mg/L,遠高于細菌培養及藥敏試驗測得的替加環素MIC值。一些指南建議,顱內注射抗菌藥物的劑量和間隔時間應根據腦脊液抗菌藥物濃度調整至致病菌MIC的10~20倍(強推薦、低證據)[20],提示腦室內注射替加環素5 mg可以達到理想的抗菌初始濃度。注射后12 h的濃度為
2.38 mg/L,略高于MIC值。由于患者僅實施腦室內注射2次治療后轉院,未能測量多次注射后的穩態濃度。通過Phoenix WinNonlin模擬多次給藥達到穩態階段后,替加環素Cmax和Cmin分別約為55 mg/L和2.6 mg/L,
峰谷濃度之間的差距較大。在Wu等[13]的研究中,替加環素靜脈注射/腦室內注射(IV/ICV)聯合給藥時,3種不同劑量40 mg IV/10 mg ICV、45 mg IV/5 mg ICV和50 mg IV/1 mg ICV的,腦脊液中替加環素的谷濃度分別為2.886、1.290和0.313 mg/L。在腦室內注射
12 h后測得的濃度2.38 mg/L與介于45 mg IV/5 mg ICV和40 mg IV/10 mg ICV的谷濃度之間。根據替加環素濃度指數衰減計算得出的半衰期約為2.73 h。上述結果顯示,腦室內注射替加環素5 mg至少每天兩次才能維持CSF中對XDR A. baumannii的MIC,這與指南推薦q 12 h給藥是一致的。如果要達到更理想的治療濃度,可能需要進一步增加給藥頻次。遺憾的是,本研究中沒有收集引流袋中的CSF,無法評估替加環素濃度下降通過引流管丟失的還是在顱內代謝的。在今后的研究中,需在這方面做更多的數據收集。本文對于替加環素腦室內注射的療效評估基于藥動學個案分析,實際的治療效果還需要結合TDM觀察更多臨床案例。
腦室內或鞘內注射可使藥物在腦脊液中達到高濃度,而藥物對神經細胞的損害是不可逆轉的,所以研究替加環素的神經毒性非常必要。PC12細胞來源于可移植的小鼠嗜鉻細胞瘤,由神經生長因子誘導分化為神經內分泌細胞,它是研究藥物神經毒性的常見細胞株之一。本研究評估了不同濃度的替加環素對PC12細胞的生長抑制作用。如CCK-8試驗所示,替加環素誘導PC12細胞的細胞活力降低呈劑量依賴性,尤其是當濃度在20~100 μg/mL之間時細胞活力呈直線性下降,因此,替加環素可能存在潛在的神經毒性。流式細胞術分析表明,隨著替加環素濃度的增加,細胞凋亡率逐漸增加。但是在相同的替加環素濃度下,PC12細胞凋亡率遠低于細胞生長抑制率,提示凋亡可能不是替加環素抑制神經細胞生長的主要方式,具體機制還需要進一步研究。患者腦室內注射替加環素過程中未發生明顯不良反應,隨訪時未見神經系統后遺癥,筆者認為腦室內注射5 mg替加環素劑量是相對安全的。腦室內注射5 mg替加環素的Cmax為37.894 mg/L,表觀分布體積與正常情況下人CSF的總量(130~150 mL)相當。由此推斷腦室內注射替加環素的Cmax可以根據單次劑量與腦脊液容量比值來估計,這對研究藥物單次最大劑量的安全性非常有意義。與IC50值相比,CSF中替加環素Cmax越低越安全。替加環素對PC12的IC50為51.35 mg/L,單次腦室內注射5 mg替加環素Cmax與之差距較小,通過模擬多劑給藥的PK,預測穩態Cmax 為55 mg/L,已超過IC50值,可能需要減少單次劑量來降低峰值濃度,以減少神經毒性。通過擬合多劑給藥時間-濃度曲線和細胞活性曲線,達到穩態階段后,替加環素對PC12細胞毒性主要集中在給藥后3 h內,提示臨床在注射藥物后的3 h應密切觀察。誠然,神經系統包含許多相互作用不同的細胞,是一個復雜的系統。一種類型的細胞的研究并不代表整個神經系統[21],還需要研究更多類型的神經細胞,以確定替加環素的神經毒性。
綜上所述,腦室內注射替加環素可能是治療鮑曼不動桿菌顱內感染的一種很有前景的方法。但是高濃度的替加環素可能具有潛在的、不可逆的神經毒性作用。筆者不推薦替加環素作為腦室注射治療
A. baumannii顱內感染的首選藥物。如果作為最后手段添加,每次劑量最好少于5 mg,每天給藥頻次不少于2次。腦室內注射最好在TDM下進行,以確保安全和有效。
倫理聲明:本研究獲得湖南省人民醫院醫學倫理委員會批準(2022 Scientific Research Ethics Review NO: 15 )。
參 考 文 獻
Hussein K, Rabino G, Feder O, et al. Risk factors for meningitis in neurosurgical patients with cerebrospinal fluid drains: Prospective observational cohort study[J]. Acta Neurochir, 2019, 161(3): 517-524.
Long W, Yuan J, Liu J, et al. Multidrug resistant brain abscess due to Acinetobacter baumannii ventriculitis cleared by intraventricular and intravenous tigecycline therapy: A case report and review of literature[J]. Front Neurol, 2018, 9: 518.
夏為, 侯云生, 卞曉華. 顱腦手術后并發顱內多重/泛耐藥鮑曼不動桿菌感染24例治療總結[J]. 臨床誤診誤治, 2016, 29(7): 71-74.
Hu F, Guo Y, Yang Y, et al. Resistance reported from China antimicrobial surveillance network (CHINET) in 2018[J]. Eur J Clin Microbiol, 2019, 38(12): 2275-2281.
Cook A M, Mieure K D, Owen R D, et al. Intracerebroventricular administration of drugs[J]. Pharmacotherapy, 2009, 29(7): 832-845.
Tsuji B T, Pogue J M, Zavascki A P, et al. International Consensus Guidelines for the Optimal Use of the Polymyxins: Endorsed by the American College of Clinical Pharmacy (ACCP), European Society of Clinical Microbiology and Infectious Diseases (ESCMID), Infectious Diseases Society of America (IDSA), International Society for Anti-infective Pharmacology (ISAP), Society of Critical Care Medicine (SCCM), and Society of Infectious Diseases Pharmacists (SIDP)[J]. Pharmacotherapy, 2019, 39(1): 10-39.
Lauretti L, D'Alessandris Q G, Fantoni M, et al. First reported case of intraventricular tigecycline for meningitis from extremely drug-resistant Acinetobacter baumannii[J]. J Neurosurg, 2017, 127(2): 370-373.
Deng Z W, Wang J, Qiu C F, et al. A case report of intraventricular and intrathecal tigecycline infusions for an extensively drug-resistant intracranial Acinetobacter baumannii infection[J]. Medicine (Baltimore), 2019, 98(15): e15139.
Li W, Li D, Yin B, et al. Successful treatment of pyogenic ventriculitis caused by extensively drug-resistant Acinetobacter baumannii with multi-route tigecycline: A case report[J]. World J Clin Cases, 2021, 9(3): 651-658.
司徒冰, 鄭培英, 王穎, 等. 替加環素治療泛耐藥鮑曼不動桿菌所致醫院獲得性肺炎的PK/PD研究[J]. 中國新藥雜志, 2018, 27(10): 1153-1158.
Xie J, Roberts J A, Alobaid A S, et al. Population pharmacokinetics of tigecycline in critically ill patients with severe infections[J]. Antimicrob Agents Chemother, 2017, 61(8): e00345-17.
Xing H, Cheng C, Zhang Y, et al. Successful treatment with intrathecal and intravenous polymyxin b-based combination against MDR Acinetobacter baumannii meningitis in pediatric patient: A case report[J]. Front Pediatr, 2021, 9: 564991.
Wu Y, Chen K, Zhao J, et al. Intraventricular administration of tigecycline for the treatment of multidrug-resistant bacterial meningitis after craniotomy: A case report[J]. J Chemother, 2018, 30(1): 49-52.
Chen i, Tang M, Liu M, et al. Neferine and lianzixin extracts have protective effects on undifferentiated caffeine-damaged PC12 cells[J]. BMC Complement Med Ther, 2020, 20(1): 76.
Tamma P D, Aitken S L, Bonomo R A, et al. Infectious diseases society of america guidance on the treatment of ampc beta-lactamase-producing enterobacterales, carbapenem-resistant Acinetobacter baumannii, and Stenotrophomonas maltophilia infections[J]. Clini Infect Dis, 2022, 74(12): 2089-2114.
Paul M, Carrara E, Retamar P, et al. European Society of Clinical Microbiology and Infectious Diseases (ESCMID) guidelines for the treatment of infections caused by multidrug-resistant Gram-negative bacilli (endorsed by European society of intensive care medicine)[J]. Clin Microbiol Infect, 2021, 28(4): 521-547.
Petersen P J, Labthavikul P, Jones C H, et al. In vitro antibacterial activities of tigecycline in combination with other antimicrobial agents determined by chequerboard and time-kill kinetic analysis[J]. J Antimicrob Chemother, 2006, 57(3): 573-576.
Sopirala M M, Mangino J E, Gebreyes W A, et al. Synergy testing by Etest, microdilution checkerboard, and time-kill methods for pan-drug-resistant Acinetobacter baumannii[J]. Antimicrob Agents Ch, 2010, 54(11): 4678-4683.
中國醫師協會神經外科醫師分會神經重癥專家委員會,北京醫學會神經外科學分會神經外科危重癥學組. 神經外科中樞神經系統感染診治中國專家共識(2021版)[J]. 中華神經外科雜志, 2021, 37(1): 2-11.
Tunkel A R, Hasbun R, Bhimraj A, et al. 2017 infectious diseases society of America's clinical practice guidelines for healthcare-associated ventriculitis and meningitis[J]. Clin Infect Dis, 2017, 64(6): e34-e65.
Annabi E, Salem I B, Abid-Essefi S. Acetamiprid, a neonicotinoid insecticide, induced cytotoxicity and genotoxicity in PC12 cells[J]. Toxicol Mech Methods, 2019, 29(8): 580-586.

