銅綠假單胞菌群體感應(yīng)系統(tǒng)及其抑制劑的研究進(jìn)展
周志蓮 周彤 周秀娟 龍坤蘭 陳駿 張傳濤 高培陽(yáng)
摘要:抗生素的過(guò)度使用導(dǎo)致了“超級(jí)細(xì)菌”的出現(xiàn),銅綠假單胞菌是引起醫(yī)療相關(guān)感染的機(jī)會(huì)致病菌之一。銅綠假單胞菌臨床分離株對(duì)常用抗菌藥物的耐藥性已成為嚴(yán)重的公共衛(wèi)生問(wèn)題。銅綠假單胞菌的致病性和耐藥性被一種稱為“群體感應(yīng)”的復(fù)雜機(jī)制調(diào)節(jié),其調(diào)節(jié)毒力因子的產(chǎn)生、生物膜形成、細(xì)菌對(duì)抗生素的耐藥性、細(xì)菌運(yùn)動(dòng)等等,并可減弱宿主的免疫應(yīng)答。群體感應(yīng)抑制劑(quorum sensing inhibitors, QSIs)可以在不影響細(xì)菌生長(zhǎng)的情況下降低細(xì)菌毒性,并可抑制和消除生物膜,增加抗生素對(duì)細(xì)菌的敏感性。這些特性使QSIs成為目前研發(fā)抗感染和輔助抗感染藥物的熱點(diǎn),本文就銅綠假單胞菌的群體感應(yīng)系統(tǒng)和銅綠假單胞菌QSIs的研究進(jìn)展進(jìn)行了綜述。
關(guān)鍵詞:群體感應(yīng)系統(tǒng);銅綠假單胞菌;群體感應(yīng)抑制劑
中圖分類號(hào):R978.1 ?文獻(xiàn)標(biāo)志碼:A
Study on quorum sensing system and its inhibitors of Pseudomonas aeruginosa
Zhou Zhilian, Zhou Tong, Zhou Xiujuan, Long Kunlan, Chen Jun, Zhang Chuantao, and Gao Peiyang
(Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610072)
Abstract The overuse of antibiotics has led to the emergence of "superbacteria". Pseudomonas aeruginosa is one of the opportunistic pathogens that causes medical-related infections. The resistance of clinical isolates of Pseudomonas aeruginosa to commonly used antibiotics has become a serious public health problem. The pathogenicity and drug resistance of Pseudomonas aeruginosa are regulated by a complex mechanism called “quorum sensing”. Quorum sensing regulates the production of virulence factors, biofilm formation, bacterial resistance to antibiotics, bacterial movement and so on, and can weaken the immune response of the host. Quorum sensing inhibitors (QSIs) can reduce bacterial toxicity without affecting bacterial growth, as well as inhibiting and eliminating biofilm, thus increasing the sensitivity of antibiotics to bacteria. These characteristics make QSIs a key focus in research into the development of anti-infective and adjuvant anti-infective drugs. This paper reviews the quorum sensing system of Pseudomonas aeruginosa and summarises progress in research into Pseudomonas aeruginosa QSIs.
Key words Quorum sensing system; Pseudomonas aeruginosa; Quorum sensing inhibitors
抗生素濫用導(dǎo)致的抗生素耐藥性(antimicrobial resistance, AMR)已成為全球公共衛(wèi)生問(wèn)題。最近的一項(xiàng)評(píng)估估計(jì),如果全球繼續(xù)忽視AMR問(wèn)題,到2050年,由此導(dǎo)致的人類死亡將達(dá)到1000萬(wàn)[1],銅綠假單胞菌(Pseudomonas aeruginosa, PA)是一種運(yùn)動(dòng)型、帶有單極鞭毛、需氧的芽胞桿菌[2],是醫(yī)院常見(jiàn)的機(jī)會(huì)致病菌之一,可引起多系統(tǒng)感染,包括消化系統(tǒng)、呼吸系統(tǒng)等。由于抗生素的濫用,多重甚至泛耐藥銅綠假單胞菌的出現(xiàn)給臨床治療帶來(lái)了巨大挑戰(zhàn)[3-4]。研究顯示,銅綠假單胞菌的致病性和耐藥性與群體感應(yīng)(quorum sensing, QS)有關(guān)。QS是廣泛存在于細(xì)菌群體中的一種依賴細(xì)菌密度的信號(hào)系統(tǒng)[5],可調(diào)節(jié)多種生物學(xué)特性,包括毒力基因的表達(dá)、細(xì)菌的運(yùn)動(dòng)及生物膜的形成[6]。最近,QS過(guò)程的抑制劑,群體猝滅(quorum quenching,QQ)酶和群體感應(yīng)抑制劑(quorum sensing inhibitors,QSIs),已被開(kāi)發(fā)用于降低細(xì)菌的毒力,從而在不干擾細(xì)菌生長(zhǎng)的情況下抑制細(xì)菌毒力因子[7],降低細(xì)菌耐藥性[8]。本綜述總結(jié)了銅綠假單胞菌的QS系統(tǒng)及其在生物膜形成過(guò)程中的作用。同時(shí),還總結(jié)了QSIs和QQ酶的最新發(fā)展,作為設(shè)計(jì)新抗菌劑的可能策略。
1 群體感應(yīng)系統(tǒng)與PA的群體感應(yīng)系統(tǒng)
1.1 群體感應(yīng)系統(tǒng)
群體感應(yīng)是細(xì)胞與細(xì)胞之間的通訊方式[9],廣泛存在于自然界的微生物中,是一個(gè)依賴于細(xì)菌密度的基因調(diào)控系統(tǒng)[5]。細(xì)菌在生長(zhǎng)過(guò)程中會(huì)產(chǎn)生和釋放一種稱為自誘導(dǎo)分子(auto inducers, AIs)的化學(xué)信號(hào)分子,其濃度隨著細(xì)菌種群密度的增加而增加,當(dāng)自誘導(dǎo)分子達(dá)到閾值后,就會(huì)與QS受體結(jié)合,調(diào)控多種基因的表達(dá)[10],從而調(diào)節(jié)毒力因子的生成、生物膜形成和胞外多糖等,使細(xì)菌作為一個(gè)能夠共同應(yīng)對(duì)周圍環(huán)境變化的群體,產(chǎn)生耐藥性和毒力等不良后果[11]。通過(guò)QS系統(tǒng)表達(dá)致病性和耐藥性包括以下步驟:①合成QS信號(hào)分子;②向環(huán)境釋放信號(hào)分子;③高密度的信號(hào)分子與膜受體的感應(yīng)和結(jié)合;④從細(xì)胞中提取受體信號(hào)復(fù)合物及其與啟動(dòng)子區(qū)的結(jié)合;⑤致病相關(guān)基因的轉(zhuǎn)錄[12]。大量研究發(fā)現(xiàn),不同的微生物通過(guò)不同的化學(xué)信號(hào)進(jìn)行群體感應(yīng):N-酰基高絲氨酸內(nèi)酯類(acylhomoserine lactones, AHLs)及其衍生物主要作用于革蘭陰性菌;氨基酸和短肽類(autoinducing peptides, AIPs)主要作用于革蘭陽(yáng)性菌;除這兩大類AIs外,還報(bào)道了各種微生物對(duì)多種信號(hào)分子的使用,如銅綠假單胞菌以假單胞菌喹諾酮類信號(hào)(Pseudomonas quinolone signal,PQS)為信號(hào)分子等[13]。
1.2 銅綠假單胞菌的群體感應(yīng)系統(tǒng)
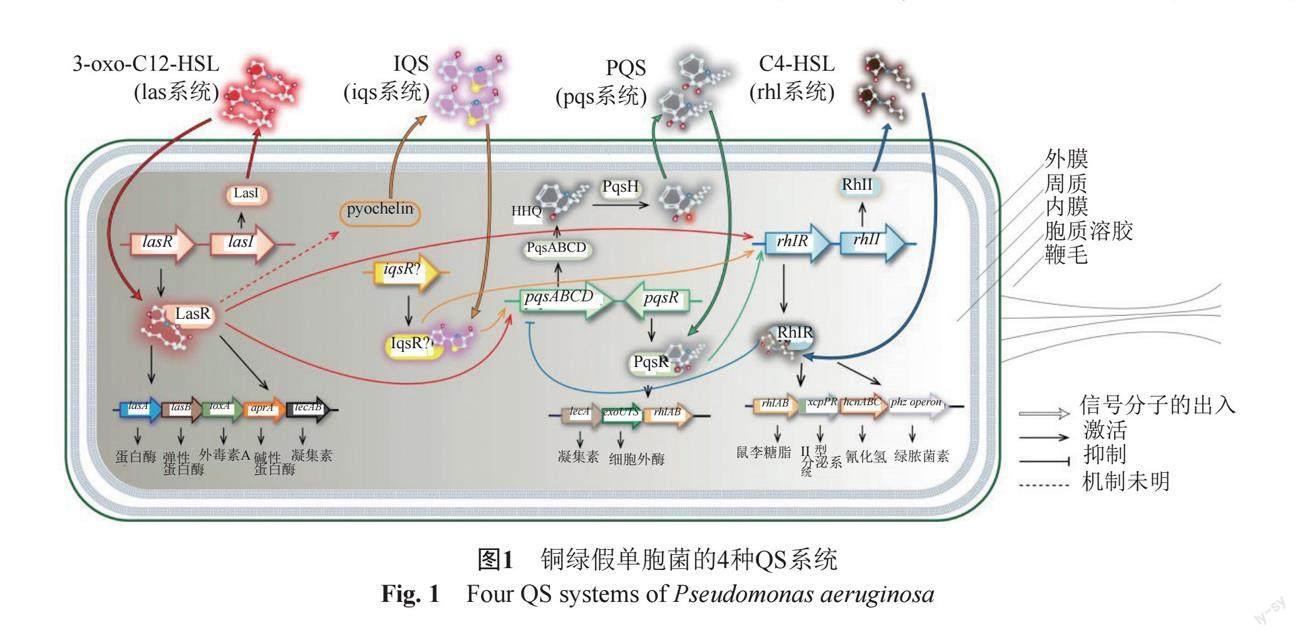
銅綠假單胞菌主要通過(guò)las系統(tǒng)、rhl系統(tǒng)和pqs系統(tǒng)介導(dǎo)群體感應(yīng),詳見(jiàn)圖1,其中l(wèi)as系統(tǒng)和rhl系統(tǒng)屬于AHLs介導(dǎo)的系統(tǒng),這類系統(tǒng)由LuxI合成酶和LuxR受體蛋白組成。具體來(lái)說(shuō),las系統(tǒng)由LasI合成酶和LasR受體蛋白組成,rhl系統(tǒng)由RhlI合成酶和RhlR受體蛋白組成。在las系統(tǒng)中,LasI合成3-氧十二烷酰高絲氨酸內(nèi)酯(N-(3-oxododecanoyl)-L-homoserine lactone, 3-oxo-C12-HSL)作為該系統(tǒng)的AIs,當(dāng)其達(dá)到閾值時(shí),與LasR結(jié)合后激活LasR受體蛋白并形成復(fù)合物L(fēng)asR-3OC12-HSL,直接或間接調(diào)控基因的表達(dá)。rhl系統(tǒng)和las系統(tǒng)的區(qū)別是其AIs為丁基高絲氨酸內(nèi)酯(N-Butanoylhomo Serine lactone, C4-HSL),其形成的復(fù)合物是RhlR-C4-HSL。第三個(gè)pqs系統(tǒng)是僅在銅綠假單胞菌中發(fā)現(xiàn)的,它使用烷基-4-(1H) 喹諾酮類化合物(alkyl-4-(1H)-Quinolones, AQS)作為信號(hào)分子,AQS包括2-庚基-3-羥基-4-喹諾酮(PQS)及其前體2-庚基-4-羥基喹啉(HHQ)。pqsABCD操縱子產(chǎn)生HHQ,HHQ經(jīng)PqsH催化轉(zhuǎn)化為PQS,而PqsR作為受體蛋白與信號(hào)分子結(jié)合以激活各種靶基因的轉(zhuǎn)錄[14]。研究表明las、rhl、pqs系統(tǒng)均可調(diào)節(jié)多種毒力因子的表達(dá),如胞外酶、次級(jí)代謝物和毒素。rhl、pqs系統(tǒng)還可以調(diào)節(jié)鼠李糖脂的生成[15]。除了這3個(gè)QS系統(tǒng)外,還存在第四種群體感應(yīng)系統(tǒng),稱為iqs系統(tǒng),它的信號(hào)分子被稱為IQS,iqs系統(tǒng)具有整合QS信號(hào)和應(yīng)激反應(yīng)方面的功能。iqs系統(tǒng)的中斷會(huì)干擾pqs和rhl介導(dǎo)的QS信號(hào)。在營(yíng)養(yǎng)充足的條件下iqs系統(tǒng)由las系統(tǒng)控制,其可通過(guò)限制磷酸鹽被激活。iqs系統(tǒng)可以在lasI或lasR基因突變的情況下調(diào)控las系統(tǒng),繼續(xù)發(fā)揮銅綠假單胞菌QS系統(tǒng)的調(diào)節(jié)作用[16]。然而,最近的一項(xiàng)研究證實(shí)IQS是一種銅綠醛,是綠膿菌素生物合成或降解的副產(chǎn)物[17]。
在銅綠假單胞菌的QS網(wǎng)絡(luò)中,各子系統(tǒng)彼此獨(dú)立而又相互關(guān)聯(lián),存在級(jí)聯(lián)調(diào)節(jié)機(jī)制。已有研究表明las系統(tǒng)中的lasRI基因位于其他系統(tǒng)的上游,是QS網(wǎng)絡(luò)系統(tǒng)的主控因子,啟動(dòng)lasRI基因后可上調(diào)其他系統(tǒng)基因的表達(dá)[18]。另外,pqsR和pqsH基因能夠被LasR-3OC12-HSL激活,而pqsABCD和pqsR又能被RhlR-C4-HSL抑制,PqsR-AQS信號(hào)分子AQS的分泌能夠進(jìn)一步上調(diào)rhlI和rhlR的表達(dá)[19]。總的來(lái)說(shuō),pqs系統(tǒng)與las和rhl系統(tǒng)相互聯(lián)系,形成緊密而又高效的信號(hào)傳遞與交流的通路,共同調(diào)節(jié)菌體生理特性。
2 QS系統(tǒng)調(diào)節(jié)PA生物膜形成,增加抗生素耐藥性
2.1 QS系統(tǒng)調(diào)節(jié)PA生物膜形成
銅綠假單胞菌QS網(wǎng)絡(luò)中的las、rhl和pqs系統(tǒng)調(diào)節(jié)多種促進(jìn)生物膜發(fā)育的分子產(chǎn)生,包括Pel多糖、鼠李糖脂、綠膿菌素、鐵載體pyoverdine和凝集素等。Pel多糖在維持生物膜生長(zhǎng)、成熟及結(jié)構(gòu)維持中起決定作用。鼠李糖脂是一種含有鼠李糖的糖脂化合物,在后期生物膜形成過(guò)程中維持細(xì)胞聚集物之間的開(kāi)放空間起著重要作用。綠膿菌素是一種有細(xì)胞毒性作用的次級(jí)代謝物,可誘導(dǎo)細(xì)胞裂解并將細(xì)胞DNA釋放形成胞外DNA(extracellular DNA, eDNA)eDNA是生物膜成分之一,它可以與綠膿菌素結(jié)合,增加溶液黏度,進(jìn)而增加生物膜基質(zhì)與周圍環(huán)境的相互作用,促進(jìn)細(xì)胞聚集。鐵載體pyoverdine是對(duì)鐵具有高親和力的熒光鐵載體,它可以在環(huán)境中固定鐵,并將其輸送到細(xì)胞中,鐵是生物膜形成的必要成分。凝集素(lectin, Lec)是位于外膜上的可溶性蛋白質(zhì),包括LecA和LecB,前者與半乳糖及其衍生物結(jié)合,后者與巖藻糖、甘露糖和含甘露糖的低聚糖結(jié)合。凝集素的這種黏附特性促進(jìn)細(xì)胞和胞外多糖停留在生長(zhǎng)的生物膜中,不僅有利于形成生物膜結(jié)構(gòu),還有利于黏附在上皮和黏膜等生物表面[17]。此外,核苷酸的第二信使,二磷酸鳥(niǎo)苷,是胞外聚合物(extracellular polymeric sub-stances, EPS)產(chǎn)生的關(guān)鍵調(diào)節(jié)因子,能使細(xì)菌細(xì)胞從能動(dòng)階段轉(zhuǎn)變?yōu)楣讨A段,并使粘附細(xì)胞處于生物膜狀態(tài)[20]。既往研究已經(jīng)證實(shí)QS信號(hào)分子可直接或間接地作用于二磷酸鳥(niǎo)苷,將復(fù)雜的環(huán)境信息信號(hào)轉(zhuǎn)換為一般細(xì)胞內(nèi)信號(hào),促進(jìn)生物膜形成[21]。總的來(lái)說(shuō),這種分子和細(xì)胞的交互作用再合并其他聚合物可促進(jìn)形成一個(gè)穩(wěn)固而成熟的生物膜[22]。
2.2 銅綠假單胞菌生物膜與抗生素耐藥性
銅綠假單胞菌以生物膜和浮游生物兩種形式存在,PA以生物膜的形式生長(zhǎng)時(shí)表現(xiàn)出許多不同于浮游細(xì)胞的特性,一方面增強(qiáng)了對(duì)抗生素的耐藥性,另一方面還可以對(duì)抗宿主免疫系統(tǒng)[23],使得由PA生物膜引起的感染難以治療和根除[24]。PA的生物膜由EPS基質(zhì)包圍的細(xì)胞構(gòu)成,這種基質(zhì)包含多糖、脂類、蛋白質(zhì)、核酸和生物表面活性劑,它們有助于細(xì)胞的初始黏附,并為生物膜形成提供基本結(jié)構(gòu)。其中EPS基質(zhì)產(chǎn)生于生物膜發(fā)育后期高度自聚集時(shí)[20]。銅綠假單胞菌生物膜的形成包括4個(gè)主要步驟: 附著在表面,增殖,微菌落形成及成熟為一個(gè)結(jié)構(gòu)化的耐藥微生物群落[25]。
生物膜胞外多糖基質(zhì)作為一種擴(kuò)散屏障,阻止抗生素的擴(kuò)散,并固定抗生素。此外,擴(kuò)散障礙導(dǎo)致養(yǎng)分梯度的產(chǎn)生,使得細(xì)菌細(xì)胞的生長(zhǎng)在生物膜的不同區(qū)域有所不同。生長(zhǎng)在生物膜表面的細(xì)菌細(xì)胞代謝更加活躍,而內(nèi)部細(xì)胞生長(zhǎng)更加緩慢[26-27]。生物膜內(nèi)部細(xì)胞生長(zhǎng)速度下降和代謝活動(dòng)的減少使持久性細(xì)胞增加[28]。一些抗生素,如大多數(shù)β-內(nèi)酰胺類抗生素,僅對(duì)生長(zhǎng)中的細(xì)胞有效,而少數(shù)抗生素,如多黏菌素,對(duì)生長(zhǎng)條件差的細(xì)胞仍有殺傷作用[26],Baek等[29]還觀察到多黏菌素和環(huán)丙沙星聯(lián)用可以清除持久細(xì)胞。一般來(lái)說(shuō),較低濃度的抗生素就可以殺死大多數(shù)銅綠假單胞菌生物膜細(xì)胞,但是即便增加它們的濃度也不能殺死持久細(xì)胞[30]。因此,研究人員得出結(jié)論,生物膜細(xì)胞中只有一小部分負(fù)責(zé)增強(qiáng)抗生素抗藥性,大多數(shù)生物膜細(xì)胞對(duì)抗生素治療仍然敏感[27]。既往研究證實(shí),革蘭陰性菌生物膜中含有更多的持久細(xì)胞,可能是因?yàn)樗鼈兊募?xì)胞壁含有脂多糖,進(jìn)一步減弱了抗生素對(duì)細(xì)胞的滲透性[28]。
3 PA的群體感應(yīng)抑制劑
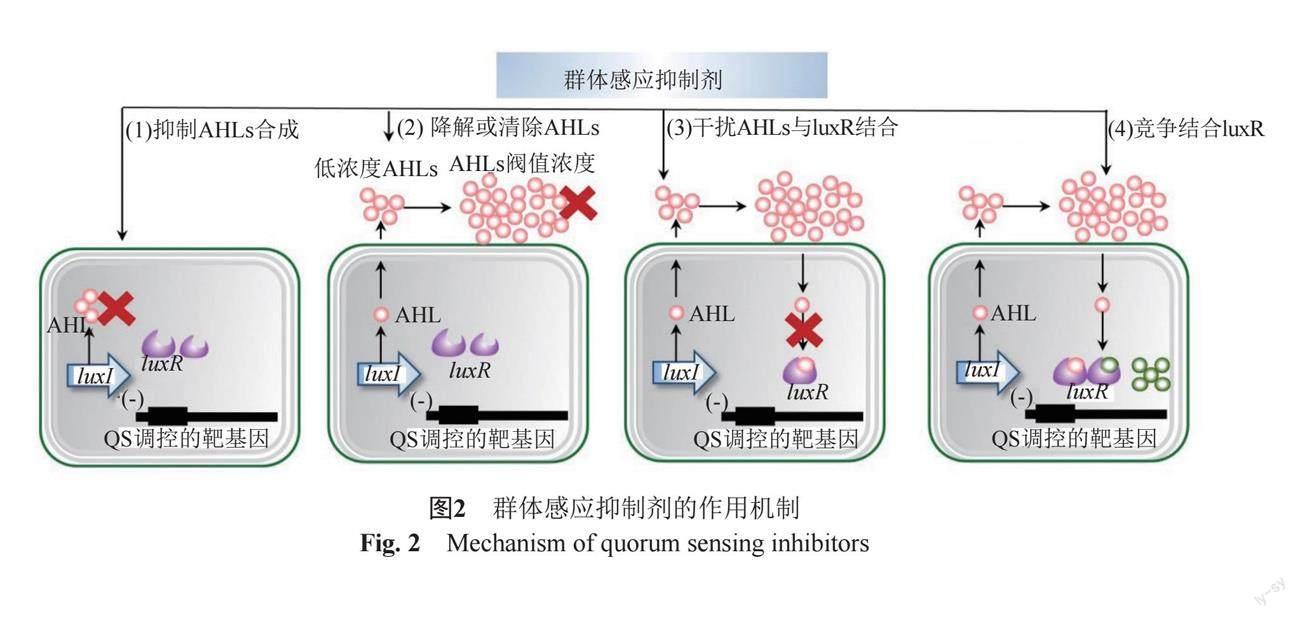
QS在銅綠假單胞菌的致病性和多重耐藥性中起著關(guān)鍵作用,它可以上調(diào)有關(guān)毒力基因、生物膜相關(guān)基質(zhì)基因、外排泵基因的表達(dá),不僅有助于銅綠假單胞菌的傳播,還可以提高銅綠假單胞菌對(duì)抗菌藥物的耐藥性。治療銅綠假單胞菌感染的一種有希望的新方法是在不殺死任何目標(biāo)細(xì)菌的情況下阻斷QS,近些年發(fā)現(xiàn)的QQ酶和QSIs可在不影響細(xì)菌生長(zhǎng)的前提下,大大降低銅綠假單胞菌的毒性。這一作用使其不易誘導(dǎo)細(xì)菌耐藥[31],因此此類藥物成為目前抗感染領(lǐng)域的研發(fā)熱點(diǎn)。QQ酶和QSIs通過(guò)不同的機(jī)制發(fā)揮作用(以AHL luxI/luxR調(diào)控機(jī)制為例,如圖2):①抑制信號(hào)分子的合成;②酶降解信號(hào)分子;③與信號(hào)分子競(jìng)爭(zhēng)結(jié)合相關(guān)受體位點(diǎn);④干擾信號(hào)分子與基因啟動(dòng)子的結(jié)合并抑制基因表達(dá);⑤通過(guò)抗體和環(huán)糊精等大分子清除AIs。最近,已經(jīng)報(bào)道了許多類型的QSIs,它們可以是人工合成的,也可以來(lái)自大自然中,從陸地、海洋到淡水生態(tài)系統(tǒng)[13]。QSIs由多種生物體產(chǎn)生,如植物、動(dòng)物、真菌或細(xì)菌。大多數(shù)已知的QSIs主要在植物和微生物中鑒定。這可能是由于對(duì)植物提取物和微生物的QSIs活性進(jìn)行了更多的篩選[32]。近年來(lái),人工合成的QSIs也越來(lái)越多地被報(bào)道。
3.1 人工合成QSIs
在銅綠假單胞菌的QS系統(tǒng)中,LasR位于級(jí)聯(lián)傳導(dǎo)的頂端,是銅綠假單胞菌多種QS系統(tǒng)的核心調(diào)節(jié)因子。因此,LasR蛋白是近年研究銅綠假單胞菌群體感應(yīng)抑制的熱門藥物靶點(diǎn)。Dalal等[33]篩選了大量潮霉素系列小分子,通過(guò)原子分子動(dòng)力學(xué)模擬和分子力學(xué)計(jì)算來(lái)描述它們抑制LasR蛋白的潛力。結(jié)果表明一部分潮霉素分子對(duì)LasR蛋白具有良好的結(jié)合親和力,并可以形成穩(wěn)定的LasR抑制劑復(fù)合物,這將有助于正在進(jìn)行的新抗生素研究。Aflakian等[34]通過(guò)人工合成設(shè)計(jì)了新的抗菌肽WSF、FASK和YDVD,通過(guò)與LasR蛋白的轉(zhuǎn)錄激活物結(jié)合,在銅綠假單胞菌的QS系統(tǒng)中干擾LasR,并進(jìn)一步抑制了生物膜生成、生物膜相關(guān)基因AlgC、PslA和PelA的表達(dá)和浮游銅綠假單胞菌生長(zhǎng)。
3.2 天然植物來(lái)源QSIs
除了人工合成化合物以及微生物次級(jí)代謝產(chǎn)物,天然植物及其次級(jí)化合物逐漸受到科學(xué)家們的重視,尤其是2015年之后,相關(guān)研究文獻(xiàn)激增[35]。大豆異黃酮(soy isoflavones, SI)是一組富含于大豆和其他豆類的酚類化合物,Yin等[36]通過(guò)體外實(shí)驗(yàn)發(fā)現(xiàn)SI與銅綠假單胞菌的AHLs有很好的競(jìng)爭(zhēng)性結(jié)合作用,對(duì)生物膜的形成,毒力因子、AHLs的產(chǎn)生以及QS相關(guān)基因的表達(dá)水平具有顯著的抑制作用。綠原酸(chlorogenic acid, CA)是一種在蔬菜、水果和中藥中含量豐富的酚類化合物,Xu等[37]將CA應(yīng)用于耐多藥銅綠假單胞菌臨床分離株的QQ試驗(yàn),發(fā)現(xiàn)綠原酸能夠下調(diào)lasI、lasR、rhlI、rhlR、pqsA和pqsR基因的表達(dá),抑制了耐多藥銅綠假單胞菌生物膜的形成,可以作為治療臨床銅綠假單胞菌感染的抗毒力因子。El-Sayed等[38]用70%乙醇萃取獲得綠茶提取物,通過(guò)體外實(shí)驗(yàn)證明其對(duì)PA的lasI、lasR、rhlI和rhlR基因轉(zhuǎn)錄有較強(qiáng)的抑制作用,其抑制率分別約為92%、96%、95%、95%和93%,并且,在亞MIC下,綠茶提取物對(duì)PA生物膜抑制率高達(dá)85%,這項(xiàng)研究表明未來(lái)有希望減少對(duì)抗生素的依賴。α-松油醇(α-terpineol, αT)是一種香料,是從松樹(shù)、茶樹(shù)等植物中提取的精油的組成部分。Bose等[39]使用含有αT的游離納米結(jié)構(gòu)脂質(zhì)載體(nanostructured lipid carriers, NLCs)作用于PA,體外實(shí)驗(yàn)發(fā)現(xiàn)αT-NLCs顯著降低PA的毒力基因rhlAB、aprA、lasB、toxA、plcH和關(guān)鍵QS基因las和rhl的表達(dá)水平。同時(shí)也顯著降低EPS、溶血素、彈性蛋白酶和綠膿菌素的產(chǎn)生,另外,還抑制了PA的游泳運(yùn)動(dòng)和生物膜形成。電子分析還表明,αT-NLCs對(duì)QS受體lasR、rhlR和pqsR有很強(qiáng)的結(jié)合親和力。基于αT-NLCs體外的強(qiáng)群體感應(yīng)抑制活性,Bose等[40]還以銅綠假單胞菌感染小鼠角膜炎為模型,探討了αT-NLCs對(duì)銅綠假單胞菌誘導(dǎo)的角膜炎的治療效果,具體來(lái)說(shuō),經(jīng)αT-NLCs治療后,角膜組織中的細(xì)菌數(shù)量顯著減少,并改善了角膜組織病理學(xué),減少了炎癥標(biāo)記物水平。這是少有的體內(nèi)實(shí)驗(yàn)的研究結(jié)果。松油烯-4-醇是αT的異構(gòu)體,是茶樹(shù)油中主要的單氧萜類活性成分,Bose等[41]觀察到松油素-4-醇、環(huán)丙沙星單獨(dú)使用均可抑制PA的毒力因子和生物膜的產(chǎn)生,并減少成熟生物膜的數(shù)量,另外,還觀察到松油烯-4-醇和環(huán)丙沙星聯(lián)用使PA的毒力因子的產(chǎn)生最大程度的降低。使QSI與抗生素聯(lián)用成為另一種治療感染的可能。
3.3 傳統(tǒng)中藥來(lái)源QSIs
此外,傳統(tǒng)中藥及其次級(jí)化合物在抑制QS方面的研究也在日益增多,如黃芩苷,姜辣素、姜烯酮、姜油酮(生姜的酚類化合物)及它們的衍生物,肉桂醛和丹皮酚等[1,42],已有相關(guān)綜述在前,不再贅述。值得一提的是,最近的研究顯示,肉桂醛和抗生素聯(lián)用表現(xiàn)出更強(qiáng)烈的群體感應(yīng)抑制活性,具體來(lái)說(shuō):肉桂醛單獨(dú)誘導(dǎo)lasB、rhlA和pqsA基因的抑制分別約為50%、60%和45%,而肉桂醛和妥布霉素聯(lián)合使用可降低lasR表達(dá)約70%,抑制rhlR和PQS分別為64.7%和69.4%。此外,與單獨(dú)作用相比,肉桂醛與黏菌素和肉桂醛與妥布霉素在生物膜抑制和預(yù)成生物膜分散中具有相加活性[43]。Subhaswaraj等[44]為了解決生物利用度問(wèn)題,開(kāi)發(fā)出亞MIC水平的肉桂醛包覆殼聚糖納米粒(cinnamaldehyde encapsulated chitosan nanopart-icles,CANPs),結(jié)果表明,與肉桂醛單獨(dú)使用相比,CANPs通過(guò)下調(diào)QS調(diào)節(jié)的毒力因子和相關(guān)的生物膜形成,顯示出更顯著的抗群體感應(yīng)活性,并可顯著抑制PA的游泳和群集運(yùn)動(dòng)。
4 總結(jié)和展望
生物膜相關(guān)感染治療困難,也更容易引起復(fù)發(fā),找到有針對(duì)性的治療措施,是臨床抗感染中急需解決的問(wèn)題,QQ酶和QSIs以細(xì)菌QS系統(tǒng)作為靶標(biāo)防治細(xì)菌感染,不僅可以減少毒力因子的產(chǎn)生,降低細(xì)菌致病性,還可以抑制生物膜的產(chǎn)生和清除成熟生物膜,增加抗生素對(duì)細(xì)菌的敏感性。如果在治療中較早使用,則會(huì)延遲甚至消除耐藥性,使其可能成為優(yōu)良的輔助抗菌藥物,越來(lái)越多的研究已經(jīng)證明抗生素和QSI合用可以發(fā)揮協(xié)同作用,不僅可以減少藥物的劑量和不良反應(yīng),還能延緩細(xì)菌耐藥速度。并且隨著納米技術(shù)與QSIs的碰撞,更是解決了傳統(tǒng)QSIs的生物利用度的問(wèn)題。由于QSIs并不殺死或抑制細(xì)菌生長(zhǎng),使得細(xì)菌不易產(chǎn)生抗藥性[45]。然而目前的研究成果大多還停留在體外試驗(yàn)和體內(nèi)動(dòng)物實(shí)驗(yàn),這些研究成果還需要進(jìn)一步驗(yàn)證,才能成功過(guò)渡并轉(zhuǎn)化為應(yīng)用醫(yī)學(xué),從而在臨床環(huán)境中對(duì)抗銅綠假單胞菌的感染。
參 考 文 獻(xiàn)
Chadha J, Harjai K, Chhibber S. Repurposing phytochemicals as anti-virulent agents to attenuate quorum sensing-regulated virulence factors and biofilm formation in Pseudomonas aeruginosa[J]. Microb Biotechnol, 2022, 15(6): 1695-1718.
Azam M W, Khan A U. Updates on the pathogenicity status of Pseudomonas aeruginosa[J]. Drug Discov Today, 2019, 24(1): 350-359.
Tamma P D, Aitken S L, Bonomo R A, et al. Infectious diseases society of America guidance on the treatment of extended-spectrum β-lactamase producing enterobacterales (ESBL-E), carbapenem-resistant Enterobacterales (CRE), and Pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa)[J]. Clin Infect Dis, 2021, 72(7): e169-e183.
陳美玲, 何曉靜, 菅凌燕. 銅綠假單胞菌的耐藥趨勢(shì)變化及治療進(jìn)展[J]. 中國(guó)抗生素雜志, 2022, 47(6): 543-549.
Miller M B, Bassler B L. Quorum sensing in bacteria[J]. Annu Rev Microbiol, 2001, 55(1): 165-199.
Chen J, Wang B, Lu Y, et al. Quorum sensing inhibitors from marine microorganisms and their synthetic derivatives [J]. Mar Drugs, 2019, 17(2): 80-107.
柏卜鸞, 李云鶴, 洪守強(qiáng), 等. 革蘭陰性病原菌毒力因子及抗毒力治療策略進(jìn)展[J]. 中國(guó)抗生素雜志, 2021, 46(2): 104-112.
Maeda T, Garc?a-contreras R, Pu M, et al. Quorum quenching quandary: resistance to antivirulence compounds [J]. ISME J, 2012, 6(3): 493-501.
Waters C M, Bassler B L. Quorum sensing: cell-to-cell communication in bacteria[J]. Annu Rev Cell Dev Biol, 2005, 21: 319-346.
Wang S, Payne G F, Bentley W E. Quorum sensing communication: Molecularly connecting cells, their neighbors, and even devices[J]. Annu Rev Chem Biomol Eng, 2020, 11: 447-468.
Dong Y H, Wang L H, Xu J L, et al. Quenching quorum-sensing-dependent bacterial infection by an N-acyl homoserine lactonase[J]. Nature, 2001, 411(6839): 813-817.
Durán N, Justo G Z, Durán M, et al. Advances in Chromobacterium violaceum and properties of violacein-its main secondary metabolite: A review[J]. Biotechnol Adv, 2016, 34(5): 1030-1045.
Kalia V C, Patel S K S, Kang Y C, et al. Quorum sensing inhibitors as antipathogens: Biotechnologic-al applications [J]. Biotechnol Adv, 2019, 37(1): 68-90.
Turkina M V, Vikstrom E. Bacteria-host crosstalk: Sensing of the quorum in the context of Pseudomonas aeruginosa infections[J]. J Innate Immun, 2019, 11(3): 263-279.
Chadha J, Harjai K, Chhibber S. Revisiting the virulence hallmarks of Pseudomonas aeruginosa: A chronicle through the perspective of quorum sensing[J]. Environ Microbiol, 2022, 24(6): 2630-2656.
Zender M, Witzgall F, Drees S L, et al. Dissecting the multiple roles of PqsE in Pseudomonas aeruginosa virulence by discovery of small tool compounds[J]. ACS Chem Biol, 2016, 11(6): 1755-1763.
Thi M T T, Wibowo D, Rehm B H A. Pseudomonas aeruginosa biofilms[J]. Int J Mol Sci, 2020, 21(22): 8671
高雅婷, 李曉霞, 段金菊. 銅綠假單胞菌的群體感應(yīng)系統(tǒng)及其抑制劑研究進(jìn)展[J]. 中國(guó)抗生素雜志, 2018, 43(11): 1338-1343.
Gokalsin B, Berber D, Sesal N C. Pseudomonas aeruginosa quorum sensing and biofilm inhibition[M]. Quorum Sensing. 2019: 227-256.
Friedman L, Kolter R, Two genetic loci produce distinct carbohydrate-rich structural components of the Pseudomonas aeruginosa biofilm matrix[J]. J Bacteriol, 2004, 186(14): 4457-4465.
Wu S, Liu J, Liu C, et al. Quorum sensing for population-level control of bacteria and potential therapeutic applications[J]. Cell Mol Life Sci, 2020, 77(7): 1319-1343.
Passos Da Silva D, Matwichuk M L, Townsend D O, et al. The Pseudomonas aeruginosa lectin LecB binds to the exopolysaccharide Psl and stabilizes the biofilm matrix[J]. Nat Commun, 2019, 10(1): 1-11.
Costerton J W, Lewandowski Z, Caldwell D E, et al. Microbial biofilms[J]. Annu Rev Microbiol, 1995, 49(1): 711-745.
Ghadaksaz A, Fooladi A A I, Hosseini H M, et al. The prevalence of some Pseudomonas virulence genes related to biofilm formation and alginate production among clinical isolates [J]. BMC Microbiol, 2015, 13(1): 61-68.
Whiteley M, Bangera M G, Bumgarner R E, et al. Gene expression in Pseudomonas aeruginosa biofilms [J]. Nature, 2001, 413(6858): 860-864.
Breidenstein E B, De La Fuente-nú?ez C, Hancock R E. Pseudomonas aeruginosa: All roads lead to resistance[J]. Trends Microbiol, 2011, 19(8): 419-426.
Drenkard E. Antimicrobial resistance of Pseudomonas aeruginosa biofilms[J]. Microbes Infect, 2003, 5(13): 1213-1219.
Sultana S T, Call D R, Beyenal H. Eradication of Pseudomonas aeruginosa biofilms and persister cells using an electrochemical scaffold and enhanced antibiotic susceptibility[J]. NPJ Biofilms Microbiomes, 2016, 2(1): 1-8.
Baek M S, Chung E S, Jung D S, et al. Effect of colistin-based antibiotic combinations on the eradication of persister cells in Pseudomonas aeruginosa[J]. J Antimicrob Chemother, 2020, 75(4): 917-924.
Brooun A, Liu S, Lewis K. A dose-response study of antibiotic resistance in Pseudomonas aeruginosa biofilms[J]. Antimicrob Agents Chemother, 2000, 44(3): 640-646.
Hemmati F, Salehi R, Ghotaslou R, et al. Quorum quenching: A potential target for antipseudomonal therapy[J]. Infect Drug Resist, 2020, 13: 2989-3005.
Mulat M, Pandita A, Khan F. Medicinal plant compounds for combating the multi-drug resistant pathogenic bacteria: A review[J]. Curr Pharm Biotechnol, 2019, 20(3): 183-196.
Dalal A, Kushwaha T, Choudhir G, et al. Computational investigations on the potential role of hygrophorones as quorum sensing inhibitors against LasR protein of Pseudomonas aeruginosa[J]. J Biomol Struct Dyn, 2022: 1-11.
Aflakian F, Rad M, Hashemitabar G, et al. Design and assessment of novel synthetic peptides to inhibit quorum sensing-dependent biofilm formation in Pseudomonas aeruginosa[J]. Biofouling, 2022: 1-16.
Ghosh S, Lahiri D, Nag M, et al. Phytocompound mediated blockage of quorum sensing cascade in ESKAPE pathogens[J]. Antibiotics, 2022, 11(1): 61.
Yin L, Zhang Y, Azi F, et al. Inhibition of biofilm formation and quorum sensing by soy isoflavones in Pseudomonas aeruginosa[J]. Food Control, 2022, 133: 108629.
Xu W, Zhang X, Wang L, et al. Effect of chlorogenic acid on the quorum-sensing system of clinically isolated multidrug-resistant Pseudomonas aeruginosa[J]. J Appl Microbiol, 2022, 132(2): 1008-1010
El-sayed N R, Samir R, Jamil M A H L, et al. Olive leaf extract modulates quorum sensing genes and biofilm formation in multi-drug resistant Pseudomonas aeruginosa[J]. Antibiotics (Basel), 2020, 9(9): 526.
Bose S K, Nirbhavane P, Batra M, et al. Nanolipoidal α-terpineol modulates quorum sensing regulated virulence and biofilm formation in Pseudomonas aeruginosa[J]. Nanomedicine, 2020, 15(18): 1743-1760.
Kumar B S, Sharma K, Chhibber S, et al. Therapeutic potential of nanolipoidal α-terpineol in combating keratitis induced by Pseudomonas aeruginosa in the murine model [J]. Int J Pharm, 2021, 594: 120175.
Bose S K, Chauhan M, Dhingra N, et al. Terpinen-4-ol attenuates quorum sensing regulated virulence factors and biofilm formation in Pseudomonas aeruginosa[J]. Future Microbiol, 2020, 15(2): 127-142.
Yang D, Hao S, Zhao L, et al. Paeonol attenuates quorum-sensing regulated virulence and biofilm formation in Pseudomonas aeruginosa[J]. Front Microbiol, 2021, 12: 692474.
Topa S H, Palombo E A, Kingshott P, et al. Activity of cinnamaldehyde on quorum sensing and biofilm susceptibility to antibiotics in Pseudomonas aeruginosa[J]. Microorganisms, 2020, 8(3): 455.
Subhaswaraj P, Barik S, Macha C, et al. Anti quorum sensing and anti biofilm efficacy of cinnamaldehyde encapsulated chitosan nanoparticles against Pseudomonas aeruginosa PAO1[J]. Lwt, 2018, 97: 752-759.
Zhang L, Tian T, Mei G. Quorum quenching, a new strategy for controlling plant bacterial diseases[J]. Chinese J Biolog Control, 2010, 26(3): 241-247.

