基于血液學參數的急性高原反應潛在預測指標的篩查分析*
葉 梓,劉鑫源,陳 郁,羅勇軍△
(1.陸軍軍醫大學陸軍衛勤訓練基地軍事醫學地理學教研室,重慶 400038;2.陸軍軍醫大學基礎醫學院學員四大隊,重慶 400038)
當人體快速暴露于高原環境(海拔超過2 500 m)時,如果低氧壓力超出了自身習服水平,則可能發生急性高原病,其中急性高原反應(acute mountain sickness,AMS)最為常見,表現為頭痛、頭暈、乏力、嘔吐等[1]。AMS通常在到達目的地域4~12 h后發生,可持續到第5天,這對有緊急任務的人員開展工作影響嚴重,且AMS進一步惡化可發展為高原腦水腫(high-altitude cerebral edema,HACE),死亡風險增加[2]。
然而,盡管AMS被研究了上百年,但其確切病因和發病機制仍不完全清楚,以低氧為核心的各類生理參數變化都被認為是AMS的潛在易感因素,包括肺通氣、血氧飽和度(blood oxygen saturation,SpO2)、心血管功能、血液學和代謝參數,其中SpO2被認為是最有前途的預測變量,已被許多研究證實與AMS發病風險呈明顯負相關[3],然而也有研究表明兩者并無相關性[4]。此外,參與氧氣運輸的血液學指標,包括紅細胞數(red blood cell count,RBC)、血紅蛋白(hemoglobin,Hb)水平、紅細胞比容(hematocrit,HCT)也被證實與AMS發生明顯相關[5],然而暴露時間和參數值范圍的不同,其相關性也存在很大差異。因此,本研究希望建立一個從平原到高原,并連續暴露于低氧環境的隊列,根據到達高原時是否出現AMS,連續觀測AMS和非AMS 2組人員在高原習服不同階段的生理代謝參數差異,從而篩查出可能對AMS的發生、發展有穩定預測價值的參數,并為進一步了解高原習服過程、探索AMS的潛在發生機制提供參考。
1 資料與方法
1.1 一般資料
46例健康平原漢族人于2019年7月在重慶(海拔500 m)招募。納入標準為20~30歲于重慶生活4年以上的健康男性,排除有嚴重呼吸系統疾病、心血管系統疾病、消化系統疾病患者,以及既往到達拉薩(海拔3 650 m)出現急慢性高原病史者。所有受試者通過低壓氧艙完成低氧預適應訓練(模擬海拔3 000 m,8 h/d,共2 d),并于在重慶出發前(CQ)采集基本生理和血液學參數。隨后32例乘坐火車(用時52 h),14例乘坐飛機(用時2 h)于同一天到達拉薩,于到達第2天(LS1)、第23天(LS2)、第44天(LS3)、第65天(LS4)采集相同生理和血液學參數,并根據LS1時填寫的2018版路易斯湖急性高山病評分系統(The 2018 Lake Louise Acute Mountain Sickness Score,LLS)量表評分將受試者分為AMS組與非AMS組。本研究獲本校醫學倫理委員會審查批準(2020第001-02號)。
1.2 方法
1.2.1基本生理參數采集
所有研究對象均簽署知情同意書,經專業人員調查其年齡、性別、民族、既往病史和急慢性高原病史等基本情況,并做體格檢查,記錄 BMI、血壓(blood pressure,BP)、心率(heart rate,HR)、SpO2等。BP、HR均為清晨空腹舒適狀態下靜坐至少15 min后進行測量,SpO2為靜坐后待數值穩定時的取值。隨后受試者由專業醫護人員統一采集5 mL靜脈血于高原特殊真空抗凝采血管中,采集完畢后立即送往西藏阜康醫院健康體檢中心進行血常規、血生化指標檢測。
采用歐姆龍U30電子血壓計(歐姆龍大連有限公司)測量受試者BP、HR;采用魚躍YX102指夾式SpO2檢測儀(江蘇魚躍醫療設備股份有限公司)測量SpO2;采用乙二胺四乙酸二鉀(EDTA-K2)抗凝真空管(江蘇康捷醫療器械有限公司)采集靜脈血;采用漢方HF-3800全自動血細胞分析儀(濟南漢方醫療器械有限公司)檢測血常規指標;采用邁瑞BS-800全自動生化儀(深圳邁瑞生物醫療電子股份有限公司)檢測血生化指標。儀器使用按標準化操作流程進行,血常規、血生化指標分析前采用對應配套質控物進行質控,保證數據的準確性和穩定性。
1.2.2AMS的診斷
所有受試者于LS1清晨在專業人員指導下填寫LLS量表[6],主觀癥狀包括頭痛、頭昏/頭暈、疲勞/虛弱、惡心/嘔吐4類,每一類癥狀根據無、輕度、中度、重度分別評為0、1、2、3分,AMS診斷標準:強制要求頭痛評分至少1分并具有其他3種癥狀中的至少一種,最終所有癥狀總分>3分。
1.3 統計學處理
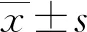
2 結 果
2.1 研究對象基線特征情況
根據LS1時是否發生AMS將研究對象分為AMS組20例和非AMS組26例,比較2組研究對象的一般情況。2組人員基線水平,包括BMI、收縮壓(systolic blood pressure,SBP)和舒張壓(diastolic blood pressure,DBP)、HR、SpO2、RBC、Hb、HCT、總蛋白(total protein,TP)、清蛋白(albumin,ALB)、球蛋白(globulin,GLB)、丙氨酸氨基轉移酶(alanine transaminase,ALT)、天門冬氨酸氨基轉移酶(glutamic-oxalacetic transaminase,AST)、總膽紅素(total bilirubin,TBIL)、肌酐(creatinine,CREA)、尿素氮(blood urea nitrogen,BUN)、甘油三酯(triacylglycerol,TRIG)等基本生理、血液學參數及交通方式比較,差異均無統計學意義(P>0.05),2組間年齡比較差異有統計學意義,提示年齡增長可能是AMS發生的風險因素。此外,通過低氧預適應訓練,2組Hb中位數均超過160 g/L,見表1。

表1 2組間基線(CQ)時特征比較
2.2 低氧暴露后2組間生理參數與血細胞參數比較
AMS LS1時,2組間SpO2、SBP、DBP、HR等基本生理參數和RBC、Hb、HCT等血細胞參數比較,差異無統計學意義(P>0.05),而在AMS癥狀消失后的高原習服過程中(LS2~LS4),上述參數2組間差異也無統計學意義(P>0.05),即從急性低氧暴露到2個多月的高原習服過程中,包括SpO2、RBC、Hb、HCT等以往被證實具有AMS預測價值的參數在2組間的變化是穩定一致的,見圖1。

A:SpO2;B:RBC;C:Hb;D:HCT;ns:P>0.05,組間同時間點比較。
2.3 低氧暴露后組間血生化參數比較
CQ、LS1~LS4各時間點,除ALB以外,其余血生化參數組間差異均無統計學意義(P>0.05),在LS1和LS3(AMS癥狀消失)時,非AMS組ALB水平明顯高于AMS組,組間差異有統計學意義(P<0.05)。另外,與CQ基線水平比較,無論是AMS組還是非AMS組,ALB在整個高原習服過程中的變化趨勢都經歷了一個先明顯升高(LS2)又明顯下降(LS3)至基線水平的過程,差異僅在于非AMS組在LS1時就已經明顯升高,而AMS組直到LS2時才明顯升高并與健康習服者保持一致,這完全不同于血細胞參數在低氧暴露后的變化趨勢,見圖2。

a:P<0.05,b:P<0.01,同一時間點組間比較;c:P<0.01,非AMS組LS1、LS2時與CQ時比較;d:P<0.01,AMS組LS2時與CQ時比較。
2.4 AMS發生、發展的潛在預測因素篩查
為發現AMS的潛在預測因素,對CQ和LS1時的所有基本生理、血細胞和血生化參數進行單因素logistic回歸分析。在CQ時,單因素logistic回歸顯示,只有年齡(OR=1.508,95%CI:1.043~2.179,P=0.029)與AMS明顯相關;在LS1時,僅ALB(OR=0.706,95%CI:0.549~0.906,P=0.006)與AMS明顯相關性,見表2。接著,將單因素logistic回歸中與AMS明顯相關的年齡、ALB及以往被證實有預測價值的SpO2、RBC、Hb、HCT全部納入多因素logistic回歸中進行分析。結果顯示在CQ時,僅年齡(OR=1.508,95%CI:1.043~2.179,P=0.029)是AMS的獨立危險因素;在LS1時,年齡(OR=1.611,95%CI:1.059~2.451,P=0.026)是AMS的獨立危險因素,而ALB(OR=0.676,95%CI:0.511~0.894,P=0.006)是AMS的獨立保護因素,見表3。

表2 在CQ和LS1時AMS的單因素logistic回歸分析

表3 在CQ和LS1時AMS的多因素logistic回歸分析
3 討 論
本研究確定了從海拔500 m到3 650 m人員基本生理和血液學參數持續75 d(共5個時間點)的變化過程,并比較了AMS患者與健康習服人員在此期間所有參數的差異變化,結果發現SpO2、RBC、Hb、HCT等基本生理和絕大部分血液學參數及交通方式差異均無統計學意義(P>0.05),因此這些參數可能對AMS并無預測價值。值得注意的是,本研究發現在LS1時年齡增長可能是發生AMS的風險因素。同時,在急性低氧暴露時健康習服人員血漿ALB明顯高于AMS患者,而在AMS癥狀消失后的高原習服過程中,2組人員ALB均出現了先升高后降低的一致變化過程,提示ALB可能對AMS有一定預測價值。并且通過logistic回歸分析再次驗證上述發現。
盡管直到現在對AMS的發病機制仍缺乏統一的解釋,但是絕大部分研究表明更明顯的低氧血癥是發生AMS的首要因素[7],這可能是由于AMS患者受到低氧暴露后的影響在癥狀和病理生理變化出現前數小時就已經開始了,包括氧化應激、較低的通氣量、間質性肺水腫造成的氣體交換障礙及液體潴留[8]。因此,SpO2作為反映氧氣輸送和血氧含量的直接參數,被某些研究認為是AMS最有價值的預測指標[9]。然而本研究發現,低氧暴露后2組人員SpO2的變化趨勢是一致的,在各個時間點差異也均無統計學意義(P>0.05),因此提示AMS的易感性似乎不是低氧血癥直接導致。這可能是由于在本研究中低氧環境觸發的可能發生AMS的危險因素并不能得到有效控制,包括個體的健康、生理和遺傳及在高海拔地區進行了特定行為和活動,從而造成個體對同水平低氧血癥存在不同的生理反應[10]。故單純測量SpO2的數值可能對AMS并無預測價值,還要考慮到其他因素的影響。同時,本研究中輕度AMS患者其SpO2與健康習服者無明顯差異,這也從另一個角度說明單純測量SpO2的預測價值可能受到其他因素的影響。
由于RBC是全身氧氣運輸的關鍵參與者,因此,它們在適應缺氧方面發揮著明確的作用[11-12]。低氧暴露后一定程度上的紅細胞系增生被認為是減輕低氧血癥的有力補償,然而其過度增生甚至病理狀態(HAPC)將使血液黏度增加、血流速度和心輸出量減慢,從而導致向組織輸送的氧氣反而減少[13-14],可能會誘發AMS[15]。有研究顯示Hb在超過160 g/L的范圍后,其過度增生與AMS發生明顯相關,AMS組Hb明顯高于非AMS組[16]。然而本研究中,無論是AMS組還是非AMS組,經低氧預適應訓練后平均Hb在基線水平(CQ)就已經超過160 g/L,且在低氧暴露后Hb不斷上升至180~190 g/L的整個過程中,組間Hb、BRC、HCT差異均無統計學意義(P>0.05),這提示健康習服人員和AMS患者紅細胞系增生的變化趨勢是一致的。雖然缺氧誘導的紅細胞代償性增生及Hb的升高有助于提高紅細胞的攜氧能力,但這二者導致高黏滯血癥和血流速度降低,可能會增加血栓形成的臨床風險[11]。那么上述參數若是達到上限后可能無法顯示明顯的差異或是低氧刺激可能對2組人員的紅細胞系參數影響是同等的,但也可能受到其他不同因素的影響。因此,紅細胞系參數過度增生對是否罹患AMS的預測價值還不能確定。
ALB是人體血液中含量最豐富的蛋白,約占血漿總蛋白的60%,它的主要作用是調節血漿膠體滲透壓(colloid osmotic pressure,COP),占COP的75%~80%,從而維持血管內外平衡,保證正常血容量,故臨床上常用于對癥治療低血容量、出血、休克、燒傷、急性肝功能衰竭、慢性肝病等[17]。此外,ALB還通過其抗氧化、抗炎和抗細胞凋亡的作用維持血管內皮細胞穩定,減輕血管通透性的增加[18]。既往研究顯示血漿ALB與AMS間缺乏明顯相關性[19],但本研究發現健康習服人員在急性低氧暴露時(LS1)血漿ALB明顯升高,而AMS患者并未發生明顯變化,血漿ALB升高是AMS的獨立保護因素,提示血漿ALB可能在預防AMS中發揮積極作用,然而其變化的具體機制目前并不清楚,可能是ALB降解減少或合成增加,也可能是血液濃縮間接引起。對于健康習服人員ALB直接降解減少或合成增加導致:有研究顯示高原低氧環境可能對ALB的合成有一定的刺激作用,盡管低氧已被證明抑制動物的肝臟蛋白合成,但低氧引起的呼吸性堿中毒可刺激肝臟蛋白合成,從而彌補低氧引起的直接效應。ALB合成增加在理論上確實可以通過增加COP,維持血管內皮細胞穩定和血管通透性等作用以減少血液往組織間隙滲漏,從而避免腦腫脹或腦白質細胞內水腫,這是AMS發生的潛在機制[7]。然而通常來說,血漿ALB增加應該會導致血漿容量的增加,可能反而還引起顱內壓升高,而且這似乎也與高原暴露后血漿容量下降相矛盾[20-21]。對于健康習服人員血液濃縮間接導致:大量研究表明由于高原濕度降低、肺通氣增加及呼吸性堿中毒促進腎臟利鈉和利尿的作用[22],抵達高海拔地區后血漿容量可持續減少以提高血液的攜氧能力,這種變化甚至持續至3周后,與觀察到的LS1(非AMS組出現),LS2(2組均出現)時ALB明顯升高相一致。這也可以用血液被稀釋來解釋,也與之前報道的長時間高海拔逗留后血漿容量將部分或全部恢復相吻合[20]。但是血漿容量變化與AMS發生是否相關仍存在很大爭議[19],仍有部分研究顯示AMS患者表現出更高的液體滯留量,更大的血漿滲透壓下降和更大的血漿容量增加[23],這與本研究的假設相吻合。
值得注意的是,如果ALB升高是由于血液濃縮間接導致,那為何在LS1時血液濃縮的非AMS組和血液未濃縮的AMS組其紅細胞系參數表現出無差異的一致性,這是否提示健康習服者與AMS患者在急性高原暴露時其習服模式是不同的,而在短暫逗留后(LS2及以后)其習服模式又恢復一致?這還需要繼續深入研究。
綜上所述,本研究證實SpO2、RBC、Hb、HCT等生理和血液學參數可能對AMS并無預測價值,而急性低氧暴露時血漿ALB的變化可能對AMS有一定預測價值,盡管并不清楚這種變化是由于其合成增加、降解減少還是血液濃縮引起的。此外,低氧暴露后期血漿ALB在健康習服人群和AMS患者癥狀消失后的一致變化過程反映了其在高原習服中可能扮演重要角色,這還需要深入研究其在低氧暴露條件下的生理效應,為今后通過應用ALB及其相關制品來預防AMS帶來可能。

