內(nèi)皮祖細(xì)胞損傷來源微粒對內(nèi)皮祖細(xì)胞的影響機(jī)制研究*
馬藝萍,阿不都熱合曼·米吉提,袁玉娟,吐爾孫阿依·依斯米提拉,阿卜拉江·艾合麥提,穆葉賽·尼加提
(1.新疆醫(yī)科大學(xué)研究生院,烏魯木齊 830000;2.喀什地區(qū)第二人民醫(yī)院心血管內(nèi)科,新疆喀什 844099;3.新疆維吾爾自治區(qū)人民醫(yī)院急救中心,烏魯木齊 830000)
心血管疾病(cardiovascular disease,CVD)是一種與內(nèi)皮細(xì)胞(endothelial cell,EC)水平相關(guān)的疾病[1]。EC損傷、血小板黏附和循環(huán)血液中的白細(xì)胞侵襲內(nèi)皮下層是動脈粥樣硬化形成的關(guān)鍵早期事件。內(nèi)皮祖細(xì)胞(endothelial progenitor cell,EPC)是一種多功能干細(xì)胞,具有向EC分化的潛能[2]。當(dāng)組織缺血或損傷時(shí),EPC從骨髓被動員到外周血中進(jìn)行分化。研究發(fā)現(xiàn),EPC能有效減輕心絞痛和心力衰竭,改善左心室射血分?jǐn)?shù),并顯示出組織器官再生和恢復(fù)缺血相關(guān)器官功能的前景[3]。微粒(microparticles,MPs)是由各種活化和凋亡細(xì)胞產(chǎn)生、直徑為100~1 000 nm的小膜囊泡[4-6]。MPs是細(xì)胞間物質(zhì)交換和信號轉(zhuǎn)導(dǎo)的重要介質(zhì),攜帶表面抗原、蛋白質(zhì)和各種生物活性分子,在細(xì)胞通訊中發(fā)揮關(guān)鍵作用[7]。有研究發(fā)現(xiàn),EPC來源MPs可以保護(hù)心肌細(xì)胞免受血管緊張素-Ⅱ誘導(dǎo)的肥大和凋亡[8],并將微小RNA轉(zhuǎn)移到EPC和EC,修復(fù)CVD中的組織損傷[9]。WU等[10]發(fā)現(xiàn)miR-126通過細(xì)胞外調(diào)節(jié)蛋白激酶(extracellular signal-regulated kinase,ERK)1/2信號通路來增強(qiáng)氧化應(yīng)激下EPC的生物學(xué)功能,這可能為急性心肌梗死的治療提供新的策略。然而,損傷的EPC來源MPs對EPC的作用及具體作用機(jī)制尚缺乏深入研究,因此,本研究通過體外實(shí)驗(yàn),損傷處理EPC,提取MPs對EPC進(jìn)行干預(yù),為減少細(xì)胞組織損傷,開發(fā)阻斷損傷EPC來源MPs試劑盒提供理論依據(jù),現(xiàn)報(bào)道如下。
1 材料與方法
1.1 一般材料
EPC購于武漢普諾賽生命科技有限公司;異硫氰酸熒光素(fluorescein isothiocyanate,FITC)-CD34(11-0349-42)購于美國eBioscience公司;內(nèi)皮細(xì)胞生長培養(yǎng)基(endothelial cell growth medium,EGM)-2(Promocell,C22121)、胎牛血清(Wisent,086-150)及青鏈霉素(Wisent,450-201-EL)均購于北京畢特博生物技術(shù)有限責(zé)任公司;腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)重組蛋白購于上海澤葉生物科技有限公司。檢測設(shè)備:AcurriC6流式細(xì)胞儀購于美國BD公司;JEM1011透射電鏡儀購于日本JEOL公司;Multiskan 51119000酶標(biāo)儀購于美國Thermo fisher公司;Ts2R倒置顯微鏡購于日本Nikon公司);Veriti PCR儀購于美國Applied Biosystems公司;Mini Protean 3十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)儀器購于美國Bio-Rad公司;化學(xué)發(fā)光成像分析儀購于上海天能生命科學(xué)有限公司。
1.2 方法
1.2.1細(xì)胞培養(yǎng)
EPC為貼壁細(xì)胞,培養(yǎng)于EGM-2中,含有10%胎牛血清,100 U/mL的青霉素,100 μg/mL鏈霉素,放置于37 ℃、5% CO2的細(xì)胞培養(yǎng)箱中。當(dāng)細(xì)胞長至80%~90%時(shí),去除培養(yǎng)基,加入磷酸鹽緩沖液(PBS)洗1~2次,去除PBS后,加入1 mL胰酶消化1~3 min后,加入3 mL完全培養(yǎng)基中和胰酶終止消化,將消化的細(xì)胞轉(zhuǎn)移至15 mL離心管中,1 000 r/min離心5 min。倒掉上清液,加入3 mL培養(yǎng)基重懸細(xì)胞,1∶3傳代至培養(yǎng)皿中培養(yǎng)。
1.2.2流式細(xì)胞儀檢測
取分離培養(yǎng)的EPC,去除培養(yǎng)基,加入PBS洗1~2次,去除PBS后加入1 mL胰酶消化1~3 min,加入3 mL完全培養(yǎng)基中和胰酶終止消化,將消化的細(xì)胞轉(zhuǎn)移至15 mL離心管中,1 000 r/min離心5 min。倒掉上清液后,加入3 mL PBS重懸細(xì)胞。加入PBS-1%牛血清白蛋白(BSA)重懸細(xì)胞,加入CD34抗體按照1∶50的比例稀釋,空白對照細(xì)胞加入同型對照抗體,冰上孵育30 min。細(xì)胞中加入400 μL PBS混勻,1 000 r/min離心,去除上清液,加入PBS洗3次,加入500 μL PBS緩沖液重懸細(xì)胞。CD34是EPC的特征性分子標(biāo)志物,采用流式細(xì)胞儀檢測分離細(xì)胞中的CD34陽性細(xì)胞群,見圖1。

圖1 EPC流式鑒定
1.2.3HG、TNF-α損傷處理
將EPC培養(yǎng)于培養(yǎng)皿中,待細(xì)胞貼壁后分別進(jìn)行正常培養(yǎng)、高糖(high glucose,HG)培養(yǎng)、加入TNF-α重組蛋白培養(yǎng)24 h后收集上清液并提取MPs,此為HG、TNF-α損傷的EPC來源MPs。將1×106個(gè)正常EPC接種于6孔板中,待細(xì)胞貼壁后,將50 μg/mL正常培養(yǎng)EPC來源MPs(control-EPC-MPs組)、50 μg/mL HG培養(yǎng)EPC來源MPs(HG-EPC-MPs組)、50 μg/mL TNF-α培養(yǎng)EPC來源MPs(TNF-α-EPC-MPs組)分別加入正常培養(yǎng)的EPC后,收集細(xì)胞進(jìn)行檢測。
1.2.4透射電鏡檢測
3組細(xì)胞用胰酶消化后,收集到離心管中,2 000 r/min離心5 min,去除培養(yǎng)基。向收集的細(xì)胞中加入戊二醛稀釋液固定備用;取5~10 μL細(xì)胞懸液加到Formvar-carbon載樣銅網(wǎng)上;取100 μL PBS加到封口膜上,用鑷子將銅網(wǎng)(Formvar膜面朝下)放在PBS液滴上清洗。在所有步驟中,保持Formvar膜面濕潤而另一面干燥;銅網(wǎng)放在50 μL 1%戊二醛液滴上5 min;銅網(wǎng)放在100 μL ddH2O洗2 min(洗8次);銅網(wǎng)放在50 μL草酸雙氧鈾液滴上(pH 7.0)5 min;銅網(wǎng)放在50 μL甲基纖維素液滴上10 min,冰上操作;銅網(wǎng)放到樣品臺頂端的不銹鋼環(huán)上,在濾紙上吸去多余液體。空氣干燥5~10 min;銅網(wǎng)放在樣品盒里,拍攝透射電鏡照片。
1.2.5MTT檢測
3組細(xì)胞培養(yǎng)24 h后,加入10 μL MTT(5 mg/mL),在細(xì)胞培養(yǎng)箱中繼續(xù)培養(yǎng)3 h。去除培養(yǎng)基,每孔加入100 μL Formazan溶解液,適當(dāng)混勻,在細(xì)胞培養(yǎng)箱內(nèi)繼續(xù)孵育,直至普通光學(xué)顯微鏡下觀察發(fā)現(xiàn)Formazan全部溶解。37 ℃孵育4 h,紫色結(jié)晶全部溶解。如果紫色結(jié)晶較小、較少,溶解時(shí)間較短;如果紫色結(jié)晶較大、較多,溶解時(shí)間延長,可適當(dāng)振搖數(shù)次。在570 nm測定吸光度(A)值;如無570 nm濾光片,可使用560~600 nm濾光片。
1.2.6細(xì)胞劃痕實(shí)驗(yàn)
將5×106個(gè)EPC接種于6孔板中,搖晃均勻后放入培養(yǎng)箱中培養(yǎng)。待細(xì)胞長滿后,去除培養(yǎng)基,用PBS洗1次;200 μL槍頭在6孔板中劃3道直線,PBS洗2次,去掉劃出的細(xì)胞;用PBS洗2次,將殘余的細(xì)胞洗干凈;在顯微鏡下拍照,加入無血清培養(yǎng)基,再分別加入control-EPC-MPs組、HG-EPC-MPs組、TNF-α-EPC-MPs組細(xì)胞,搖晃均勻后放入培養(yǎng)箱中常規(guī)培養(yǎng)12、24 h后拍照。
1.2.7細(xì)胞管腔形成實(shí)驗(yàn)
3組細(xì)胞用胰酶消化,1 000 r/min離心,去除上清液,加入完全培養(yǎng)基重懸細(xì)胞,將細(xì)胞分別種在24孔板中,每孔種1×105個(gè)細(xì)胞。培養(yǎng)6 h后,觀察EC管腔形成情況并拍照。拍照后,使用Image J軟件Angiogenesis Analyzer Plugin插件對管腔形成情況進(jìn)行分析。
1.2.8實(shí)時(shí)熒光定量PCR(qPCR)檢測
3組細(xì)胞去除培養(yǎng)基,加入PBS洗1次,加入1 mL TRIzol裂解細(xì)胞,將裂解液轉(zhuǎn)移至EP管中。加入氯仿200 μL,用力振搖15 s,室溫靜置15 min,4 ℃ 12 000 r/min離心15 min。離心后液體分為3層,小心吸取上層無色液體移入1個(gè)新的EP管中。加入等體積異丙醇,上下顛倒混勻,室溫靜置5 min,4 ℃ 12 000 r/min離心10 min。去除上清液,沉淀加入75%乙醇1 mL,輕微振蕩15 s,4 ℃ 7 500 r/min離心5 min。小心去除上清液,管內(nèi)沉淀在超凈臺中鼓風(fēng)靜置干燥3~5 min。加入50 μL DEPC水溶解,nanodrop檢測濃度水平,-80 ℃冰箱保存。RNA純度根據(jù)nanodrop檢測結(jié)果和230、260、280 nmA值決定。內(nèi)皮型一氧化氮合成酶(endothelial nitric oxide synthase,eNOS)、沉默信息調(diào)節(jié)因子1(silent information regulator 1,SIRT1)、ERK、大鼠肉瘤(rat sarcoma,RAS)引物情況見表1。

表1 PCR檢測引物序列
1.2.9Western blot
3組細(xì)胞加入200 μL RIPA裂解液,冰上裂解30 min。裂解后將裂解產(chǎn)物轉(zhuǎn)移到預(yù)冷的1.5 mL離心管(冰上)并在4 ℃下以12 000 r/min離心10 min。將離心后的上清液轉(zhuǎn)移至1.5 mL離心管中,-20 ℃保存。采用BCA法檢測總蛋白水平,十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate,polyacrylamide gel electrophoresis,SDS-PAGE)分離蛋白。濃縮膠黏劑層電壓為80 V,電泳時(shí)間為30 min。樣品進(jìn)入分離膠黏劑后,在120 V下電泳90 min,然后將蛋白轉(zhuǎn)移到硝酸纖維素膜上。在脫脂乳中封閉后,將膜與一抗在4 ℃孵育過夜。根據(jù)一抗,將膜與二抗在25 ℃孵育2 h。使用化學(xué)發(fā)光成像分析儀進(jìn)行掃描成像。
1.3 統(tǒng)計(jì)學(xué)處理
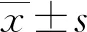
2 結(jié) 果
2.1 3組EPC電鏡下細(xì)胞器變化
control-EPC-MPs組細(xì)胞微管結(jié)構(gòu)完整,整體較長,高爾基體結(jié)構(gòu)完整;HG-EPC-MPs組細(xì)胞微管結(jié)構(gòu)完整,長度無明顯差異,高爾基體結(jié)構(gòu)相對完整;TNF-α-EPC-MPs微管結(jié)構(gòu)完整,長度有所縮短,高爾基體結(jié)構(gòu)相對完整,部分高爾基體出現(xiàn)囊泡狀散在分布在細(xì)胞質(zhì)中,見圖2。

綠色箭頭:微管;藍(lán)色箭頭:高爾基體。
2.2 3組EPC細(xì)胞增殖情況比較
與control-EPC-MPs組比較,HG-EPC-MPs組、TNF-α-EPC-MPs組細(xì)胞增殖率明顯下調(diào),差異有統(tǒng)計(jì)學(xué)意義(P<0.01),見圖3。

①:control-EPC-MPs組;②:HG-EPC-MPs組;③:TNF-α-EPC-MPs組;a:P<0.01,與control-EPC-MPs組比較。
2.3 3組EPC細(xì)胞遷移情況比較
與control-EPC-MPs組比較,HG-EPC-MPs組、TNF-α-EPC-MPs組0 h細(xì)胞遷移能力無明顯變化(P>0.05),12、24 h細(xì)胞遷移能力明顯降低,差異有統(tǒng)計(jì)學(xué)意義(P<0.01),見圖4。

A:細(xì)胞劃痕圖(100×);B:3組EPC遷移距離比較;a:P<0.01,與control-EPC-MPs組比較。
2.4 3組EPC管腔形成情況比較
與control-EPC-MPs組比較,HG-EPC-MPs組、TNF-α-EPC-MPs組成管明顯減少,差異有統(tǒng)計(jì)學(xué)意義(P<0.01),見圖5。

A:管腔形成圖(100×);B:成管分析結(jié)果;①:control-EPC-MPs組;②:HG-EPC-MPs組;③:TNF-α-EPC-MPs組;a:P<0.01,與control-EPC-MPs組比較。
2.5 3組EPC的mRNA和蛋白表達(dá)水平比較
與control-EPC-MPs組比較,HG-EPC-MPs組、TNF-α-EPC-MPs組eNOS、SIRT1、RAS和ERK的mRNA和蛋白表達(dá)水平下調(diào),差異有統(tǒng)計(jì)學(xué)意義(P<0.05),見圖6~7。

A:3組eNOS mRNA表達(dá)比較;B:3組SIRT1 mRNA表達(dá)比較;C:3組RAS mRNA表達(dá)比較;D:3組ERK mRNA表達(dá)比較;①:control-EPC-MPs組;②:HG-EPC-MPs組;③:TNF-α-EPC-MPs組;a:P<0.05,與control-EPC-MPs組比較。

A:3組eNOS、RAS Western blot圖;B:3組SIRT1、ERK Western blot圖;C:3組eNOS蛋白表達(dá)分析;D:3組SIRT1蛋白表達(dá)分析;E:3組RAS蛋白表達(dá)分析;F:3組ERK蛋白表達(dá)分析;①:control-EPC-MPs組;②:HG-EPC-MPs組;③:TNF-α-EPC-MPs組;a:P<0.05,與control-EPC-MPs組比較。
3 討 論
從骨髓動員進(jìn)入循環(huán)的EPC對血管修復(fù)、管壁組織重塑和血管生成[11]具有重要意義。前期研究發(fā)現(xiàn),MPs在CVD的發(fā)生、發(fā)展中發(fā)揮極其重要的作用[12]。研究人員已經(jīng)證實(shí),EPC來源MPs可以修復(fù)CVD中的組織損傷[9-10]。本研究應(yīng)用HG和TNF-α介導(dǎo)EPC損傷來源MPs,探索EPC功能障礙的機(jī)制,這可能為將來阻斷EPC損傷來源MPs、減少EPC損傷提供理論依據(jù)。
本研究發(fā)現(xiàn),HG和TNF-α介導(dǎo)EPC損傷來源MPs下調(diào)了EPC細(xì)胞增殖,降低了細(xì)胞遷移能力,細(xì)胞成管明顯減少;HG-EPC-MPs組和TNF-α-EPC-MPs組EPC損傷加重,并引起EPC微管和高爾基體等細(xì)胞器輕微改變;HG-EPC-MPs組和TNF-α-EPC-MPs組EPC變化可能與SIRT1/ERK1信號通路有關(guān)。有研究強(qiáng)調(diào)了線粒體和內(nèi)質(zhì)網(wǎng)在維持內(nèi)皮功能中的核心作用[13]。然而,關(guān)于微管和高爾基體在內(nèi)皮功能中的作用鮮有報(bào)道。本研究發(fā)現(xiàn),HG-EPC-MPs組、TNF-α-EPC-MPs組的EPC微管結(jié)構(gòu)完整,長度有所縮短,高爾基體結(jié)構(gòu)相對完整,部分高爾基體出現(xiàn)囊泡狀散在分布在細(xì)胞質(zhì)中,提示HG和TNF-α介導(dǎo)EPC損傷來源的MPs可能會導(dǎo)致微管和高爾基體結(jié)構(gòu)改變,從而加重應(yīng)激損傷反應(yīng)。因此,高爾基體損傷可能在EPC的損傷中發(fā)揮重要作用。
SIRT1是哺乳動物NAD依賴的sirtuin脫乙酰基酶組成部分,影響炎癥、線粒體生物發(fā)生、細(xì)胞衰老和凋亡等多個(gè)過程[14-15]。CAO等[16]證明了原兒茶酚醛通過調(diào)節(jié)SIRT1誘導(dǎo)自噬和抑制凋亡來挽救氧糖剝奪/再灌注(oxygen-glucose deprivation/reperfusion,OGD/R)誘導(dǎo)的EC損傷。此外,LI等[17]提出miR-126過表達(dá)通過促進(jìn)SIRT1/Nrf2信號通路來減輕氧化應(yīng)激和炎癥反應(yīng),從而減輕OGD/R誘導(dǎo)的人臍靜脈EC(human umbilical vein endothelial cells,HUVECs)的神經(jīng)毒性。本研究中,與control-EPC-MPs組比較,HG-EPC-MPs組、TNF-α-EPC-MPs組SIRT1的mRNA和蛋白表達(dá)水平下調(diào)。此外, HG-EPC-MPs組和TNF-α-EPC-MPs組的EPC增殖率、細(xì)胞遷移能力降低,細(xì)胞成管明顯減少。BI等[18]證明,血管生成素-1通過Tie2受體/ERK1/2-p38MAPK通路減輕了腎小球EC中內(nèi)質(zhì)網(wǎng)應(yīng)激誘導(dǎo)的細(xì)胞功能障礙和凋亡。WANG等[19]研究表明,堿性成纖維細(xì)胞生長因子參與了缺血氧化損傷模型中內(nèi)質(zhì)網(wǎng)應(yīng)激和線粒體功能障礙的抑制,這是PI3K/Akt和ERK1/2信號通路激活的基礎(chǔ)。與control-EPC-MPs組比較,HG-EPC-MPs組、TNF-α-EPC-MPs組ERK1的mRNA及其蛋白表達(dá)下調(diào),表明HG和TNF-α介導(dǎo)EPC損傷來源的MPs可以通過影響SIRT1/ERK1的表達(dá)和改變高爾基體結(jié)構(gòu)來抑制EPC的生物學(xué)功能。
eNOS是一種產(chǎn)生NO的酶,在心肌缺血再灌注損傷(myocardial ischemia reperfusion injury,MIRI)中具有重要意義。CAPE-oNO2通過SIRT1/eNOS通路抑制氧化應(yīng)激、炎癥反應(yīng)和細(xì)胞壞死,從而減輕MIRI[20]。PENG等[21]證明CC基元配體2促進(jìn)MAPK/ERK1/2/MMP-9、PI3K/AKT和Wnt/β-catenin信號通路相關(guān)蛋白的表達(dá),并以濃度依賴方式促進(jìn)HUVECs的增殖、遷移和管形成。醛糖還原酶通過SIRT1/AMPK-α1/mTOR通路抑制HG誘導(dǎo)的eNOS和血管細(xì)胞黏附因子1表達(dá),調(diào)控單核細(xì)胞白血病單核細(xì)胞與HUVECs的黏附,從而調(diào)控HG誘導(dǎo)的HUVECs死亡[22]。本研究中,與control-EPC-MPs組比較,HG-EPC-MPs組、TNF-α-EPC-MPs組SIRT1的mRNA和蛋白表達(dá)水平下調(diào)。RAS的激活在MIRI的發(fā)生、發(fā)展中發(fā)揮重要作用[23]。當(dāng)MIRI發(fā)生時(shí),腎素-血管緊張素-醛固酮系統(tǒng)的最終代謝產(chǎn)物血管緊張素Ⅱ與血管緊張素Ⅰ型受體結(jié)合,刺激線粒體氧化應(yīng)激損傷反應(yīng),導(dǎo)致活性氧過度產(chǎn)生[24]。活性氧過度產(chǎn)生可能誘發(fā)強(qiáng)烈的炎癥反應(yīng),增加心肌梗死面積,導(dǎo)致心功能異常。LI等[25]研究表明,高爾基體參與了鈣超載的形成和緩解,并對神經(jīng)細(xì)胞的缺血和再灌注有強(qiáng)烈的反應(yīng)。因此,本研究證實(shí)HG和TNF-α介導(dǎo)EPC損傷來源MPs可能通過影響EPC中eNOS、RAS的表達(dá),促進(jìn)氧化應(yīng)激、炎癥反應(yīng)和細(xì)胞壞死,從而加重EPCs的損傷。
綜上所述,HG和TNF-α介導(dǎo)EPC損傷來源MPs可能通過調(diào)控SIRT1/ERK1通路蛋白的表達(dá),使EPC內(nèi)含細(xì)胞器的結(jié)構(gòu)改變,從而影響EPC的生物學(xué)功能。

