血漿及腫瘤組織HPV ctDNA表達水平與宮頸癌腹主動脈旁淋巴結受累、術后復發的關系
袁錦鑫 杜 鍇 袁 洋 李洪飛
宮頸癌是原發于子宮頸部位的惡性腫瘤,是女性生殖道最常見的婦科惡性腫瘤,且多發于50~55歲女性[1]。在宮頸癌早期及時進行宮頸癌根治手術治療,治愈率可達到80%以上,但單一的宮頸癌根治術仍可能出現宮頸癌復發情況[2]。宮頸癌根治術的范圍包括廣泛子宮切除術與淋巴結切除術,既往對宮頸癌的臨床分期未考慮患者淋巴結狀態,隨著臨床對宮頸癌的不斷深入探究,研究發現淋巴結轉移可能與宮頸癌患者預后密切相關[3]。相關研究[4]報道,腹主動脈旁淋巴結(para-aortic lymph node,PALN)受累患者的預后生存質量顯著低于淋巴結陰性者。因此早期檢出宮頸癌患者腹主動脈淋巴結轉移,提高宮頸癌患者術后復發轉移的預測效能,及時進行預防,對改善患者術后生存質量具有重要意義。宮頸癌在絕大多數情況下是由人乳頭瘤病毒(human papillomavirus,HPV)感染引起的,并且可以在腫瘤中發現人乳頭瘤病毒DNA序列,循環腫瘤DNA(circulating tumor,ctDNA)是在血液或腫瘤組織中存在的少部分腫瘤細胞壞死分泌的DNA片段,可用作腫瘤病情的評估;國內外研究[5-6]報道,宮頸癌患者的血漿ctDNA與宮頸癌病情進展存在一定的相關性。本研究將HPV ctDNA作為研究指標,探索其與宮頸癌患者PALN受累和術后復發的關系。
1 材料與方法
1.1 一般資料
選取2017年6月至2019年5月我院收治的宮頸癌患者102例,年齡32~66歲,平均(48.45±7.49)歲。納入標準:①臨床體征和影像學檢查均符合宮頸癌相關診斷標準[7],并經病理檢查確診是否存在PALN受累;②入組前均未接受癌癥相關治療;③均行宮頸癌根治術,其中PALN受累患者同時行腹主動脈旁淋巴結切除術;術后接受放、化療等輔助治療;④患者及其家屬愿意配合本研究,并簽署知情同意書。排除標準:①存在其他心腦、肝腎等全身重要器官損傷;②存在其他惡性腫瘤;③中途退出本研究或失訪。本研究符合《赫爾辛基宣言》相關倫理準則。
1.2 臨床資料收集
根據本研究目的,設計調查問卷由醫院專業人員收集患者年齡、BMI、病理類型、臨床分期、分化程度、腫瘤直徑、肌層浸潤深度、PALN受累等一般資料。
1.3 HPV ctDNA表達水平檢測
血漿樣本:抽取宮頸癌患者外周靜脈血10 mL于EDTA抗凝試管中,搖晃使血液充分混勻,離心處理分離后,保存血漿于-80 ℃冰箱中待提取ctDNA。腫瘤組織樣本:取10~20 mg腫瘤組織加入到600 μL冷凍細胞裂解液中,65 ℃孵育15~30 min;使用HiPure游離DNA抽提試劑盒(廣州美基生物科技有限公司)從血漿離心管或腫瘤組織水化液中提取ctDNA,超聲打斷至300 bp大小;使用核酸定量分析試劑盒(蘇州瑞諾德生物科技有限公司)檢測游離DNA的濃度,然后使用High sensitivity DNA Rragents 試劑盒(美國安捷倫科技有限公司)和High sensitivity DNA chips 試劑盒(美國安捷倫科技有限公司)進行片段分析;使用NEBNext?UltraTMII DNA 文庫制備試劑盒(美國Illumina公司)進行DNA文庫構建,對文庫進行 PCR 擴增;應用HiSeq X10 平臺(美國Illumina公司)上機測序,應用 Control-FREEC(version 10.3)對 BAM 文件進行拷貝數變異分析,window 選取50 kb,并使用 GC 矯正以及健康人群參照隊列矯正。計算每條染色體臂所有 window 的平均值得到該條染色體臂的 cov值;ctDNA百分含量=(染色體長臂cov值-染色體短臂cov值)/其中較小者。結果判定:設定以ctDNA 百分含量<0.1%為陰性標準,>0.1%為陽性標準。
1.4 隨訪
出院后定期通過電話或門診對所有患者進行隨訪,隨訪截止時間至2022年5月31日或患者術后復發,隨訪時間范圍為12個月~36個月,記錄患者術后復發(發現新發病灶或出現明顯自覺癥狀)情況。
1.5 統計學處理
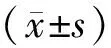
2 結果
2.1 不同臨床病理參數宮頸癌患者的血漿和癌組織HPV ctDNA表達水平
宮頸癌患者血漿和癌組織HPV ctDNA表達水平與年齡、是否絕經、病理類型、腫瘤直徑無顯著相關性(P>0.05),與PALN受累、臨床分期、分化程度、肌層浸潤深度存在顯著相關性(P<0.05)。見表1。
2.2 復發組與未復發組的臨床病理參數比較
復發組與未復發組患者在年齡、是否絕經、病理類型、腫瘤直徑方面比較無明顯差異(P>0.05),在PALN受累、臨床分期、分化程度、肌層浸潤深度、血漿和癌組織HPV ctDNA表達水平比較存在顯著差異(P<0.05)。見表2。
2.3 血漿和癌組織HPV ctDNA表達對宮頸癌患者PALN的診斷價值
根據ROC曲線分析可知,血漿和癌組織HPV ctDNA表達診斷宮頸癌患者PALN受累的AUC分別為0.841、0.823(P<0.05),兩種檢測方式AUC比較無統計學差異(Z=0.495,P=0.621)。見圖1、表3。

圖1 血漿和癌組織HPV ctDNA表達診斷宮頸癌患者PALN受累的ROC曲線

表3 血漿和癌組織HPV ctDNA表達對宮頸癌患者PALN受累的診斷價值
2.4 血漿和癌組織HPV ctDNA表達對宮頸癌患者術后復發的預測價值
根據ROC曲線分析可知,血漿和癌組織HPV ctDNA表達預測宮頸癌患者術后復發的AUC分別為0.759、0.735(P<0.05),兩種檢測方式AUC比較無統計學差異(Z=0.821,P=0.412)。見圖2、表4。

圖2 血漿和癌組織HPV ctDNA表達預測宮頸癌患者術后復發的ROC曲線

表4 血漿和癌組織HPV ctDNA表達對宮頸癌患者術后復發的預測價值
3 討論
世界衛生組織2018年最新發布數據顯示,全球宮頸癌發病率為13/10萬,2018年全球新發人數約為56.9萬例,死亡約31.1萬例[8]。宮頸癌預后與淋巴結轉移密切相關,PALN轉移被認為是宮頸癌的遠處轉移,一旦發生PALN轉移,患者預后生存質量顯著下降[9]。多項臨床研究[10-11]表明,宮頸癌早期手術治療后會復發,且復發后患者死亡風險極高。因此,若能早發現、早診斷、早治療,可以有較好的根治及預后效果。HPV是引起宮頸癌的主要原因,癌組織中的HPV DNA陽性可認為是宮頸癌的特征性表現[12]。
ctDNA是人體血液循環系統中不斷流動的攜帶一定特征(包括突變,缺少,插入,重排,拷貝數異常,甲基化等)來自腫瘤基因的DNA片段,主要來源于壞死或凋亡的腫瘤細胞[13]。既往研究[14]報道,由HPV病毒引起的腫瘤,通過病毒基因組可以區分ctDNA和正常細胞來源的cfDNA,因此,可以通過對患者血漿和癌組織中HPV ctDNA檢測來了解患者的腫瘤負荷情況。Jeannot等[15]的研究發現,血漿中HPV ctDNA和PALN受累顯著相關;K?hler等[16]的研究發現,HPV DNA與宮頸癌患者主動脈旁淋巴結轉移密切相關。本研究發現,宮頸癌患者血漿和癌組織HPV ctDNA表達水平與PALN受累顯著相關,存在PALN受累的宮頸癌患者血漿和腫瘤組織HPV ctDNA陽性表達較高。與上述報道相似,提示HPV ctDNA表達與宮頸癌患者PALN受累存在關聯。同時本研究發現,宮頸癌患者血漿和癌組織HPV ctDNA表達水平與臨床分期、分化程度、肌層浸潤深度存在顯著相關性,進一步提示HPV ctDNA表達水平可能與宮頸癌的病情發展有一定的相關性,但本研究納入樣本數量較少,可能存在數據的偏倚,后期仍需進一步采用多中心、大樣本臨床研究深入分析。
既往研究[17]報道,ctDNA表達可作為多種癌癥術后復發風險的標志,如在Ⅱ/Ⅲ期結直腸癌患者中,術后連續ctDNA檢測可預測較高的復發風險,并先于影像學診斷疾病復發;ctDNA檢測的分子殘留病灶可以識別出復發風險較高的患者,并可以促進輔助治療背景下新治療的強化研究,以提高生存率。本次研究發現,復發組宮頸癌患者血漿和腫瘤組織HPV ctDNA陽性表達率顯著高于未復發組,本研究結果結合上述報道,提示血漿和腫瘤組織HPV ctDNA表達水平與宮頸癌術后復發存在關聯。同時本研究發現,復發組與未復發組宮頸癌患者在PALN受累、臨床分期、分化程度、肌層浸潤深度方面存在顯著差異,與雷雅潔等[18]的報道基本一致,提示PALN受累可能會增加宮頸癌患者術后復發風險。
本研究還發現,血漿和癌組織HPV ctDNA表達診斷宮頸癌患者PALN轉移的AUC分別為0.841、0.823,預測宮頸癌患者術后復發的AUC分別為0.759、0.735,檢測方式AUC比較無統計學差異。提示臨床可選擇HPV ctDNA表達作為宮頸癌患者PALN診斷和術后復發預測指標,選取患者血漿還是癌組織樣本根據實際采集難易度進行決定。
綜上所述,血漿和癌組織HPV ctDNA表達水平與宮頸癌患者PALN受累、術后復發存在顯著相關性,HPV ctDNA表達水平較高的患者更易發生PALN受累和術后復發。但本研究仍存在部分不足,如樣本數量較少、單中心研究,可能對數據的準確性存在偏倚,且未明確HPV ctDNA預測宮頸癌術后復發的作用機制,后期仍需進一步采用多中心、大樣本臨床試驗深入分析HPV ctDNA對宮頸癌患者病情發展的影響,并進行動物試驗分析HPV ctDNA不同表達水平對宮頸癌患者預后的影響。

