非小細胞肺癌患者血清miR-92a、miR-143、miR-196b變化及其臨床意義
趙林杰 孫嵐英 婁利梅
非小細胞肺癌(non-small cell lung cancer,NSCLC)是源于支氣管黏膜或腺體的惡性腫瘤疾病,是最常見的肺癌種類,肺癌的發病率和致死率已上升至全球癌癥的首位[1]。尋找一種科學、高效診斷NSCLC的生物活性標志物已成為研究的重點。近年來,有研究發現血漿中的微小RNA(microRNA,miRNA)具有高穩定性,參與調控腫瘤的發生發展過程,有望成為新型腫瘤活性標記物[2-3]。微小核糖核酸-92a(microRNA-92a,miR-92a)是一種促癌基因,在肺癌組織中高度表達,對肺癌的發生發展及其預后有著重要作用[4]。微小核糖核酸-143(microRNA-143,miR-143)位于人類第5號染色體,通過作用于多個靶基因調節腫瘤的發生發展[5]。微小核糖核酸-196b(microRNA-196b,miR-196b)已被研究證實參與胃癌、宮頸癌、結直腸癌、肺癌等多種惡性腫瘤的發生、發展和轉移[6]。目前,血清miR-92a、miR-143、miR-196b在NSCLC中表達及預后的相關研究較少。因此,本文擬對NSCLC 患者血清miR-92a、miR-143、miR-196b水平進行檢測,旨在為早期NSCLC的預后提供臨床參考。
1 資料與方法
1.1 一般資料
選取2016年1月至2019年2月在本醫院收治的70例NSCLC患者為NSCLC組,NSCLC組男性36例,女性34例,年齡52~86歲,平均年齡(65.46±4.58)歲。病理組織類型:鱗癌34例,腺癌33例,其他肺癌3例。根據肺癌TNM分期標準(第8版)[7]對NSCLC患者進行臨床分期,15例Ⅰ期,22例Ⅱ期,23例Ⅲ期,10例Ⅳ期。根據世界衛生組織(world health organization,WHO)肺癌病理學分級標準進行組織分化,其中低分化23例,中分化24例,高分化23例。根據淋巴結是否發生轉移分為無轉移患者42例,淋巴結轉移患者28例。另隨機選取同期在本院收治的肺部良性病變患者70例為對照組,男性37例,女性33例,對照組年齡51~85歲,平均年齡(66.18±4.37)歲。NSCLC組和對照組患者性別、年齡等一般資料無明顯差異(P>0.05)。
1.2 排納標準
納入標準:①經病理檢查及CT確診為NSCLC患者;②患者術前未進行手術治療、免疫學治療、放化療等。
排除標準:①合并心、肝、腎等嚴重功能不全者、自身免疫性疾病和其他惡性腫瘤患者;②合并既往有胸部放療史者、惡性胸腔積液患者。
1.3 血清miR-92a、miR-143、miR-196b檢測方法
抽取NSCLC組和對照組空腹靜脈血5 mL,離心15 min,取上清液,于-80 ℃凍存。NSCLC組于手術或放化療前采集血樣。取兩組患者凍存的血清標本,采用Trizol試劑盒提取兩組血清樣本總RNA,逆轉錄酶轉錄成cDNA,應用7500實時熒光定量PCR儀(美國ABI公司)進行qRT-PCR擴增,經歷35個循環得到CT值,引物序列見表1。內參照:內參U6由Ribo Bio公司提供,RT-PCR 反應總體系10 μL,反應程序:95 ℃ 3 min、95 ℃ 10 s、55 ℃ 30 s、72 ℃ 30 s,合計35個循環;72 ℃ 10 min 。實驗進行次生物學重復,以2-△△Ct法計算miRNA相對表達量。
1.4 觀察指標
比較對照組和NSCLC組血清miR-92a、miR-143、miR-196b水平;分析血清miR-92a、miR-143、miR-196b表達與NSCLC臨床病理特征的關系,包括TNM 分期、組織學類型、分化程度、淋巴結轉移等;利用單因素生存分析Kaplan-Meier繪制3年生存曲線;采用Pearson相關性分析NSCLC組和對照組血清miR-92a、miR-143、miR-196b水平相關性關系。
1.5 隨訪方法
對本研究的NSCLC患者自入組后進行隨訪調查,隨訪截止日期為2022年3月,共計隨訪時間36個月,每3個月隨訪一次,每半年門診復查一次,隨訪記錄患者復發情況、生存時間及隨訪時狀態(存活、死亡或其他)等。
1.6 統計學處理
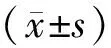
2 結果
2.1 NSCLC組和對照組血清miR-92a、miR-143、miR-196b水平比較
NSCLC組血清miR-92a、miR-196b表達水平較對照組均升高,差異具有顯著性(P<0.05);NSCLC組血清miR-143表達水平較對照組顯著下調,差異也具有顯著性(P<0.05),見表2。

表2 血清miR-92a、miR-143、miR-196b表達水平比較
2.2 血清miR-92a、miR-143、miR-196b表達與NSCLC臨床病理特征的關系
單因素分析結果顯示,NSCLC組血清miR-92a、miR-143、miR-196b 表達與腫瘤TNM分期、分化程度及淋巴結轉移有關(P<0.05),見表3。

表3 血清miR-92a、miR-143、miR-196b表達與NSCLC臨床病理特征的關系
2.3 miR-92a表達與NSCLC患者預后的關系
采用中位數法,將NSCLC患者分為miR-92a高表達組和miR-92a低表達組,各30例。NSCLCmiR-92a低表達組3年總生存率為66.67%,高表達組3年總生存率為36.67%,兩組比較具有顯著性差異(Log-rank χ2=6.706,P=0.0096),見圖1。

圖1 miR-92a表達與NSCLC患者預后的關系圖
2.4 miR-196b表達與NSCLC患者預后的關系
采用中位數法,將NSCLC患者分為miR-196b高表達組和低表達組,各30例。miR-196b低表達組3年總生存率為63.33%,顯著高于miR-196b高表達組(40.00%),差異具有顯著性(Log-rank χ2=4.83,P=0.0279),見圖2。

圖2 miR-196b表達與患者總生存率的關系
2.5 miR-143表達與NSCLC患者預后的關系
采用中位數法,將NSCLC患者分為miR-143高表達組和miR-143低表達組,各30例。miR-143高表達組3年總生存率為63.33%,高于miR-143低表達組(46.67%)。見圖3。

圖3 miR-143表達與患者總生存率的關系
2.6 NSCLC患者血清miR-92a、miR-196、miR-143的相關性
Pearson相關性分析顯示,NSCLC患者血清miR-92a與miR-196b表達呈正相關性(γ=0.453,P<0.05),miR-143與miR-92a、miR-196b表達呈負相關性(γ=-0.376,-0.356,P<0.05)。
3 討論
近幾年,隨著我國分子生物學領域的不斷發展,miRNA的發現為惡性腫瘤疾病的診斷和預后帶來了新方向,miRNA是一類具有調控基因表達功能的非編碼小分子RNA,有著高穩定性、高保守性、組織特異性等優點,作為腫瘤診斷和預后的分子標志物具有積極優勢[8]。已有研究結果發現多種miRNA參與了NSCLC腫瘤細胞的增殖、分化的調控,且發揮致癌基因或抑癌基因的作用,又或同時具有致癌和抑癌兩種功能[9]。本研究探討了血清miR-92a、miR-143和miR-196b 水平在 NSCLC腫瘤細胞中的表達及其預后關系,對NSCLC的早期預防和術后診斷有著重要作用。
miR-92a、miR-196b屬于促癌基因,與NSCLC腫瘤細胞的增殖、分化、轉移密切相關[10]。miR-143-3p屬于miR-143家族基因,miR-143表達量的顯著降低可能影響腫瘤細胞增殖、轉移和侵襲能力[11]。研究實驗證明,miR-143-3p在胃癌、卵巢癌、骨肉瘤等多種腫瘤細胞中均呈低表達[12],但miR-143在NSCLC的作用機制尚部明確,有待深入研究。本研究結果發現,血清miR-92a、miR-196b在NSCLC組的表達量顯著高于對照組;而miR-143在NSCLC表達量低于對照組。miR-92a、miR-196b高表達和miR-143低表達與腫瘤TNM分期、低分化程度、淋巴結轉移均有關,這與既往研究結果基本一致。提示miR-92a、miR-196b在NSCLS中呈高表達,miR-143呈低表達,且血清miR-92a、miR-196b、miR-143均有可能參與NSCLC腫瘤的發生發展。
研究表明,肺癌組織中miR-92a、miR-143、miR-196b水平可能與患者總生存率有關。分析血清水平與NSCLC患者3年生存率之間的關系,結果顯示,血清miR-92a、miR-196b低表達組NSCLC患者3年生存率高于高表達組,血清miR-143高表達組NSCLC患者3年生存率高于低表達組,進一步分析Pearson相關性,血清miR-92a與miR-196b表達量呈正相關,血清miR-143與miR-92a、miR-196b呈負相關。臨床分期、組織分化和淋巴結轉移是NSCLC主要病理特征,可能是影響肺癌預后的關鍵因素,提示miR-92a、miR-143、miR-196b可作為評估NSCLC病情的潛在生物標志物。
綜上所述,NSCLC患者組織中血清miR-92a、miR-196b表達均上調,miR-143表達下調,且與患者總生存率相關,miR-92a、miR-143、miR-196b的表達可作為NSCLC臨床病情評估和預后的重要依據。

