苦參素對肝癌耐藥細胞株HepG2/ADM的作用及機制研究
王昭輝 王國興 郭東雅
肝癌是全球第二大惡性腫瘤,其發生率和致死率僅次于肺癌,放化療是臨床上治療肝癌的常用手段,但長期使用化療藥物會導致患者出現耐藥性,因此大大降低了臨床療效[1]。傳統中藥因多靶點、低毒性的優點受到學者廣泛關注,苦參素又名氧化苦參堿,是從中藥苦參中提取分離得到的一種生物堿,具有廣泛抗腫瘤活性。研究發現,苦參素可增強化療藥物抗腫瘤效果,提高肝癌荷瘤小鼠免疫功能[2]。苦參素可抑制肝癌HepG2細胞上皮間質轉化,降低癌細胞增殖、遷移和侵襲能力[3]。絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/細胞外調節蛋白激酶(extracellular regulated protein kinases,ERK)信號通路激活與多種惡性腫瘤的進展有關,過表達miR-429可通過抑制ERK/MAPK信號通路降低肝癌HepG2細胞增殖、遷移和侵襲[4]。白芥子穴位貼敷通過阻礙ERK1/2激活可抑制肝癌H22移植瘤生長[5]。基于以上苦參素和ERK/MAPK信號通路在肝癌中的相關研究,本研究主要探討苦參素是否能通過抑制ERK/MAPK信號通路逆轉肝癌細胞化療藥物耐藥性。
1 材料與方法
1.1 細胞系
人肝癌細胞株HepG2和人肝癌耐藥細胞株HepG2/ADM均購自美國ATCC公司。
1.2 試劑和儀器
苦參素購自寶雞市萬晟生物開發有限公司;培養基和胎牛血清購自美國Sigma公司;細胞凋亡檢測試劑盒和MTT試劑盒購自上海碧云天生物科技有限公司;阿霉素購自深圳萬樂藥業有限公司;p-ERK1/2、P-糖蛋白(P-glycoprotein,P-gp)、乳腺癌耐藥蛋白(breast cancer drug resistance protein,BCRP)和肺耐藥蛋白(pulmonary resistance protein,LRP)抗體購自美國Abcam公司;倒置顯微鏡購自日本奧林巴斯公司;多功能酶標儀和凝膠成像儀購自美國Bio-Rad公司;流式細胞儀購自美國Becton Dickinson公司。
1.3 細胞培養
含10%胎牛血清的DMEM培養基培養HepG2細胞。含0.5 nmol/mL濃度 ADM的DMEM培養基培養HepG2/ADM細胞,維持細胞的耐藥性,實驗前一周改用不含ADM的培養基培養。將細胞置于37 ℃、5% CO2的恒溫培養箱中培養,每天更換一次培養基,每2天傳代1次,取第3代對數生長期細胞用于實驗。
1.4 苦參素對HepG2/ADM細胞存活率的影響
胰蛋白酶消化細胞,制成密度為1×104個/mL的單細胞懸液,接種于96孔板,每孔200 μL,置于培養箱中培養。細胞貼壁生長后,隨機分為空白組(只加入完全培養基,不接種細胞),不同濃度苦參素組(5 、10、20、40和60 μg/mL)以及對照組(接種細胞,不加入苦參素),培養24 h后,每孔加入5 mg/mL MTT溶液15 μL,培養箱中繼續培養4 h,每孔加入二甲基亞砜150 μL,37 ℃搖床上孵育震蕩10 min,置于酶標儀上測定492 nm波長處吸光度(A)值,計算細胞存活率率(%)=(實驗組A值-空白組A值)/(對照組A值-空白組A值)×100%。
1.5 HepG2/ADM細胞耐藥性檢測
取第3代對數生長期HepG2細胞和HepG2/ADM細胞,不同濃度阿霉素(1.5、3、6、12和24 μg/mL)處理24 h,根據1.4的方法測定吸光度(A)值,計算細胞抑制率(%)=[(對照組A值-實驗組A值)/(對照組A值-空白組A值)],計算阿霉素半數抑制濃度(half inhibitory concentration,IC50)。耐藥指數(resistance index,RI)=耐藥細胞IC50/親本細胞IC50。為檢測苦參素對HepG2/ADM細胞耐藥性的逆轉作用,采用10 μg/mL苦參素+不同濃度(1.5、3、6、12和24 μg/mL)阿霉素處理HepG2/ADM細胞,計算苦參素逆轉倍數=耐藥細胞IC50/苦參素干預后耐藥細胞IC50。
1.6 Transwell實驗檢測細胞遷移和侵襲能力
將HepG2/ADM細胞隨機分為對照組、苦參素組、阿霉素組、苦參素+阿霉素組,苦參素組細胞用10 μg/mL苦參素處理,阿霉素組細胞用15 μg/mL阿霉素處理,苦參素+阿霉素組細胞用10 μg/mL 苦參素和15 μg/mL阿霉素處理,對照組不用任何藥物處理,培養24 h后,收集細胞。在鋪滿基質膠的Transwell上室中加入200 μL含5000個細胞的細胞懸液,下室中加入500 μL含10%胎牛血清的培養基,培養箱中培養24 h后,多聚甲醛固定10 min,1%結晶紫染色10 min,預冷PBS清洗3次,顯微鏡下拍照并計數。檢測細胞遷移能力時Transwell小室上室中不加入基質膠,其余操作同上。
1.7 流式細胞儀檢測細胞凋亡率
按照1.6的方法處理細胞,24 h后,收集細胞,加入500 μL結合緩沖液將細胞重懸,再加入5 μL Annexin V-FITC和5 μL碘化丙啶,充分混勻,避光孵育20 min,上樣,流式細胞儀檢測細胞凋亡情況。
1.8 蛋白印跡法檢測細胞中蛋白相對表達量
按照1.6的方法處理細胞,24 h后,裂解液裂解,離心收集上清液,按照BCA試劑盒說明書測定蛋白樣品濃度。12%聚丙烯酰胺凝膠電泳,每個上樣孔加入蛋白樣品50 μg,電泳結束后,將蛋白濕轉至PVDF膜上,室溫封閉,GAPDH、p-ERK1/2、P-gp、LRP和BCRP抗體(1∶1000)4 ℃孵育過夜,二抗(1∶5000)室溫孵育1 h,ECL法顯色,Image J分析條帶灰度值,目的蛋白相對表達量=目的蛋白灰度值/GAPDH灰度值。
1.9 統計學分析
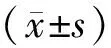
2 結果
2.1 不同濃度苦參素對細胞存活率的影響
細胞存活率隨苦參素濃度的升高逐漸降低(P<0.05)。為滿足后續實驗所需細胞量,本實驗選用細胞存活率接近80%的苦參素濃度10 μg/mL進行后續實驗,見表1。

表1 不同濃度苦參素對細胞存活率的影響
2.2 耐藥細胞的耐藥性及苦參素逆轉倍數
阿霉素作用于HepG2細胞和HepG2/ADM細胞后,兩種細胞的IC50分別是(4.04±0.63)μg/mL、(19.27±1.69)μg/mL,耐藥指數為4.77。阿霉素單獨處理HepG2/ADM細胞和苦參素聯合阿霉素處理HepG2/ADM細胞的IC50分別為(18.66±0.84)μg/mL、(7.25±0.37)μg/mL,苦參素逆轉倍數為2.57。
2.3 細胞遷移能力檢測結果
與對照組比較,苦參素組和阿霉素組遷移細胞數減少(P<0.05);與苦參素組和阿霉素組比較,苦參素+阿霉素組遷移細胞數均減少(P<0.05),見表2,圖1。

圖1 結晶紫染色檢測遷移細胞數(×200)

表2 各組細胞遷移能力比較
2.4 細胞侵襲能力檢測結果
與對照組比較,苦參素組和阿霉素組侵襲細胞數減少(P<0.05);與苦參素組和阿霉素組比較,苦參素+阿霉素組侵襲細胞數均減少(P<0.05)。見表3,圖2。

圖2 結晶紫染色檢測侵襲細胞數(×200)

表3 各組細胞侵襲能力比較
2.5 細胞凋亡率檢測結果
與對照組比較,苦參素組和阿霉素組細胞凋亡率升高(P<0.05);與苦參素組和阿霉素組比較,苦參素+阿霉素組細胞凋亡率升高(P<0.05)。見表4,圖3。

圖3 流式細胞儀檢測細胞凋亡

表4 各組細胞凋亡率比較
2.6 蛋白印跡法檢測結果
與對照組比較,苦參素組p-ERK1/2、P-gp、LRP和BCRP蛋白相對表達量降低(P<0.05);與阿霉素組比較,苦參素+阿霉素組p-ERK1/2、P-gp、LRP和BCRP蛋白相對表達量均降低(P<0.05)。對照組和阿霉素組各蛋白相對表達量比較,差異無統計學意義(P>0.05)。見表5,圖4。

圖4 細胞中各蛋白表達Western blot圖

表5 各組細胞中p-ERK1/2、P-gp、LRP和BCRP蛋白相對表達量比較
3 討論
腫瘤多藥耐藥性(MDR)是指腫瘤細胞對一種化療藥物產生耐藥性的同時,對其他結構不同、作用靶點不同的藥物也產生耐藥性的現象,MDR是惡性腫瘤治療失敗的重要原因之一[6],嚴重制約患者的化療效果和預后,因此探討腫瘤耐藥的具體機制、尋找新的治療策略對逆轉肝癌多藥耐藥性具有重要意義。
多項研究表明,苦參素具有逆轉惡性腫瘤耐藥性的作用。Liang等[7]研究表明苦參素通過抑制結腸癌細胞上皮間質轉化和NF-κB信號轉導逆轉5-氟尿嘧啶耐藥性。苦參素通過降低程序性細胞死亡1蛋白表達可逆轉非小細胞肺癌對順鉑的耐藥性[8]。由此可見,苦參素對化療耐藥的肝癌細胞具有一定的作用。本研究通過MTT法檢測不同濃度苦參素對HepG2/ADM細胞的影響,結果顯示:細胞存活率隨苦參素濃度的升高而降低。可見,苦參素對HepG2/ADM細胞的增殖具有一定抑制作用。阿霉素是臨床上常用的化療藥物,本研究用不同濃度阿霉素處理親本細胞HepG2和耐藥細胞HepG2/ADM,發現HepG2/ADM細胞出現明顯耐藥性。通過苦參素聯合不同濃度阿霉素處理HepG2/ADM細胞發現,苦參素明顯逆轉細胞耐藥性。此外,通過檢測細胞遷移和侵襲能力以及細胞凋亡率,我們發現,單獨使用苦參素或阿霉素可升高細胞凋亡率,降低細胞遷移和侵襲能力,而聯合使用苦參素和阿霉素作用效果更為顯著。以上結果表明:苦參素不僅具有抑制HepG2/ADM細胞增殖的作用,而且可逆轉HepG2/ADM細胞對阿霉素的耐藥性。
MAPK是一組信號通路,其中包括ERK信號通路、p38絲裂原活化蛋白激酶(p38 MAPK)以及c-Jun NH2末端激酶(JNK),在細胞增殖分化和生長中起著重要調節作用。MAPK/ERK信號通路不僅能促進加速細胞周期所需基因的積累,而且可調節抑制細胞增殖的基因表達,因此該信號通路與多種惡性腫瘤的發生發展密切相關。Ding等[9]研究發現下調H19可能通過阻斷MAPK/ERK信號通路誘導肝癌細胞氧化應激并逆轉CD133陽性腫瘤干細胞化療耐藥。Ke等[10]研究表明敲除砷抗性蛋白2通過抑制MAPK/ERK通路可降低人膠質母細胞瘤細胞增殖活性。長鏈非編碼RNA0006528通過激活MAPK/ERK信號通路促進人乳腺癌進展[11]。本研究蛋白印跡法顯示:阿霉素和苦參素均可降低p-ERK1/2表達,且兩者聯合作用效果更顯著。
P-gp是多藥耐藥基因編碼產物,主要存在于細胞膜上,其能夠將進入腫瘤細胞的化療藥物主動泵出,減少腫瘤細胞內的化療藥物,從而使細胞產生耐藥性。BCRP是一種新型的ABC轉運蛋白,同樣具有將化療藥物泵出腫瘤細胞的作用。LRP是一種跨膜轉運糖蛋白,它不僅可以阻止某些以細胞核為效應點的藥物通過核膜孔進入細胞核,而且可以將進入細胞質的藥物轉運至運輸囊泡中,從而隔絕藥物發揮作用[12-13]。人肝癌細胞HepG2/ADM中LRP和BCRP表達升高,美洲大蠊提取物可降低LRP和BCRP表達,逆轉耐藥細胞的耐藥性[14]。本研究中苦參素可降低HepG2/ADM中LRP、P-pg以及BCRP蛋白表達,說明苦參素可逆轉HepG2/ADM細胞耐藥性。
綜上所述,苦參素對肝癌耐藥HepG2/ADM細胞的耐藥性具有一定逆轉作用,而且可降低耐藥細胞遷移和侵襲能力,誘導細胞凋亡,其可能是通過抑制ERK/MAPK信號通路發揮作用。為臨床治療肝癌提供理論依據。

