骨代謝標志物與糖尿病周圍神經病變的相關性研究
陶琪,毛櫻
紹興市人民醫院特檢科,浙江紹興 312000
糖尿病(diabetes mellitus,DM)患者血糖代謝紊亂,長期處于高血糖環境會導致機體產生多種慢性并發癥。糖尿病周圍神經病變(diabetic peripheral neuropathy,DPN)是DM非常常見的并發癥,既往一項Meta分析[1]顯示,有30%的DM患者并發DPN。DPN發病機制很復雜、臨床表現多樣[2-4],主要表現為雙側肢體對稱性麻木、疼痛、發涼,嚴重的可以導致肢體劇痛,甚至影響運動功能,增加患者的致殘率和病死率[5]。既往研究表明,糖尿病及其并發癥會侵害機體的微血管,損傷的微血管更容易形成微血栓,微血栓會影響全身的微循環,骨骼內微血管的損傷會造成骨骼內供血出現障礙,骨代謝發生異常[6]。既往研究發現,骨質疏松(osteoporosis,OP)在2型糖尿病患者中發生率較高,這與其微血管并發癥之間有著非常密切的聯系,包括糖尿病腎病(diabetic nephropathy,DN)及糖尿病視網膜病變(diabetic retinopathy,DR)[7],但是既往文獻很少研究DPN與骨代謝之間是否相關,本研究通過對比DPN和NDPN患者的骨代謝指標,研究骨代謝標志物與糖尿病周圍神經病變的相關性。
1 對象與方法
1.1 研究對象
選取紹興市人民醫院肌電圖室2021年1月至2022年2月就診的糖尿病患者187例,合并DPN的入DPN組,沒有合并DPN的入NDPN組。最終DPN組入組70例,NDPN組入組117例。納入標準:確診糖尿病,符合世界衛生組織2009年糖尿病診斷標準。排除標準:①代謝性骨病;②服用影響骨代謝的藥物;③非糖尿病引起的神經病變,如神經卡壓綜合征、格林-巴利綜合征、酒精性周圍神經損害等。本研究通過了紹興市人民醫院倫理委員會的審查(倫理學批號:2022046),并且征得了所有參與者的知情同意。
1.2 研究方法
1.2.1 一般資料及生化指標、骨代謝標志物收集檢索所有患者的詳細病史,登記性別、年齡、病程,測身高、體質量、腰圍,記錄實驗室檢查指標,包括HbA1c、血清鈣(Ca)、血清磷(P)、25羥維生素D[25-hydroxy vitamin D,25(OH)D]、骨鈣素、Ⅰ型前膠原氨基端前肽(amino-terminal propeptide of typeⅠprocollagen,PINP)、Ⅰ型膠原羧基端肽β特殊序列(type Ⅰcollagen carboxy terminal peptide β special sequence,β-CTX)。
1.2.2 糖尿病慢性并發癥的診斷 (1)DPN:①確診糖尿病;②有周圍神經損傷的證據,包括臨床體征和(或)肌電圖的證據;③排除其他原因引起的周圍神經病變。(2)DN:①明確的糖尿病史;②尿白蛋白排泄率>200μg/min或尿常規尿蛋白陽性(尿蛋白定量>0.5g/24h)。(3)DR:Ⅰ期:視網膜微動脈瘤形成和小出血點;Ⅱ期:視網膜硬性滲出或少量出血斑;Ⅲ期:視網膜軟性滲出或少量出血斑;Ⅳ期:視網膜新生血管形成或玻璃體出血;Ⅴ期:視網膜新生血管出血形成纖維增殖;Ⅵ期:增殖牽拉繼發視網膜脫離。
1.3 統計學方法
采用SPSS 21.0統計學軟件對數據進行統計分析,計量資料行正態檢驗,符合正態分布的計量資料以均數±標準差(±s)表示,組間比較采用t檢驗;不符合正態分布的計量資料以中位數(四分位數間距)[M(Q1,Q3)]表示,采用Mann-WhitneyU檢驗;計數資料通過百分比表示,進行χ2檢驗。變量間相關性分析采用Spearman相關分析。探討糖尿病周圍神經病變的影響因素采用二元Logistic回歸分析,P<0.05為差異有統計學意義。
2 結果
2.1 兩組臨床資料比較
與NDPN組相比,DPN組年齡更大、DM病程更長,高血壓患病率、糖尿病慢性并發癥比例更高,差異有統計學意義(P<0.05),見表1。
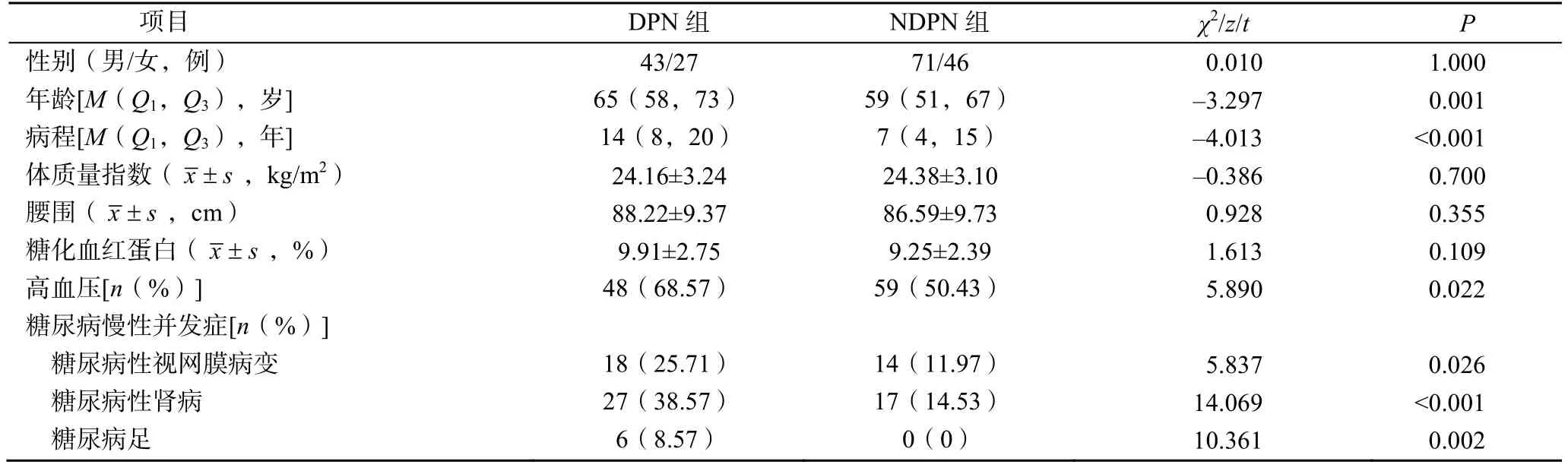
表1 兩組臨床資料比較
2.2 兩組骨代謝標志物比較
DPN組患者25(OH)D、Ca顯著低于NDPN組患者,差異有統計學意義(P<0.05)。兩組間骨鈣素、PINP、β-CTX、P比較差異無統計學意義(P>0.05),見表2。
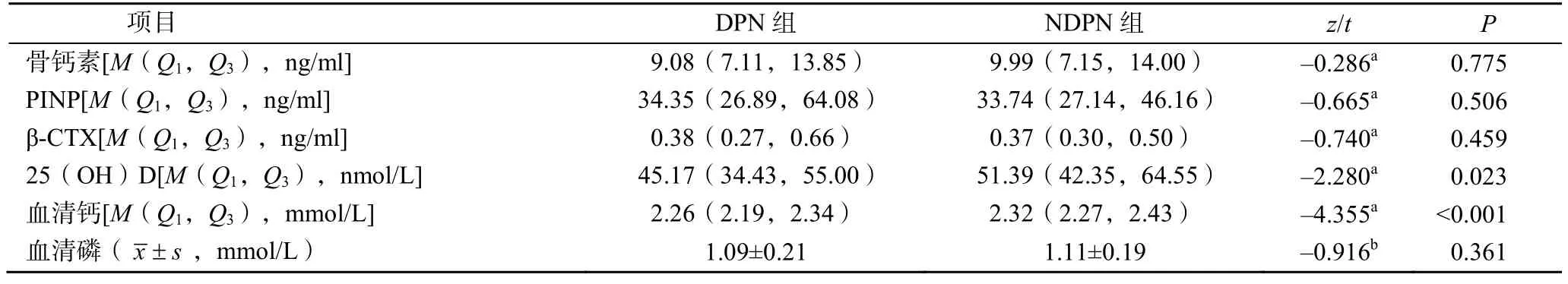
表2 兩組骨代謝標志物比較
2.3 一般臨床資料、骨代謝標志物與DPN的相關性分析
Spearman相關性分析顯示,患者年齡、糖尿病病程、高血壓及糖尿病慢性并發癥與DPN呈正相關(P<0.05),25(OH)D、Ca與DPN呈負相關(P<0.05),見表3、4。

表3 一般臨床資料與DPN相關性分析
2.4 糖尿病患者發生DPN的多因素Logistic回歸分析
以有無合并DPN為因變量,相關分析中有統計學意義的因素為自變量,進行Logistic回歸分析。結果顯示,糖尿病病程、Ca偏低是DPN的獨立危險因素(P<0.05),見表5。
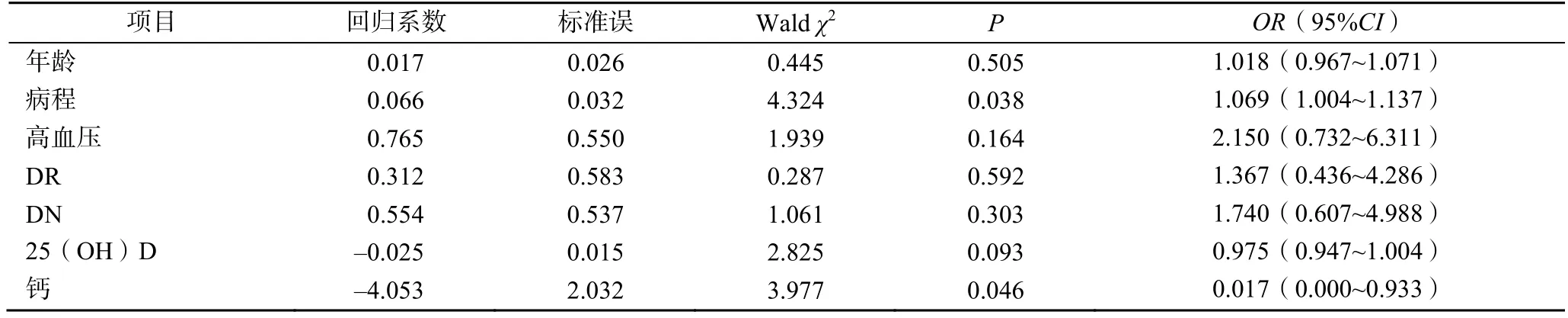
表5 糖尿病患者發生DPN的多因素Logistic回歸分析
3 討論
既往研究發現,DM患者較普通人群更易發生骨質疏松,特別是并發微血管損傷后,骨質疏松及骨折的發生率更高[8]。DPN是糖尿病的常見并發癥,研究表明,DPN是非創傷性骨折的危險因素[9]。DPN發病機制復雜,一般認為與過高的血糖、胰島素抵抗、活躍的多元醇通道、氧化應激產物過多等存在密切聯系[10-11]。其中,長期血糖控制欠佳所導致的過高的血糖和胰島素抵抗是發生周圍神經病變的關鍵因素[12-13]。長時間的高血糖環境使神經外膜血管出現異常,并發毛細血管基底膜的異常增殖,導致血管內膜細胞異常增生,血管管壁較正常變厚,血管管腔較正常變窄,血流動力學發生很大改變,最終導致微循環出現異常[14]。骨骼微血管的分布和功能均發生改變,骨骼血供減少,骨代謝受到影響,骨密度發生變化。
骨代謝產物和相關激素可以間接反映骨代謝狀態。這些可被檢測、與骨代謝相關的生化指標總稱骨代謝標志物。它們大致可以分為以下4類:骨代謝相關激素與細胞因子、骨代謝調控激素、骨轉換標志物和骨代謝相關生化標志物。目前國際上多推薦首選PINP為骨形成標志物,因其濃度和Ⅰ型膠原的合成緊密相關,可以用它來描述骨形成水平,首選β-CTX為骨吸收標志物,它是Ⅰ型膠原降解后形成的,可以用來描述骨吸收水平[15]。維生素D主要以25(OH)D的形式在體內儲存,其濃度可以很好地反映體內總維生素D的情況,鈣和磷在腸道的吸收有賴于維生素D及其代謝物,而血鈣、磷水平的正常是骨骼健康和神經肌肉功能正常的前提和保障。
本研究選取有代表性的幾種骨代謝標志物進行研究,骨形成標志物選擇PINP、骨鈣素,骨吸收標志物選擇β-CTX,骨代謝生化標志物選擇血鈣、磷,骨代謝調控激素選擇25(OH)D。對比DPN組與NDPN組間骨代謝標志物水平發現,與NDPN組相比,DPN組患者25(OH)D顯著低于NDPN組患者。相關性分析顯示,25(OH)D與DPN呈負相關,DPN組患者中65.96%的患者缺乏維生素D,而對照組僅43.75%的患者維生素D不足。這與既往研究結果一致,Ahmadieh等[16]發現DPN組的2型糖尿病患者的平均25(OH)D3水平低于NDPN組,維生素D缺乏癥可作為DPN的預測指標。
施萬細胞可以合成并分泌很多種類的生長因子,例如神經生長因子,胰島素樣生長因子等,它們在神經損傷的修復中起著重要作用。動物實驗發現,VD不足與交感神經、感覺神經元的發育和生存所必需神經生長因子的減少之間存在聯系,并可能影響神經元細胞的鈣穩態,NGF的減少和鈣穩態的缺陷使神經纖維變得脆弱,毒性因素(例如高血糖)更容易損傷神經纖維,維生素D類似物的補充被證實可有效誘導NGF的表達[17]。因此,通過促進NGF的合成,維生素D可以營養周圍神經,從而保護周圍神經。神經元細胞的分化和功能受到維生素D受體的調節,因此,維生素D缺乏會影響到維生素D受體的表達,從而損傷感受器的功能,加重神經損傷。補充維生素D可以改善DPN神經性疼痛并通過修復和保護神經來延緩DPN的進展[18-19]。
本研究還發現,DPN組患者Ca濃度顯著低于對照組,回歸分析顯示Ca偏低是DPN的獨立危險因素。鈣能夠改善微循環,既往研究表明,血鈣水平升高,微血管壁的通透性會下降,血液就不那么黏稠,可以有效防止血栓形成,同時增加血管基底膜的營養,神經組織的供血、供氧、微生態得到改善,從而減輕神經系統的臨床癥狀和體征。鈣的缺乏導致微循環障礙,血流瘀滯,血栓易于形成,從而影響神經組織供血供氧,促進DPN的發生、發展。
綜上所述,糖尿病患者應積極監測25(OH)D、Ca的變化,或可為DPN的預測提供參考,補鈣能改善微循環,提高神經組織供血供氧,從而保護周圍神經,延緩糖尿病周圍神經病變的發生、發展。

