復方苦參注射液對乙肝相關肝細胞癌患者化療效果及T細胞免疫的影響
呂新遠,戴兵,劉馳
南陽市中心醫院普通外科肝臟病區,南陽 473000
我國肝細胞癌(hepatocellular carcinoma,HCC)約占原發性肝癌的90%,其中約80%以上HCC主要由乙型肝炎病毒(hepatitis B virus,HBV)感染所致[1]。多數HCC患者在疾病進展到中晚期時,才會出現肝區疼痛、肝大、腹水等典型癥狀,此時已無法進行外科手術治療,只能采用非手術治療[2]。隨著血管介入放射學的發展,介入治療技術以其微創、快速、安全和有效等優勢,在心腦血管、外周血管、腫瘤等領域取得了飛速發展。經導管動脈化療栓塞(transcatheter arterial chemoembolization,TACE)術是介入放射學最重要的基本技術之一,更是肝癌非手術治療的首選方法,但長期使用化療藥物可能出現藥物不良反應,影響患者預后[3]。中醫藥在防治放化療后的不良反應方面積累了豐富的臨床經驗,部分學者認為化療藥物藥性多峻烈,易困脾傷胃,脾失健運,胃失和降,運化失職[4]。在治療癌癥的過程中,中醫藥在不同階段可起到促進康復、抗復發轉移、增效減毒及提高生活質量等作用,現已被廣泛應用于臨床[5]。復方苦參注射液可清熱利濕、涼血解毒、散結止痛,該藥所含的苦參堿成份具有提高免疫功能的作用[6]。既往多項研究[7-8]報道,復方苦參注射液應用于腫瘤的輔助治療,可顯著提高患者的治療效果。因此推測復方苦參注射液可能通過改善腫瘤患者的免疫功能,提高化療效果。本研究旨在探討復方苦參注射液對HBV相關HCC患者化療效果及T細胞免疫功能的影響,以期為臨床治療HBV相關HCC提供更多的決策依據,現報道如下。
1 資料與方法
1.1 一般資料
選取2019年1月~2021年12月期間于該院確診的106例HBV相關HCC患者作為研究對象,采用隨機數字表法分為對照組與觀察組,每組53例。對照組:男性28例,女性25例;年齡29~77歲,平均年齡(56.21±10.64)歲;CNLC分期:Ⅱ期者13例,Ⅲ期者24例,Ⅳ期者16例;卡諾夫斯凱計分(Kanofsky performance score,KPS)評分58~88分,平均KPS評分(70.94±7.01)分。觀察組:男性27例,女性26例;年齡34~75歲,平均年齡(58.28±8.89)歲;CNLC分期:Ⅱ期者14例,Ⅲ期者23例,Ⅳ期者16例;KPS評分57~84分,平均KPS評分(72.72±6.55)分。兩組一般資料比較無統計學差異(P>0.05),具有可比性。本研究通過醫院倫理委員會審核批準,所有患者及家屬愿意配合完成本研究,并簽署知情同意書。
納入標準:①符合《原發性肝癌診療規范》(2017年版)[9]中HCC相關診斷標準,經影像學、病理檢查確診為HCC,且CNLC分期為Ⅱ~Ⅳ期者。②經實驗室檢查、病理學及影像學診斷為HBV感染者。③無法進行根治性手術治療者。④符合TACE術適應癥,且無相關禁忌癥者。⑤經醫生評估生存時間>3個月者。⑥年齡>18歲者。
排除標準:①存在嚴重心腦血管疾病者。②存在凝血功能障礙者。③存在免疫系統疾病者。④存在嚴重感染者。⑤對造影劑及局部麻醉藥物存在嚴重過敏者。⑥入組前1周使用過其他類似藥物治療者。⑥未能配合完成隨訪者。
1.2 研究方法
所有納入HBV相關HCC患者呈仰臥位,消毒鋪巾后,對股動脈穿刺點注入鹽酸利多卡因注射液(四川國瑞藥業有限責任公司,國藥準字H20055048,規格:10ml∶0.2g)3mg/kg進行局部麻醉,先行股動脈穿刺,置入導管于腹腔干造影見:脾動脈及肝總動脈顯影,肝右葉的腫瘤造影劑濃染。將導管引至肝總動脈近端,置入微導管及微導絲,將微導管引至右肝動脈的腫瘤供血動脈內,造影證實。緩慢注射化療藥物奧沙利鉑注射液[齊魯制藥(海南)有限公司,國藥準字H20203218,規格:40ml∶0.2g]100mg/m2,再次造影見:供血動脈栓塞良好,未見該動脈供應腫瘤。再將導管超選至供應瘤體的肝動脈分支,用碘化油注射液(煙臺魯銀藥業有限公司,國藥準字H37022398,規格:10ml)10~20ml加化療藥物行TACE術化療,直至所有供血動脈栓塞完畢。于右肝動脈最后造影:未見腫瘤染色。手術結束,拔除導管,腹股溝加壓包扎。每次介入治療間隔3~4周,連續進行2次介入治療。觀察組同時靜脈滴注復方苦參注射液(山西振東制藥股份有限公司,國藥準字Z14021231,規格:每支裝5ml)20ml/次,用氯化鈉注射液(辰欣藥業股份有限公司,國藥準字H20056758,規格:50ml∶0.45g)200ml稀釋后使用,qd。在介入術前2~3天起,持續給藥復方苦參注射液10天(全身用藥總量200ml為1個療程),所有患者持續2個療程。
1.3 觀察指標
1.3.1 臨床療效
治療2個療程后,所有入組HBV相關HCC患者參照實體瘤免疫相關療效評價標準(immune response evaluation criteria in solid tumors,iRECIST)[10]進行臨床療效評價:①完全緩解(complete response,CR):非淋巴結病變完全消融,淋巴結短軸<10mm,無新病灶。②部分緩解(partial response,PR):腫瘤負荷減少≥30%。③疾病進展(progressive disease,PD):存在新的可測量/不可測量病變,或相對于最低點,腫瘤負荷增加≥20%。④疾病穩定(stable disease,SD):不符合CR/PR/PD標準者。客觀緩解率(objective response rate,ORR,%)=(CR+PR)例數/每組總例數×100%;疾病控制率(disease control rate,DCR,%)=(CR+PR+SD)例數/每組總例數×100%。
1.3.2 Child-Pugh肝功能分級
將患者5個指標(一般狀況、腹水、血清膽紅素、血清白蛋白濃度及凝血酶原時間)分別記1分、2分和3分,并將5個指標計分進行相加,總和5~15分。參照《內科疾病診斷標準》(第2版)[11]中相關標準評價患者Child-Pugh肝功能分級:5~6分為A級,7~9分為B級,≥10分為C級;分值越高,表示患者的肝功能越差。
1.3.3 肝癌標志物
分別于入院后第1天及治療2個療程后第1天采集兩組HBV相關HCC患者空腹靜脈血4ml,均分為2份,1份使用7060型全自動生化分析儀[日立(中國)有限公司]檢測α-L-巖藻糖苷酶(α-L-fucosidase,AFU)水平;1份使用Avanti JXN-26型高速冷凍離心機(貝克曼庫爾特有限公司,r=10cm),以3000r/min于4℃離心10min后,取血清。采用化學免疫法測定兩組患者血清甲胎蛋白(alpha fetoprotein,AFP)水平,試劑盒購自武漢華美生物工程有限公司。
1.3.4 免疫功能指標
分別于入院第1天及治療2個療程后第1天兩組HBV相關HCC患者空腹靜脈血2ml,使用FACSCantoⅡ分析型流式細胞儀(美國BD公司)檢測患者外周血T細胞亞群CD3+細胞、CD4+細胞、CD8+細胞水平,并計算CD4+/CD8+比值。
1.3.5 不良反應發生情況
觀察并記錄兩組HBV相關HCC患者介入治療后不良反應(發熱、頭痛、惡心、嘔吐、白細胞下降等)的發生情況。
1.4 統計學方法
應用SPSS 22.0軟件進行數據的統計分析。計量資料以±s表示,行t檢驗;計數資料以n(%)表示,行χ2檢驗;等級資料行秩和檢驗。P<0.05為具有統計學差異。
2 結果
2.1 臨床療效
治療2個療程后,兩組患者ORR比較無統計學差異(P>0.05);觀察組患者DCR(86.79%)高于對照組(69.81%,P<0.05)(表1)。
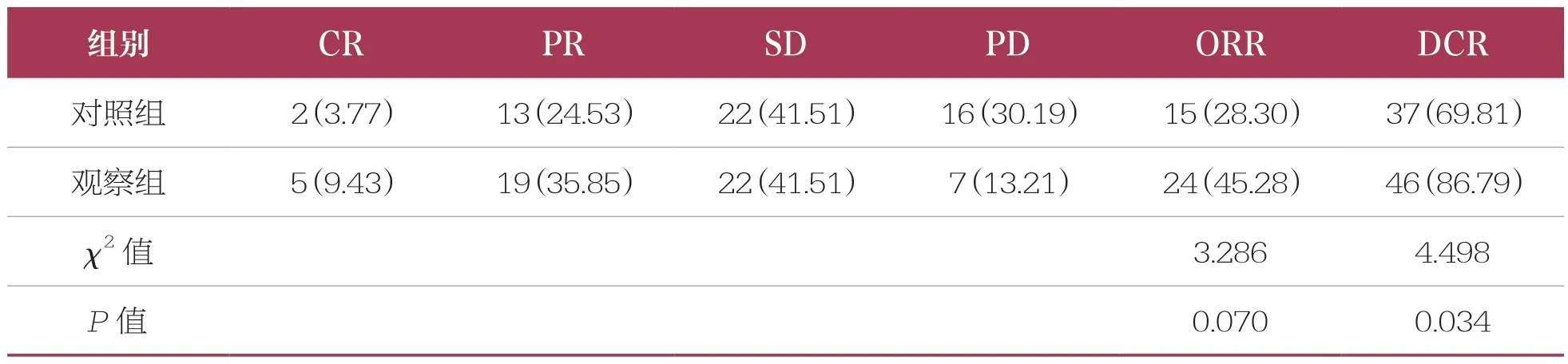
表1 兩組臨床療效比較 n=53,n(%)
2.2 Child-Pugh肝功能分級
治療前,兩組Child-Pugh肝功能A級、B級比例比較無統計學差異(P>0.05);治療后,觀察組Child-Pugh肝功能分級優于對照組(P<0.05)(表2)。

表2 兩組Child-Pugh肝功能分級比較 n=53,n(%)
2.3 肝癌標志物
治療前,兩組AFU、AFP水平比較均無統計學差異(P>0.05);治療后,兩組AFU、AFP均降低(P<0.05),且觀察組低于對照組(P<0.05)(表3)。
表3 兩組肝癌標志物比較 n=53,±s
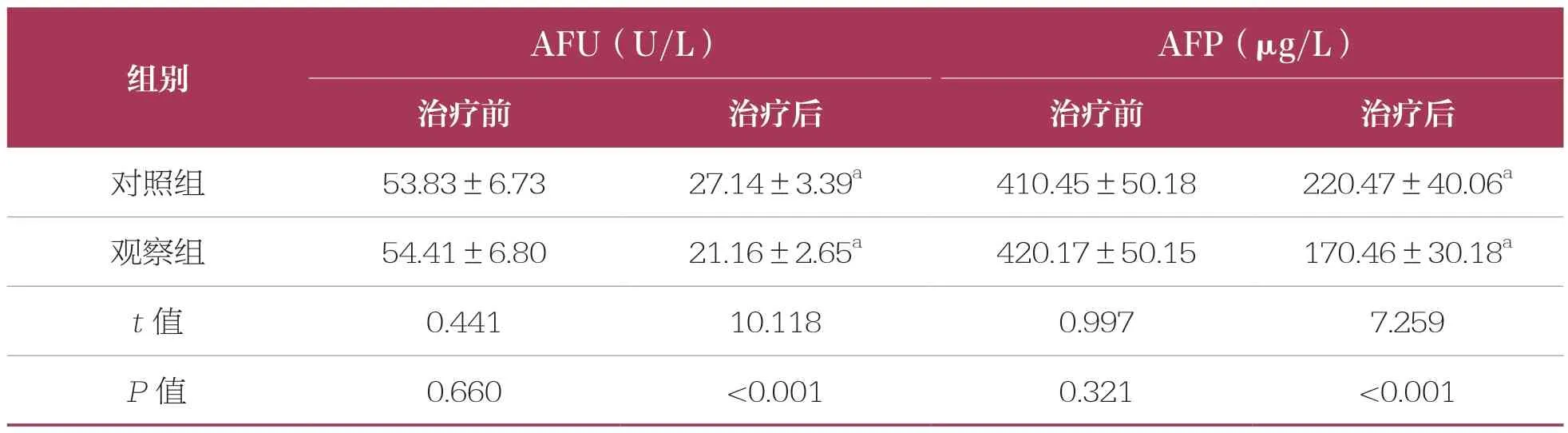
表3 兩組肝癌標志物比較 n=53,±s
AFU:α-L-巖藻糖苷酶;AFP:甲胎蛋白;與同組治療前比較,a:P<0.05。下同
AFU(U/L) AFP(μg/L)治療前 治療后 治療前 治療后對照組 53.83±6.73 27.14±3.39a 410.45±50.18 220.47±40.06a觀察組 54.41±6.80 21.16±2.65a 420.17±50.15 170.46±30.18a t值 0.441 10.118 0.997 7.259 P值 0.660 <0.001 0.321 <0.001組別
2.4 免疫功能指標
治療前,兩組T細胞免疫功能指標比較均無統計學差異(P>0.05);治療后,兩組CD3+、CD4+水平及CD4+/CD8+比值均降低(P<0.05),CD8+水平升高(P<0.05)。但觀察組CD3+、CD4+水平及CD4+/CD8+比值高于對照組(P<0.05),CD8+水平低于對照組(P<0.05)(表4)。
表4 兩組T細胞免疫功能比較 n=53,±s

表4 兩組T細胞免疫功能比較 n=53,±s
CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+治療前 治療后 治療前 治療后 治療前 治療后 治療前 治療后對照組 59.22±9.22組別51.46±1.46a 38.66±4.58 30.02±0.02a 30.31±0.31 38.58±4.07a 1.26±0.16 0.78±0.18a觀察組 58.38±8.38 0.97±0.23a t值 0.588 2.391 0.874 3.698 0.232 5.265 0.312 4.736 P值 0.558 0.019 0.384 <0.001 0.817 <0.001 0.756 <0.001 55.23±5.23a 37.89±4.49 33.15±3.15a 30.12±0.12 34.24±4.41a 1.27±0.17
2.5 不良反應發生情況
對照組患者介入治療術后出現發熱、頭痛、惡心及嘔吐各2例,白細胞下降6例;觀察組患者介入治療術后出現發熱、惡心及嘔吐各2例。觀察組不良反應發生率(11.32%)低于對照組(26.42%,χ2=3.944,P=0.047)。
3 討論
全球范圍內,肝癌的發病率呈持續上升趨勢,其在惡性腫瘤死亡風險排名中居前5位。HBV感染是全球性的公共衛生問題,全球有超過2.5億的HBV感染者,20%以上的HCC患者發病原因都與HBV相關[12]。由于HCC發病隱匿,病情進展較快,往往確診時已發展至中晚期,多數患者已無法耐受手術治療,只能選擇化療方式延長生存時間。TACE屬于一種微創介入化療手段,在臨床上不僅可用于治療肝臟出血,也可用于治療HCC。既往研究[13]報道,TACE治療HCC具有較好的近期療效。但同時也有研究[14]報道,TACE治療后,多數患者出現發熱、肝區疼痛等栓塞后綜合征問題,不利于患者預后。近年來,中西醫結合在中晚期惡性腫瘤的臨床研究取得了一定的成果,并在延緩疾病進展、減輕化療不良反應等方面具有顯著效果[15]。復方苦參注射液是臨床常用的抗腫瘤類中藥注射劑,主要成份為苦參和白土苓。苦參性寒、味苦,具有清熱燥濕的功效;白土苓性平,味甘、淡,具有解毒、除濕、通利關節的功效。研究表明,復方苦參注射液對乙型肝炎和肝癌具有一定的治療作用[16-17]。本研究結果發現,觀察組患者DCR(86.79%)高于對照組(69.81%,P<0.05),提示復方苦參注射液聯合TACE輔助治療HBV相關HCC,可有效提高患者的化療效果。
既往研究[18]報道,TACE可能會造成肝損傷。本研究結果發現,經治療后,觀察組Child-Pugh肝功能分級優于對照組(P<0.05),提示復方苦參注射液聯合TACE輔助治療HBV相關HCC,可緩解TACE造成的肝損傷,對肝臟具有一定的保護作用。分析其原因可能為苦參的主要藥理成份苦參堿具有降酶護肝、抗肝纖維化等藥理作用[19]。
由于肝癌患者外周血AFU水平明顯升高,因此其被認為是肝癌的腫瘤標記物[20]。AFP是一種糖蛋白,肝癌細胞可大量分泌AFP,因此也被認為是肝癌的腫瘤標記物[21]。本研究結果發現,經治療后,觀察組AFU、AFP水平低于對照組(P<0.05),提示復方苦參注射液可與化療藥物產生協同作用,更好地控制腫瘤患者的病情進展,但其可能的作用機制尚未明確,后期仍需進行深入研究以進一步分析其作用機制。
肝癌患者體內T細胞免疫功能被抑制,從而使患者發生免疫功能障礙[22]。CD3+淋巴細胞代表全T淋巴細胞,其包括CD4+和CD8+;CD4+水平降低表明機體免疫功能低下,CD8+水平升高表明機體免疫功能低下。既往研究[23]報道,復方苦參注射液輔助治療,可有效改善晚期腫瘤患者的免疫功能。本研究中,經治療后,兩組CD3+、CD4+水平及CD4+/CD8+比值均降低(P<0.05),CD8+水平升高(P<0.05),但觀察組CD3+、CD4+水平及CD4+/CD8+比值高于對照組(P<0.05),CD8+水平低于對照組(P<0.05)。此外,本研究結果顯示,觀察組不良反應發生率(11.32%)低于對照組(26.42%,χ2=3.944,P=0.047)。以上結果提示復方苦參注射液聯合TACE輔助治療HBV相關HCC,可有效緩解化療導致的免疫功能損傷,減少不良反應的發生風險,分析可能與復方苦參注射液的主要藥理成份可提高機體免疫力有關[24-25]。
綜上所述,復方苦參注射液輔助TACE治療HBV相關HCC,可提高患者化療效果,調節患者T細胞免疫功能,降低不良反應的發生率。然而,本研究仍存在一定的局限性,如納入樣本量較少,且為單中心研究,可能會存在一定的數據偏倚,后期仍需進一步采用多中心、大樣本試驗進行深入探究。

