類風濕關節炎患者腸道黏膜屏障功能指標及sIgA表達與外周血淋巴細胞亞群的關系探討
王紫璇,倪 華,章 玉,楊立娜
(中國人民解放軍西部戰區總醫院 a.腎臟風濕免疫科,b.消化內科,四川 成都 610000)
類風濕關節炎(RA)屬于一種慢性自身免疫性疾病。據統計,我國RA發病率為0.3%~0.5%,且呈逐年遞增趨勢[1,2]。隨著RA分子生物學及免疫學研究深入,馬雪雯[3]指出,RA患者體內相關抗體可在出現關節腫痛、晨僵等臨床癥狀之前存在于血液中,說明觸發RA自身免疫的首發部位可能位于呼吸道、胃腸道等關節外的黏膜部位。其中腸道微生物群在維持機體免疫穩態及建立適應性免疫系統中具有重大意義,而腸黏膜屏障損傷與腸道菌群失調有著直接聯系[4]。分泌型免疫球蛋白A(sIgA)是維持腸道黏膜穩態的主要物質,而外周血淋巴細胞亞群紊亂易造成免疫功能異常,促進RA的進展[5]。故本文旨在分析RA患者腸道黏膜屏障功能指標與sIgA的表達情況及其與外周血淋巴細胞亞群的關系。
1 資料與方法
1.1 一般資料2019年9月至2022年5月我院收治的126例RA患者(RA組)。納入標準:①符合《2018中國RA診療指南》[6]的診斷標準,并經CT、MRI等檢查確診;②病歷資料完整;③患者關節壓痛數量在5個以上、關節腫脹數量在3個以上;④患者均知情同意;⑤患者入院時處于疾病活動時期且均未接受系統治療。排除標準:①其他類型骨關節炎及結締組織病;②合并乙型肝炎、肺炎等感染性疾病;③存在骨腫瘤、胃癌等惡性腫瘤或存在嚴重胃腸道疾病。其中男37例,女89例,年齡58~72歲[(65.34±3.28)歲],病程2月至11年[(5.08±2.15)年],紅細胞沉降率(56.39±19.27)mm/h;DAS-28評分(4.82±1.61)分;IgG水平(13.69±3.52)g/L;IgM水平(1.31±0.62)g/L;IgA水平(3.43±1.39)g/L;C3(1.09±0.35)g/L;C4水平[0.2(0.1,0.3)]g/L;RF滴度[111(30,433)]U/ml。選取同期體檢的健康志愿者81例為對照組,男23例,女58例,年齡57~73歲[(66.07±3.86)歲]。兩組性別、年齡等基線資料比較,差異無統計學意義(P>0.05)。本研究通過醫院倫理委員會審批。
1.2 方法①資料收集:由專業醫務人員在患者入院時,詳細記錄患者年齡、性別、家族史、吸煙飲酒史、合并癥及各項生化指標結果等臨床資料,并統一納入研究系統進行比較。②腸屏障功能評估:抽取受檢者空腹靜脈血3~4 ml,隨后進行離心處理(10 min,3000 r/min),分離血清后將其置于-80 ℃低溫保存待檢。使用DAO/D-乳酸/細菌內毒素聯檢試劑盒(酶法)定量測定血清DAO、細菌內毒素及D-乳酸水平。②sIgA水平檢測:患者在采樣前均無腹瀉、嘔吐史,取糞便稱重,加入生理鹽水,將其稀釋為1∶3。隨后進行離心處理(2000 r/min,10 min),取上層清液置于-80 ℃低溫保存待檢,采用ELISA法檢測sIgA水平。③外周血淋巴細胞亞群檢測:抽取受檢者肘靜脈血5 ml,使用流式細胞儀(Calibur,美國BD公司)進行檢測。
1.3 觀察指標①比較兩組腸道黏膜屏障功能相關指標及sIgA水平,包括DAO、血細菌內毒素及血D-乳酸。②比較兩組外周血淋巴細胞亞群變化情況。③分析T淋巴細胞亞群與DAO、D-乳酸、內毒素及sIgA的關系。
1.4 統計學方法采用SPSS 20.0軟件分析數據。符合正態分布的計量資料以均數±標準差描述,組間比較采用獨立樣本t檢驗;不符合正態分布的計量資料以M(Q1,Q3)表示,組間比較采用非參數檢驗。計數資料以例數(%)表示,組間比較采用χ2檢驗;相關性檢驗采用Pearson線性相關分析。P<0.05為差異有統計學意義。
2 結果
2.1 兩組腸道黏膜屏障功能相關指標及sIgA水平比較RA組DAO、細菌內毒素、D-乳酸水平高于對照組,sIgA水平低于對照組(P<0.05)。見表1。
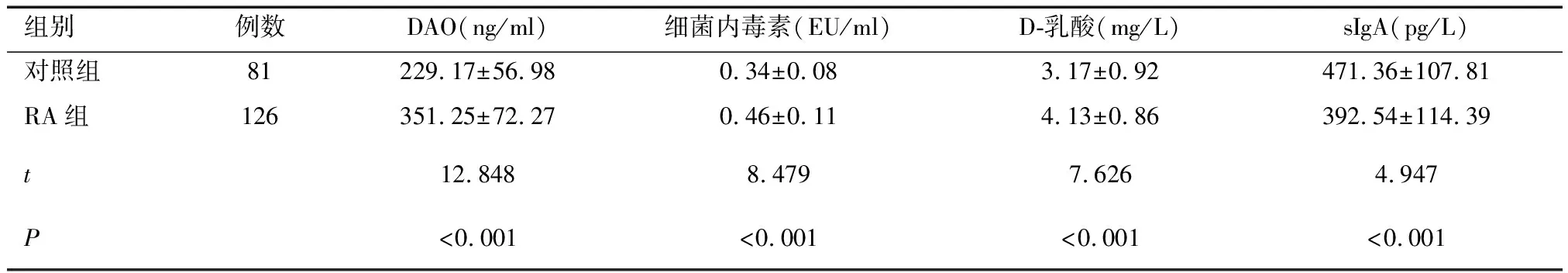
表1 兩組腸道黏膜屏障功能相關指標及sIgA水平比較
2.2 兩組外周血淋巴細胞亞群變化情況比較RA組總T淋巴細胞CD3+、輔助/誘導T淋巴細胞CD4+、抑制/殺傷T淋巴細胞CD8+及NK淋巴細胞CD16+CD56+絕對計數低于健康對照組(P<0.05),兩組B淋巴細胞CD19+絕對計數比較,差異無統計學意義(P>0.05)。見表2。

表2 兩組外周血淋巴細胞亞群絕對計數比較 (cell/μl)
2.3 外周血淋巴細胞亞群與DAO、D-乳酸、細菌內毒素及sIgA的相關性分析輔助/誘導T淋巴細胞CD4+絕對計數與血清DAO、細菌內毒素、D-乳酸水平呈負相關,與sIgA呈正相關(P<0.05);B淋巴細胞CD19+絕對計數與sIgA呈負相關(P<0.05)。見表3。

表3 外周血淋巴細胞亞群與DAO、D-乳酸、內毒素及sIgA的相關性分析
3 討論
RA是以B淋巴細胞功能亢進和T淋巴細胞機能顯著下降為特征的自身免疫性疾病,具體的發病機制尚未完全明確。但以往多項研究顯示,RA患者存在較為嚴重的細胞免疫異常,RA的發生與外周血淋巴細胞亞群的數量及功能紊亂存在聯系[7,8]。故密切監測外周血淋巴細胞亞群的變化情況在RA的臨床診斷及早期治療中具有重要意義。
2012年美國風濕病學會提出,將RA相關環境及遺傳風險因素階段、無臨床關節炎癥狀階段及RA相關系統性自身免疫階段總稱為RA臨床前期[9]。Greenblatt[10]報道,部分患者在RA臨床前期未發生自身免疫性組織損傷的條件下已出現自身抗體水平異常等情況,在環境、遺傳等多種因素的共同作用下啟動自身免疫反應,造成免疫性組織損傷。且多種基因測序技術證實,RA的始動源于機體黏膜系統,發現部分RA患者腸道乳酸菌豐度增加、嗜血桿菌減少,且上述改變與自身抗體滴度和疾病的活動度相關,提示腸道菌群紊亂可出現于RA臨床癥狀之前[11,12]。胡丹[13]的動物實驗研究結果顯示,RA臨床前期人群的腸道菌群使得小鼠腸道黏膜屏障損傷,導致相關菌群穿透黏膜發生移位,造成全身免疫系統失衡。因此,本文主要分析RA患者腸道黏膜屏障功能指標與sIgA的表達情況及二者與外周血淋巴細胞亞群的關系,旨在為RA的臨床診療提供新思路。DAO、D-乳酸及細菌內毒素等實驗室檢查指標常用于評估腸黏膜屏障受損情況,而sIgA主要位于腸系膜淋巴結等黏膜下相關組織中,其屬于黏膜免疫系統的重要抗體,在復雜的腸道內環境中發揮保護作用;若sIgA選擇性不足可造成循環免疫復合物水平的升高,從而增加消化系統感染性疾病的發生風險[14]。本研究結果顯示,RA組DAO、細菌內毒素、D-乳酸水平高于對照組。陳昌明等[15,16]研究表明,部分早期RA患者均存在亞臨床腸道炎癥,主要以T、B細胞及浸潤性單核細胞、CD68+巨噬細胞數量增加為典型特征。RA相關自身免疫及生物標志物的改變是在黏膜部位觸發的,如胃腸道、口腔等部位,當腸黏膜屏障完整性被破壞后,導致黏膜通透性增加,造成相關細菌產物向血清和淋巴器官的移位,故RA患者DAO、細菌內毒素、D-乳酸水平顯著升高。而腸上皮細胞形成的動態物理屏障通過細胞旁途徑嚴格控制抗原的運輸,當腸黏膜受到內源性、外源性等不同抗原刺激時,易產生大量sIgA,其能包裹有害病原體抗原且有效中和毒素,抑制病原體黏附于腸上皮表面。本研究中,RA組sIgA水平低于對照組。說明RA患者存在明顯的黏膜免疫功能紊亂,抵御外來病原微生物的能力減弱,當DAO、細菌內毒素、D-乳酸水平升高、sIgA濃度降低則提示RA患者存在腸道黏膜屏障受損。另一方面,本次結果顯示,RA組CD3+、CD4+、CD8+及CD16+CD56+絕對計數低于對照組,與黃懿敏[17]研究結果相似。分析原因在于:RA患者存在免疫調節紊亂,由于過度刺激NK淋巴細胞CD16+和輔助/誘導T淋巴細胞CD4+,進而導致上述細胞發生嚴重衰竭,且隨著抑制/殺傷T淋巴細胞CD8+的損害,造成CD4+/CD8+比例失調,誘發B淋巴細胞過度增殖,引起自身抗體的大量生成。由于T淋巴細胞具有免疫調節及免疫效應的雙重功效,其中抑制/殺傷T淋巴細胞CD8+發揮免疫抑制作用,而輔助/誘導T淋巴細胞CD4+通過分泌相關細胞因子來增強免疫應答過程,而上述兩類細胞在功能上相互制約,共同維持機體免疫系統的平衡,若外周血淋巴細胞亞群數量及功能紊亂導致該平衡被打破,進而引起RA的發生及發展[18]。除此之外,本研究顯示,輔助/誘導T淋巴細胞CD4+與血清DAO、細菌內毒素、D-乳酸水平呈負相關,與sIgA呈正相關,B淋巴細胞CD19+與sIgA呈負相關。目前在已確診的RA和RA前期的患者中已觀察到腸道通透性改變的跡象,腸道菌群在免疫系統的誘導和功能以及個體對自身抗原的反應中起著基礎性作用。由于自身抗體可在發炎的腸道內產生,當腸道炎癥及屏障功能損傷時,腸道組織中的相關免疫細胞可進入全身部位和關節,關節組織通常被 T 細胞、B 細胞和巨噬細胞等免疫細胞浸潤,產生多種促炎細胞因子,促進炎癥并最終導致組織破壞,引起RA的發生[19]。而B淋巴細胞存在于腸系膜淋巴結及派氏淋巴結等腸道相關淋巴組織中,腸道微生物代謝產物及相關抗原易促進黏膜漿細胞的分化,易加快B細胞類別轉換至IgA型細胞,其中富含IgA的漿細胞在免疫應答過程中可分泌大量sIgA。本研究只初步探討腸黏膜屏障功能及sIgA二者與外周血淋巴細胞亞群的關系,為RA腸道研究提供新證據,但具體的影響機制仍需進一步分析。
綜上所述,RA患者DAO、細菌內毒素、D-乳酸水平升高,sIgA水平降低;二者與輔助/誘導T淋巴細胞CD4+相關。

