一氧化氮調(diào)控線粒體功能在疾病中的作用
李昊琦,呼慶勛(上海大學(xué)醫(yī)學(xué)院,上海 200444)
一氧化氮(NO)作為生物體內(nèi)具有生物活性的信號(hào)分子,介導(dǎo)多種生物學(xué)作用,在生物系統(tǒng)中發(fā)揮著重要的生理功能。隨著對(duì)NO的深入探索,多項(xiàng)研究表明NO作為一種能在細(xì)胞間傳遞信號(hào)的分子,普遍存在于多種細(xì)胞、組織和器官中,參與心血管穩(wěn)態(tài)[1]、免疫反應(yīng)[2]、神經(jīng)傳遞[3]以及與細(xì)胞凋亡和增殖[4]相關(guān)的多種生理病理途徑。
線粒體是參與調(diào)節(jié)各種重要細(xì)胞過程的細(xì)胞器,除了作為細(xì)胞的能量工廠以產(chǎn)生大量三磷酸腺苷(ATP)外,也在細(xì)胞信號(hào)傳導(dǎo)、細(xì)胞分化、細(xì)胞凋亡等過程中發(fā)揮著重要作用。線粒體通過調(diào)控細(xì)胞代謝和表觀遺傳修飾等機(jī)制對(duì)機(jī)體穩(wěn)態(tài)產(chǎn)生影響,其功能異常將參與多種疾病的發(fā)生發(fā)展。近年來的研究表明NO及其衍生物對(duì)線粒體功能的調(diào)控起到重要影響作用,進(jìn)而影響細(xì)胞生理狀態(tài)和疾病的發(fā)生發(fā)展[5-6]。本文就NO對(duì)線粒體功能的調(diào)控機(jī)制及其通過調(diào)控線粒體功能參與疾病發(fā)病的機(jī)制進(jìn)行綜述。
1 NO的生物學(xué)作用
NO作為一種新型的氣體信號(hào)分子,在氮原子上有不成對(duì)的電子對(duì),對(duì)多種生物分子都具有很高的反應(yīng)性。作為具有脂溶性的介質(zhì),NO可以快速透過生物膜擴(kuò)散發(fā)揮生理作用,但在體內(nèi)具有不穩(wěn)定性,能迅速被血紅蛋白、氧自由基等滅活。
內(nèi)源性NO的產(chǎn)生主要是指在一氧化氮合酶(NOS)催化下,以L-精氨酸和分子氧為底物,在輔助因子四氫生物蝶呤(BH4)、還原型煙酰胺腺嘌呤二核苷酸磷酸(NADPH)、黃素腺嘌呤二核苷酸(FAD)、黃素單核苷酸(FMN)參與下產(chǎn)生。NOS主要包括三種亞型:神經(jīng)元型一氧化氮合酶(nNOS)、誘導(dǎo)型一氧化氮合酶(iNOS)和內(nèi)皮型一氧化氮合酶(eNOS)。在三種亞型中,eNOS主要表達(dá)于內(nèi)皮細(xì)胞、血管平滑肌細(xì)胞、心肌細(xì)胞中,對(duì)于維持心血管系統(tǒng)的穩(wěn)態(tài)是最重要的[7]。nNOS在大腦的特定神經(jīng)元中組成性表達(dá),主要調(diào)節(jié)神經(jīng)信號(hào)轉(zhuǎn)導(dǎo),在骨骼肌和心肌組織中也有表達(dá)。eNOS和nNOS的活性都受Ca2+和鈣調(diào)素(CaM)以及自身翻譯后修飾的調(diào)節(jié)。iNOS最早被發(fā)現(xiàn)存在于巨噬細(xì)胞中,iNOS非鈣離子依賴的特性使其具有較高的催化活性,其催化產(chǎn)生的NO在炎癥條件下的多種生化途徑和能量代謝調(diào)節(jié)中起著核心作用[8]。此外,據(jù)報(bào)道,線粒體基質(zhì)和內(nèi)膜中具有線粒體一氧化氮合酶(mtNOS),以調(diào)節(jié)線粒體的耗氧量和生物發(fā)生。mtNOS被認(rèn)為是nNOS的α亞型,但有關(guān)其性質(zhì)尚未有確切定論[9]。除了NOS的催化作用,NO的合成也可以被其氧化代謝物亞硝酸鹽還原,亞硝酸鹽可以通過與質(zhì)子反應(yīng)或酶促反應(yīng)轉(zhuǎn)化為NO。
NO通過激活環(huán)磷酸鳥苷(cGMP)信號(hào)通路和參與細(xì)胞功能的各種蛋白質(zhì)(包括參與線粒體生物學(xué)的蛋白質(zhì))的S-亞硝基化來介導(dǎo)大部分功能[10]。NO 可激活可溶性鳥苷酸環(huán)化酶(sGC),使細(xì)胞內(nèi)cGMP增加,啟動(dòng)一系列蛋白磷酸化反應(yīng),從而發(fā)揮重要的生理功能。NO-cGMP信號(hào)通路廣泛存在于人類和動(dòng)物的多種組織細(xì)胞中,它代表一種新的細(xì)胞間信息傳遞和細(xì)胞功能調(diào)節(jié)的信號(hào)傳導(dǎo)系統(tǒng)。NO也會(huì)通過cGMP非依賴性途徑介導(dǎo)生物學(xué)效應(yīng),其作用于半胱氨酸殘基,通過S-亞硝基化酶在靶蛋白上產(chǎn)生S-亞硝基硫醇(SNO),稱為S-亞硝基化的翻譯后修飾。
2 NO對(duì)線粒體功能的調(diào)控機(jī)制
2.1 NO介導(dǎo)靶蛋白的S-亞硝基化修飾
S-亞硝基化是指部分亞硝基與蛋白質(zhì)的巰基殘基(S)共價(jià)連接形成S-亞硝基,其動(dòng)態(tài)過程主要由細(xì)胞內(nèi)S-亞硝基谷胱甘肽(GSNO)的水平調(diào)節(jié)。S-亞硝基化是一種基于氧化還原的蛋白質(zhì)翻譯后修飾,可調(diào)節(jié)多種生理和病理過程,若發(fā)生異常可能導(dǎo)致蛋白質(zhì)錯(cuò)誤折疊,發(fā)生細(xì)胞凋亡和代謝紊亂[11]。研究表明NO通過介導(dǎo)靶蛋白的S-亞硝基化修飾可以調(diào)控線粒體功能(見圖1)。
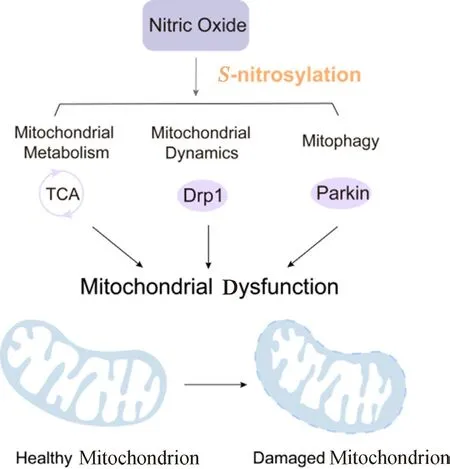
圖1 NO介導(dǎo)靶蛋白的S-亞硝基化修飾調(diào)控線粒體功能Fig 1 Nitric oxide mediates the S-nitrosylation modification of target proteins to regulate the mitochondrion function
NO水平的升高會(huì)導(dǎo)致三羧酸循環(huán)(TCA循環(huán))中的酶以及電子傳遞鏈(ETC)中蛋白質(zhì)的異常S-亞硝基化,從而損害它們的酶活性。ETC中復(fù)合物Ⅰ、Ⅱ、Ⅳ和Ⅴ中關(guān)鍵亞基的直接S-亞硝基化或硝化抑制了它們的呼吸活性,從而抑制了它們產(chǎn)生ATP的能力。
GSNO是NO在體內(nèi)的主要生物活性形式,可被亞硝基化谷胱甘肽還原酶(GSNOR)不可逆分解。因此,GSNOR在NO信號(hào)途徑中可作為主要調(diào)節(jié)因子以調(diào)控反應(yīng)發(fā)生。缺乏GSNOR會(huì)促進(jìn)線粒體亞硝化應(yīng)激,導(dǎo)致動(dòng)力相關(guān)蛋白1(Drp1)和Parkin過度S-亞硝基化,對(duì)線粒體動(dòng)力學(xué)和線粒體自噬產(chǎn)生損傷作用[12]。已有研究表明S-亞硝基化可以調(diào)節(jié)Drp1的磷酸化狀態(tài),從而影響Drp1的定位和功能。Drp1的S-亞硝基化促進(jìn)Ser-616磷酸化,導(dǎo)致線粒體裂變?cè)黾覽13]。在GSNOR敲除小鼠的肝臟和大腦中發(fā)現(xiàn)S-亞硝基化的Parkin累積,表明GSNOR缺乏會(huì)誘導(dǎo)Parkin異常S-亞硝基化從而抑制Parkin活性,導(dǎo)致線粒體自噬失調(diào)[14]。
2.2 NO調(diào)節(jié)線粒體呼吸鏈活性
NO及其衍生物通過不同的機(jī)制抑制線粒體呼吸,低濃度的NO特異性和可逆地抑制細(xì)胞色素C氧化酶,較高濃度的NO可導(dǎo)致呼吸鏈不可逆抑制、解偶聯(lián)、通透性轉(zhuǎn)變或細(xì)胞死亡[15]。NO可以與細(xì)胞色素C氧化酶的血紅素α3-CuB活性中心結(jié)合并抑制其活性。NO與銅離子(CuB)結(jié)合,形成一種新的血紅素-CuB-NO配合物,從而阻礙了ETC的正常運(yùn)作,降低了細(xì)胞色素C氧化酶的活性。NO還通過形成不可逆地抑制線粒體呼吸的高反應(yīng)性分子來發(fā)揮病理生理作用。NO與線粒體氧化磷酸化過程中產(chǎn)生的超氧化物陰離子反應(yīng)形成過氧亞硝酸鹽(ONOO-),破壞基質(zhì)、內(nèi)膜、外膜以及膜間空間中的關(guān)鍵線粒體組分。在線粒體中,ONOO-抑制復(fù)合物Ⅰ、Ⅱ、Ⅳ在呼吸鏈中的作用和ATP合酶的活性,還影響其他蛋白質(zhì)的活性,如錳超氧化物歧化酶(Mn-SOD)和細(xì)胞色素C等,導(dǎo)致線粒體功能障礙[16](見圖2)。

圖2 NO介導(dǎo)線粒體呼吸鏈活性調(diào)控線粒體功能Fig 2 NO mediated mitochondrion respiratory chain activity regulates the mitochondrion function
3 NO調(diào)控線粒體功能在疾病中的作用
3.1 心血管疾病
心血管疾病是全球死亡的主要原因,在心血管疾病的發(fā)生和預(yù)防中,NO起著重要的作用。NO在心血管系統(tǒng)中發(fā)揮保護(hù)作用的機(jī)制主要包括調(diào)節(jié)血壓和血管張力,抑制血小板聚集和白細(xì)胞黏附,防止平滑肌細(xì)胞增殖等[17]。NO生物利用度的紊亂會(huì)導(dǎo)致心血管系統(tǒng)保護(hù)功能的喪失,在某些情況下甚至?xí)铀偌膊∵M(jìn)程。
線粒體是心肌細(xì)胞的能量代謝中心,在維持正常心肌收縮力和心臟活動(dòng)中發(fā)揮必不可少的作用,因此線粒體已成為心血管系統(tǒng)保護(hù)策略的關(guān)鍵靶標(biāo)。NO通過使線粒體呼吸鏈復(fù)合體、代謝酶以及線粒體相關(guān)蛋白質(zhì)發(fā)生S-亞硝基化以影響其活性與功能,參與不同心血管疾病的發(fā)病機(jī)制。早期已有研究發(fā)現(xiàn)NO使線粒體復(fù)合物Ⅰ發(fā)生S-亞硝基化,抑制再灌注期間復(fù)合物Ⅰ活性的恢復(fù),減少活性氧(ROS)的產(chǎn)生,減輕心臟再灌注損傷[18]。同樣,Castillo等[19]在離體大鼠心臟缺血再灌注損傷模型中抑制GSNOR,發(fā)現(xiàn)可促進(jìn)線粒體復(fù)合物Ⅲ和Ⅴ發(fā)生S-亞硝基化。用GSNOR抑制劑治療的心臟顯示心肌損傷標(biāo)志物肌酸激酶的釋放較低,心肌梗死區(qū)域減少,并且改善了缺血后的心室功能,表明S-亞硝基化水平提高在缺血性心臟病中能發(fā)揮一定的心肌保護(hù)作用。Siragusa等[20]研究發(fā)現(xiàn)eNOS與內(nèi)皮細(xì)胞中的丙酮酸激酶2型(PKM2)相互作用并使其S-亞硝基化,降低其酶活性,PKM2抑制將葡萄糖分解代謝轉(zhuǎn)向磷酸戊糖途徑,通過磷酸戊糖途徑增加底物通量,以產(chǎn)生還原當(dāng)量(NADPH和GSH)并防止氧化應(yīng)激,維持內(nèi)皮的氧化還原狀態(tài)。Tang等[21]研究闡明GSNOR在心肌細(xì)胞線粒體定位,通過調(diào)控線粒體蛋白腺嘌呤核苷酸轉(zhuǎn)位酶1(ADP/ATP translocase 1,ANT1)的S-亞硝基化修飾影響線粒體功能,使得線粒體氧化應(yīng)激增加并抑制了線粒體自噬,最終導(dǎo)致心肌重構(gòu)和心力衰竭。因此,推測線粒體GSNOR將會(huì)成為心力衰竭的一個(gè)新治療靶點(diǎn),也有研究已證實(shí)GSNOR可以通過調(diào)節(jié)線粒體動(dòng)力學(xué)和線粒體自噬相關(guān)蛋白的S-亞硝基化水平以維持線粒體穩(wěn)態(tài)并延遲細(xì)胞衰老[12],這表明GSNOR具有間接影響細(xì)胞氧化還原狀態(tài)的效力,可以對(duì)心血管穩(wěn)態(tài)發(fā)揮一定的保護(hù)作用。
綜上研究結(jié)果表明,NO除了作為內(nèi)源性血管舒張因子參與對(duì)心血管的保護(hù)作用外,也可以通過對(duì)心肌線粒體的調(diào)控作用來維持心血管穩(wěn)態(tài)。靶向S-亞硝基化修飾正成為保護(hù)心血管系統(tǒng)的潛在目標(biāo),可以為開發(fā)新的治療策略提供新的途徑,然而一些抑制劑是否會(huì)對(duì)心血管功能造成不良影響仍需進(jìn)一步研究。
3.2 神經(jīng)系統(tǒng)變性疾病
在大多數(shù)神經(jīng)系統(tǒng)變性疾病中,線粒體功能紊亂,ROS和活性氮(RNS)的產(chǎn)生增加,從而導(dǎo)致突觸丟失和神經(jīng)元損傷[22]。RNS過量產(chǎn)生會(huì)導(dǎo)致NO介導(dǎo)的蛋白質(zhì)翻譯后修飾,如半胱氨酸殘基的S-亞硝基化和酪氨酸殘基的硝化。在阿爾茨海默病(AD)中,S-亞硝基化水平升高是其發(fā)病機(jī)制之一,且β-淀粉樣蛋白(Aβ)能在NO調(diào)節(jié)下使得Drp1亞硝基化而導(dǎo)致線粒體分裂增加。Nakamura等[23]發(fā)現(xiàn)AD中iNOS的表達(dá)上調(diào)使NO合成增加,NO進(jìn)而S-亞硝基化Drp1。其研究表明去泛素化酶Uch-L1促進(jìn)S-亞硝基化級(jí)聯(lián)反應(yīng),其將NO基團(tuán)轉(zhuǎn)移到Cdk5,然后再轉(zhuǎn)移到Drp1,刺激Drp1活性增強(qiáng)。由此導(dǎo)致線粒體過度分裂碎片化和生物能量受損,引起神經(jīng)元突觸缺失及細(xì)胞死亡。Wang等[24]研究發(fā)現(xiàn)GSNOR通過減輕Drp1的S-亞硝基化修飾,維持線粒體穩(wěn)態(tài)以及減少神經(jīng)元凋亡蛋白的釋放,從而發(fā)揮神經(jīng)保護(hù)作用。另有研究表明,當(dāng)NO在帕金森病(PD)中表達(dá)過高時(shí),PINK1的S-亞硝基化會(huì)抑制其激酶活性,損害PINK1/Parkin介導(dǎo)的線粒體自噬,從而導(dǎo)致多巴胺能神經(jīng)元細(xì)胞死亡[25]。以上研究揭示了NO介導(dǎo)線粒體動(dòng)力學(xué)和線粒體自噬以致神經(jīng)系統(tǒng)變性疾病的發(fā)生,而靶向部分酶的亞硝基化活性可能是神經(jīng)系統(tǒng)變性疾病的治療靶點(diǎn)。
此外,對(duì)于部分神經(jīng)系統(tǒng)變性疾病,高濃度的NO可通過抑制線粒體呼吸和激活細(xì)胞死亡途徑而導(dǎo)致神經(jīng)毒性。NO是介導(dǎo)PD中多巴胺能神經(jīng)元退變的主要影響因素之一,研究表明NO與多巴胺代謝物3,4-二羥基苯乙酸(DOPAC)的協(xié)同相互作用,可抑制細(xì)胞色素C氧化酶,引起線粒體損傷并通過消耗谷胱甘肽和氮氧應(yīng)激的機(jī)制導(dǎo)致多巴胺能細(xì)胞死亡[26]。iNOS介導(dǎo)的NO產(chǎn)生也有助于α-突觸核蛋白的聚集,導(dǎo)致線粒體呼吸能力下降及多巴胺能神經(jīng)元的選擇性喪失[27]。
3.3 腫瘤
NO在腫瘤中有著雙重作用,低濃度NO可以促進(jìn)腫瘤生長,高濃度NO則可抑制腫瘤細(xì)胞增殖并誘導(dǎo)腫瘤細(xì)胞死亡[6]。當(dāng)NO存在時(shí),與鐵硫簇(Fe-S)形成鐵-亞硝酰復(fù)合物,引發(fā)線粒體去極化,導(dǎo)致線粒體氧化應(yīng)激,介導(dǎo)細(xì)胞凋亡。NO也可抑制電子呼吸鏈復(fù)合物Ⅳ,減少ATP的產(chǎn)生并降低細(xì)胞存活率。這種抑制作用還可以增加ROS/RNS的產(chǎn)生,誘導(dǎo)氧化/亞硝化應(yīng)激或氧化還原信號(hào)傳導(dǎo),引起細(xì)胞凋亡,進(jìn)而可抑制腫瘤進(jìn)展,降低腫瘤細(xì)胞的轉(zhuǎn)移潛力。目前,高濃度NO在腫瘤治療方面具有廣闊的應(yīng)用前景,在腫瘤微環(huán)境中可與ROS反應(yīng)生成具有更強(qiáng)氧化性的活性氮類衍生物,共同影響線粒體功能、調(diào)控細(xì)胞因子,在分子和細(xì)胞水平上有效地抑制腫瘤的生長和轉(zhuǎn)移[28]。
代謝重編程是惡性腫瘤的特征,即使在有氧條件下,腫瘤細(xì)胞仍然以糖酵解途徑為主要能量來源,即Warburg效應(yīng)。NO通過與酶的相互作用或通過激活致癌途徑來影響腫瘤細(xì)胞代謝。Gao等[29]研究表明,nNOS可促進(jìn)磷酸果糖激酶1(PFK-1)亞型PFKM Cys351位點(diǎn)的S-亞硝基化修飾,導(dǎo)致卵巢癌細(xì)胞糖酵解增加。Li等[30]發(fā)現(xiàn)iNOS衍生的NO通過誘導(dǎo)PKM2發(fā)生核轉(zhuǎn)位來促進(jìn)卵巢癌細(xì)胞的糖酵解。另一方面,在腫瘤中發(fā)現(xiàn)編碼TCA循環(huán)酶的基因發(fā)生突變,如富馬酸水合酶(FH)、琥珀酸脫氫酶(SDH)和異檸檬酸脫氫酶(IDH),導(dǎo)致代謝產(chǎn)物琥珀酸、富馬酸和2-羥基戊二酸的豐度增加[31]。這些代謝產(chǎn)物可作為驅(qū)動(dòng)不同癌癥的致病因子,并且代謝物積累會(huì)促進(jìn)惡性腫瘤的發(fā)展。以上研究表明NO誘導(dǎo)代謝變化,導(dǎo)致致癌信號(hào)傳導(dǎo)、增殖和突變發(fā)生率增加,因此靶向腫瘤細(xì)胞代謝可以作為潛在的腫瘤治療手段,但仍需進(jìn)一步研究闡明該類藥物與腫瘤相關(guān)的免疫細(xì)胞產(chǎn)生不良影響的可能性。
3.4 炎癥
巨噬細(xì)胞存在于大部分組織中,與組織穩(wěn)態(tài)、炎癥和宿主防御有關(guān),在一些細(xì)胞因子和內(nèi)毒素的誘導(dǎo)下可以產(chǎn)生大量的NO。NO可以通過改變線粒體生物性質(zhì)來介導(dǎo)巨噬細(xì)胞效應(yīng)活性,并且在控制巨噬細(xì)胞代謝重編程方面具有重要影響。在細(xì)胞代謝方面,NO可以通過抑制TCA循環(huán)中關(guān)鍵酶和相關(guān)代謝產(chǎn)物的活性調(diào)控巨噬細(xì)胞代謝[32]。研究表明NO可以通過抑制烏頭酸酶2(ACO2)以調(diào)節(jié)衣康酸鹽水平來調(diào)節(jié)炎癥信號(hào)傳導(dǎo),并且通過改變呼吸鏈復(fù)合物Ⅰ中關(guān)鍵N-模塊亞基的豐度來調(diào)節(jié)巨噬細(xì)胞呼吸功能[33]。NO還抑制丙酮酸脫氫酶(PDH),通過PDH-E3亞單位(DLD)的半胱氨酸亞硝基化,從而阻斷丙酮酸進(jìn)入TCA循環(huán)[34]。NO通過靶向ACO2和PDH限制了代謝產(chǎn)物進(jìn)入TCA循環(huán),進(jìn)而影響了免疫細(xì)胞代謝重編程。在細(xì)胞凋亡方面,NO可以通過線粒體膜電位直接介導(dǎo)或通過產(chǎn)生過氧化亞硝酸鹽間接誘導(dǎo)細(xì)胞色素C的釋放,進(jìn)而活化半胱氨酸蛋白酶(Caspase)依賴的細(xì)胞凋亡途徑。Simpson等[35]發(fā)現(xiàn)過量的NO促進(jìn)細(xì)胞凋亡和炎癥。巨噬細(xì)胞內(nèi)Caspase-8減少增加了iNOS的表達(dá),從而促進(jìn)了促凋亡蛋白BAX/BAK的信號(hào)傳導(dǎo),以驅(qū)動(dòng)線粒體凋亡。NO影響免疫細(xì)胞代謝和細(xì)胞凋亡新機(jī)制的進(jìn)一步闡明,可以為患有炎癥性疾病的患者帶來新的治療方法。
4 總結(jié)與展望
綜上所述,一氧化氮合酶亞型、S-亞硝基化修飾的靶蛋白、呼吸鏈組分、細(xì)胞因子等是機(jī)體內(nèi)NO調(diào)控線粒體功能的重要因素。NO調(diào)控線粒體功能在各疾病的發(fā)生發(fā)展中發(fā)揮重要作用,靶向該途徑可以為治療各類疾病提供新的治療策略,也為相應(yīng)疾病的藥物研發(fā)提供新的思路。但也應(yīng)注意NO對(duì)于疾病的調(diào)控有雙重性,NO及其衍生物與不同靶標(biāo)的相互作用,具體取決于濃度、時(shí)間和空間限制。因此在臨床治療中有必要提出新的策略來提高NO的生物利用度,以增強(qiáng)其防治潛力。同時(shí)在NO介導(dǎo)線粒體代謝方面也需要進(jìn)一步的研究來揭示復(fù)雜代謝途徑之間的關(guān)系,并發(fā)現(xiàn)調(diào)節(jié)細(xì)胞生命活動(dòng)的新代謝途徑,將有助于我們進(jìn)一步明確靶向目標(biāo),為疾病的防治提供新的策略。

