地榆皂苷Ⅱ抑制乳腺癌MDA-MB-468細胞的作用機制
蔣永旭,陳 穎,汪 雷,孫緒強,唐梅梅,趙飛雨,王啟源,王宏婷,2,王存琴
(1.皖南醫學院 藥學院 安徽省皖南地區植物藥活性篩選與再評價工程實驗室 安徽省多糖藥物工程技術研究中心,安徽蕪湖 241002;2.山東大學 基礎醫學院,山東 濟南 250000)
乳腺癌是威脅全球女性健康的第一大癌癥殺手,對廣大女性生命健康造成極大威脅[1]。近年來,以基因為靶點探討乳腺癌的發生發展機制和應用相關的靶向藥物已成為乳腺癌診斷治療的新趨勢,對提高晚期乳腺癌患者生存率具有十分重要的意義。因此,尋找新型、高效的抗乳腺癌靶向藥物是目前亟待解決的問題。
很多抗癌藥物來源于天然產物或者其衍生物,比如紫杉醇、長春堿、喜樹堿等[2-3],已在臨床上取得了良好的療效。研究發現[4-5]植物中的三萜類成分被證明具有顯著的抗腫瘤活性,并通過多種通路發揮抑制腫瘤細胞增殖,抑制腫瘤細胞遷移和侵襲,影響細胞周期,誘導細胞程序性死亡,抗新生血管生成,減輕氧化應激等作用。地榆皂苷Ⅱ(Ziyuglycoside Ⅱ)是在苦丁茶等天然植物中提取分離得到的一種三萜類皂苷成分,有研究表明其具有良好的抗腫瘤作用[6-10],但該化合物對乳腺癌MDA-MB-468細胞的生物學作用尚未見報道。本研究旨在探討Ziyuglycoside Ⅱ對MDA-MB-468細胞增殖、克隆、遷移和凋亡的影響以及潛在的作用機制,為其在治療乳腺癌方面的進一步開發和利用提供理論依據。
1 材料與方法
1.1 材料
1.1.1 細胞株 人MDA-MB-468乳腺癌細胞(中國科學院上海生命科學研究所細胞庫)。
1.1.2 主要藥物及試劑 地榆皂苷Ⅱ(植標化純生物公司);L-15培養基(Biosharp);胎牛血清(Gibco);CCK-8試劑盒、EdU細胞增殖試劑盒(TMB法)、線粒體膜電位檢測試劑盒(JC-1)(碧云天);Annexin V-FITC/PI細胞凋亡試劑盒(翌圣生物);GAPDH、cleaved caspase-3抗體(CST);羊抗兔IgG-HRP(Biosharp);CoraLite488-conjugated Goat Anti-Rabbit IgG(H+L)(Proteintech)。
1.3 實驗儀器 激光共聚焦顯微鏡(Leica);酶標儀(BioTek);流式細胞儀(BD FACSVerse);倒置顯微鏡(OLYMPUS);凝膠成像系統(GE,Amersham lmager 600)。
1.2 方法
1.2.1 細胞培養 人MDA-MB-468乳腺癌細胞,L-15培養基培養,添加10%胎牛血清、1%雙抗,置于37℃細胞培養箱中常規培養。
1.2.2 CCK-8實驗 收集對數期生長的MDA-MB-468乳腺癌細胞接種到96孔板中,貼壁后給予不同濃度Ziyuglycoside Ⅱ(終濃度為0、0.75、1.5、3、6、12、24、48、96 μmol/L)處理,每組設置6個平行復孔,孵育24 h后每孔加入10 μL CCK-8試劑,繼續培養2 h,酶標儀檢測450 nm處吸光度值,計算各組細胞存活率,實驗重復3次。
1.2.3 EdU實驗 收集對數期生長的MDA-MB-468乳腺癌細胞接種到96孔板中,貼壁后給予不同濃度Ziyuglycoside Ⅱ(終濃度為0、3、6、12、24、48、96 μmol/L)處理,每組設置6個平行復孔,孵育24 h后每孔加入終濃度為10 μmol/L的EdU工作液,繼續培養2 h,隨后根據說明書內容進行后續操作,酶標儀檢測370 nm處吸光度值,實驗重復3次。
1.2.4 形態學實驗 收集對數期生長的MDA-MB-468乳腺癌細胞接種到24孔板中,貼壁后給予不同濃度Ziyuglycoside Ⅱ(終濃度為0、5、10、20 μmol/L)處理24 h后,在倒置顯微鏡下進行觀察拍照,實驗重復3次。
1.2.5 平板克隆實驗 收集對數期生長的MDA-MB-468乳腺癌細胞接種到6孔板中,貼壁后給予不同濃度Ziyuglycoside Ⅱ(終濃度為0、1.25、2.5、5、10、20 μmol/L)處理,在37℃細胞培養箱培養10 d。終止培養,4%多聚甲醛溶液固定30 min,PBS清洗2次,用結晶紫染色30 min,PBS清洗2次,自然晾干,拍照,實驗重復3次。
1.2.6 劃痕實驗 收集對數期生長的MDA-MB-468乳腺癌細胞接種到6孔板中,長滿后無菌槍頭在板內劃線,PBS清洗2次,給予含2%血清的不同濃度Ziyuglycoside Ⅱ(終濃度為0、2.5、5、10 μmol/L)處理,孵育0、24、48 h時,在倒置顯微鏡下觀察細胞遷移情況并拍照,使用ImageJ軟件對圖像進行劃痕面積分析,實驗重復3次。
1.2.7 細胞凋亡實驗 收集對數期生長的MDA-MB-468乳腺癌細胞接種到6孔板中,貼壁后給予不同濃度Ziyuglycoside Ⅱ(終濃度為0、5、10 μmol/L)處理24 h。0.25%胰蛋白酶(不含EDTA)消化,同時收集上清液中的懸浮細胞,1 000 r/min,離心5 min,Binding Buffer重懸細胞,加入FITC和PI染料,避光室溫反應15 min,流式細胞儀進行檢測。使用FlowJo軟件進行圖像的處理分析,實驗重復3次。
1.2.8 JC-1線粒體膜電位檢測實驗 收集對數期生長的MDA-MB-468乳腺癌細胞接種到共聚焦小皿中,貼壁后給予不同濃度Ziyuglycoside Ⅱ(終濃度為0、5、10 μmol/L)處理24 h。PBS清洗,加入1 mL培養基和1 mL JC-1工作液,37℃培養箱孵育20 min,吸去上清,JC-1染色緩沖液清洗2次,加入2 mL正常培養基,激光共聚焦拍照觀察,根據紅綠熒光強度判斷線粒體膜電位變化,使用ImageJ軟件對圖像進行平均熒光強度分析,實驗重復3次。
1.2.9 免疫熒光實驗 收集對數期生長的MDA-MB-468乳腺癌細胞,然后接種到裝有細胞爬片的24孔板中,貼壁后加入10 μmol/L Ziyuglycoside Ⅱ處理24 h。棄培養基,PBS清洗,4%多聚甲醛溶液固定15 min,PBS清洗,山羊血清封閉液封閉后加入一抗cleaved caspase-3(1∶100),4℃孵育過夜。PBS清洗3次,加入二抗CoraLite488(1∶100),室溫避光孵育2 h,PBS清洗3次,加入DAPI染料,避光孵育10 min,PBS清洗3次,防熒光淬滅劑封片,激光共聚焦拍照。使用ImageJ軟件對圖像進行平均熒光強度分析,實驗重復3次。
1.2.10 Western blot實驗 收集對數期生長的MDA-MB-468乳腺癌細胞接種到6孔板中,貼壁后加入10 μmol/L Ziyuglycoside Ⅱ處理24 h。RIPA冰上裂解細胞30 min,4℃ 12 000 r/min離心30 min,BCA蛋白濃度測定。加入蛋白上樣緩沖液,100℃煮沸5 min,經SDS-PAGE電泳,轉膜至PVDF膜,5%脫脂牛奶封閉2 h,TBST清洗3次,每次5 min,加入一抗GAPDH、cleaved caspase-3(1∶1 000),4℃孵育過夜。二抗IgG-HRP孵育1 h(1∶10 000),TBST清洗3次,每次5 min,ECL發光顯影。使用ImageJ軟件測定各條帶灰度值,結果以目的蛋白與GAPDH灰度值的比值表示,實驗重復3次。
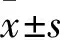
2 結果
2.1 Ziyuglycoside Ⅱ對MDA-MB-468細胞增殖的影響 CCK-8結果顯示,在Ziyuglycoside Ⅱ處理下,細胞存活率呈濃度依賴性下降,細胞增殖受到明顯抑制,IC50=8.803 μmol/L(圖1A);EdU結果顯示,與Control組相比,隨著給藥濃度增大,細胞OD值呈濃度依賴性降低(F=65.450,P<0.001,圖1B)。

A.CCK8實驗檢測不同濃度ZiyuglycosideⅡ處理24 h后的細胞活力;B.EdU實驗檢測不同濃度Ziyuglycoside Ⅱ處理24 h后的細胞增殖情況。與Control組比較,nsP>0.05,***P<0.001。
2.2 Ziyuglycoside Ⅱ對MDA-MB-468細胞形態的影響 與Control組相比,隨著Ziyuglycoside Ⅱ給藥濃度增大,細胞間隙減小,折光增強,細胞萎縮,伴隨大量細胞死亡,懸浮細胞明顯增多。見圖2。
2.3 Ziyuglycoside Ⅱ對MDA-MB-468細胞克隆形成能力的影響 MDA-MB-468單個細胞克隆緩慢,形成的細胞克隆簇較小,與Control組相比,隨著給藥濃度的增大,克隆數均減少,差異有統計學意義(F=166.900,P<0.001)。見圖3。

與Control組比較,***P<0.001。
2.4 Ziyuglycoside Ⅱ對MDA-MB-468細胞遷移能力的影響 在MDA-MB-468細胞中,劃痕24 h時,與Control組相比,10 μmol/L Ziyuglycoside Ⅱ抑制細胞遷移(F=4.071,P=0.0253)。劃痕48 h時,與Control組相比,隨著給藥濃度的增大,細胞遷移率逐漸降低(F=57.810,P<0.001)。見圖4。

與Control組比較,nsP>0.05,*P<0.05,***P<0.001。
2.5 Ziyuglycoside Ⅱ對MDA-MB-468細胞凋亡的影響 如圖5A所示,與Control組相比,MDA-MB-468細胞經Ziyuglycoside Ⅱ處理后,細胞早期凋亡比例增大(F=55.510,P<0.001,圖5B),細胞晚期凋亡比例也增大(F=90.830,P<0.001,圖5C),并呈濃度依賴性。

與Control組比較,*P<0.05,**P<0.01,***P<0.001。
2.6 Ziyuglycoside Ⅱ對MDA-MB-468細胞線粒體膜電位的影響 如圖6A所示,與Control組相比,Ziyuglycoside Ⅱ處理后,紅色熒光比例不斷下降(F=42.250,P<0.001,圖6B),綠色熒光比例不斷升高(F=156.900,P<0.001,圖6B),提示Ziyuglycoside Ⅱ使MDA-MB-468細胞線粒體膜電位下降,誘導細胞發生凋亡。

與Control組比較(紅光),**P<0.01,***P<0.001;與Control組比較(綠光),#P<0.05,###P<0.001。

A.免疫熒光法檢測cleaved caspase-3蛋白平均熒光強度;B.Western blot法檢測cleaved caspase-3蛋白相對表達量。與Control組比較,**P<0.01。
2.7 Ziyuglycoside Ⅱ對MDA-MB-468細胞cleaved caspase-3蛋白的影響 與Control組相比,Ziyuglycoside Ⅱ處理后,cleaved caspase-3蛋白平均熒光強度增強(t=8.367,P<0.01,圖7A);Western blot實驗結果也表明,Ziyuglycoside Ⅱ上調MDA-MB-468細胞cleaved caspase-3蛋白表達(t=8.014,P<0.01,圖7B)。
3 討論
2020年全球最新癌癥負擔數據顯示[11],全球新發乳腺癌患者達到226余萬例,已取代肺癌成為全球第一大癌癥,且發病率呈年輕化趨勢,對廣大女性健康造成重大威脅。手術協同化療藥物仍是至今治療乳腺癌的主要手段,但化療藥物易產生毒副作用和耐受性,影響臨床療效[12]。研究發現,約60%~75%患者出現骨轉移,這也是晚期轉移性乳腺癌最常見的遠處轉移部位,嚴重影響患者自主活動能力和生活質量[13-14]。因此,尋找新型、有效的抗乳腺癌藥物仍是目前亟待解決的問題。Ziyuglycoside Ⅱ是一種三萜類化合物,研究表明其具有很好的抗腫瘤作用[6-10],有望成為一種新型抗癌候選藥。
細胞增殖失調是癌癥特征之一,異常活躍且持續的增殖信號是人類腫瘤惡性增殖的表現,嚴重影響患者生命健康。CCK-8結果顯示,Ziyuglycoside Ⅱ處理24 h后可以顯著抑制MDA-MB-468細胞增殖,并呈濃度依賴性,IC50值為8.803 μmol/L,EdU實驗進一步表明,隨著給藥濃度增大,細胞內DNA合成受到抑制,細胞增殖能力明顯受到抑制,同時平板克隆實驗發現,在1.25 μmol/L Ziyuglycoside Ⅱ處理時,細胞克隆數顯著降低,Ziyuglycoside Ⅱ在低濃度時就有很好地抑制乳腺癌細胞增殖的作用。晚期乳腺癌患者預后差且易轉移是乳腺癌細胞高度惡性的結果,因此,抑制癌細胞轉移可能是改善乳腺癌患者預后的關鍵,本研究結果顯示,Ziyuglycoside Ⅱ可以抑制MDA-MB-468細胞遷移。這些研究結果初步表明,Ziyuglycoside Ⅱ可以顯著抑制乳腺癌細胞增殖、克隆、遷移,表現出顯著的抗腫瘤活性。
細胞凋亡途徑被激活通常被認為是一種抗癌過程[15]。半胱天冬酶家族的成員在細胞凋亡的開始和執行中起著至關重要的作用,可以促進遺傳不穩定或受損細胞的消除。很多傳統的抗癌藥物通過間接地作用半胱天冬酶來誘導細胞凋亡而殺滅癌細胞,其中半胱天冬酶-3(Caspase-3)作為一種關鍵的凋亡效應因子,激活時通常被認為促進凋亡并誘導腫瘤細胞死亡[16-17]。Annexin V-FITC/PI和JC-1染色實驗發現,Ziyuglycoside Ⅱ處理后,早期及晚期細胞凋亡比例明顯升高,且線粒體膜電位降低。免疫熒光及Western blot實驗結果顯示,與Control組相比,Ziyuglycoside Ⅱ組cleaved caspase-3蛋白表達明顯升高。這些結果表明,Ziyuglycoside Ⅱ可以降低線粒體膜電位,并激活Caspase-3誘導細胞凋亡。
綜上所述,Ziyuglycoside Ⅱ可以抑制乳腺癌細胞增殖、克隆、遷移,并誘導細胞凋亡。本研究初步探究了Ziyuglycoside Ⅱ對MDA-MB-468細胞的作用機制,為Ziyuglycoside Ⅱ在治療乳腺癌方面的進一步開發和利用提供依據。

