類風濕關節炎血漿D-二聚體水平與頸動脈粥樣硬化的相關性分析
王瑞 張翊一 羅改瑩
類風濕關節炎(rheumatoid arthritis,RA)是臨床上常見的一種慢性、炎癥性自身免疫性疾病,其基本病理改變為進行性、對稱性、侵蝕性的關節滑膜炎癥,不僅致畸致殘率高,同時在疾病進展過程中可出現如心、肺、腎等關節外的系統損害。有國內外研究顯示,RA患者動脈粥樣硬化性疾病的發病率逐年上升,且合并心血管疾病(cardiovascular arthritis,CVD)已成為RA患者的重要死亡原因之一[1,2]。RA患者CVD發病率高,除了傳統的動脈硬化危險因素增加外,還要考慮慢性炎癥的存在導致血管功能受損、動脈壁增厚以及動脈僵硬度增加。有研究表明,RA患者全身性的炎性反應與血管的凝固性增加及血栓的形成有一定關系[3]。而RA患者關節腔內大量纖維蛋白原以及凝血酶原沉積可誘發全身凝血及纖溶系統激活[4]。血漿D-聚體(D-Dimer)為凝血酶及因子Ⅻ作用的交聯纖維蛋白降解的終末產物,是反映機體繼發性纖溶功能亢進的高度敏感的分子標志物。近年有一些文獻報道,在RA患者中可出現血漿D-Dimer體及纖維蛋白降解產物(fibrin degradation product,FDP)等實驗室指標的升高[5]。另一方面,頸動脈為最常見的動脈粥樣硬化受累血管,超聲下檢測頸部動脈粥樣硬化的程度可間接地反映全身動脈硬化的情況[6]。本研究通過實驗室檢測RA患者的血漿D-Dimer水平以探討血漿D-Dimer在RA患者及RA合并頸動脈粥樣硬化(CAS)患者中的臨床意義。
1 資料與方法
1.1 一般資料 收集2018年1月至2019年1月西安市第五醫院門診及住院就診的RA患者75例(RA組),其中男26例,女49例;平均年齡(56.3±15.8)歲;病程(67.9±48.6)個月;同時收集同期健康體檢者70例作為對照組,其中男35例,女35例;平均年齡(52.1±11.6)歲。2組在性別比、年齡比較差異無統計學意義(P>0.05),且2組均排除吸煙、酗酒、高血壓、高脂血癥、感染、腫瘤、糖尿病、血液系統疾病、妊娠及其他代謝異常疾病或合并嚴重肝腎功能障礙者,且2周內未使用抗凝溶栓類藥物。
1.2 分組標準
1.2.1 RA疾病活動性分組:按照RA的DAS28評分標準,可將RA患者分為2個亞組:DAS28≤ 2.6分為非活動期RA組,其中男11例,女17例;年齡35~69歲,平均(51.20±10.09)歲。DAS28> 2.60為活動期RA組,其中男15例,女32例;年齡33~71歲,平均(51.08±16.09)歲。
1.2.2 RA是否合并CAS分組(根據超聲檢查結果[7]):頸動脈中膜厚度(IMT)>0.9 mm即判斷為增厚,提示早期動脈粥樣硬化。頸動脈粥樣硬化斑塊定義為IMT>1.2 mm,不均勻地累及左右頸總動脈分叉部,伴有或不伴有血流障礙。頸動脈粥樣硬化的改變被定義為頸動脈IMT增加或斑塊的存在。RA合并CAS組,其中男18例,女30例;年齡30~68歲,平均(49.08±15.09)歲。RA未合并CAS組,其中男8例,女19例;年齡33~71歲,平均(50.18±14.39)歲。
1.3 納入與排除標準
1.3.1 納入標準:RA組患者均符合以下條件:1987年美國風濕病學會(ACR)發布的RA分類標準與2009年美國風濕病學會(ACR)/歐洲抗風濕病聯盟(EULAR)發布的RA分類標準。
1.3.2 排除標準:合并其他結締組織病,如系統性紅斑狼瘡等,無相關動靜脈血栓病史,近半年無手術及外傷史。
1.4 血漿D-Dimer水平的檢測 采用ACL TOP 700全自動凝血儀;免疫比濁法;采用BECKMAN COULTER原廠配套試劑。標本要求:空腹采用凝血真空采血管采血1.8 ml,采樣后輕輕顛倒混勻 4~6 次后盡快分離血漿(3 000 r/min,離心 10 min)進行檢測。
1.5 其他實驗室指標測定 C-反應蛋白(CRP):采用BECKMAN COULTER Immage 800 特種蛋白分析儀;免疫散射比濁法;BECKMAN COULTER 原廠配套試劑。標本要求:空腹,采用無添加劑真空采血管采取靜脈血3 ml,靜置,分離血清(3 000 r/min,10 min)。紅細胞沉降率(ESR):ESR-30 全自動動態血沉儀;紅外線阻擋法。標本要求:采用3.8%檸檬酸鈉真空采血管采集靜脈血1.28 ml,采樣后輕輕顛倒混勻6~8次,2 h 內完成檢測。腫瘤壞死因子-α(TNF-α):TNF-α采用雙抗體夾心酶聯免疫吸附法(ELISA) 檢測,試劑盒由美國RB(RAPIDBIO)公司提供,儀器應用雷杜RT-6100型酶標儀所有操作均嚴格按產品說明書進行。標本要求:空腹,采用無添加劑真空采血管采取靜脈血3 ml,靜置,分離血清(3 000 r/min,10 min)。
1.6 DAS28評分標準 使用DAS28評分程序,計算28個關節的腫脹數及壓痛數[28個關節包括膝關節(n=2),肩關節(n=2),肘關節(n=2),腕關節(n=2),掌指關節(n=10),近端指間關節(n=10)]以及CRP和ESR水平。DAS28 > 2.60表示疾病活動;DAS28 ≤ 2.60表示疾病緩解。
1.7 超聲檢查 采用EsaoteDU6彩色超聲診斷儀對2組進行檢查,探頭LA523,頻率5~13 MHz。受試者取平臥位,充分暴露頸部,檢查時頭偏向對側,探頭置于頸部,分別連續測量3次雙側頸總動脈內中膜厚度(CIMT),取平均值。頸動脈超聲是在對研究對象進行資料采集的同一天完成,均由1名經驗豐富的超聲醫生進行檢測。根據2013年歐洲高血壓學會(ESH)/歐洲心臟病學會(ESC)高血壓患者心血管危險因素控制指南,異常頸動脈IMT增厚通常定義為厚度>0.9 mm。頸動脈粥樣硬化斑塊定義為局部增厚>1.2 mm,不均勻累及整個左側或右側頸總動脈分叉,無論是否存在血流障礙[7]。
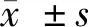
2 結果
2.1 2組血漿D-Dimer水平、ESR、CRP、CIMT值比較 活動期、非活動期RA組血漿D-Dimer水平、ESR、CRP、CIMT值明顯高于對照組,其中活動期RA組血漿D-Dimer水平、ESR、CRP、CIMT值高于非活動期RA組(P<0.05)。見表1。

表1 2組血漿D-Dimer、ESR、CRP、CIMT值比較
2.2 RA合并CAS與RA未合并CAS患者血漿D-Dimer水平比較 RA患者中合并CAS患者血漿D-Dimer水平、ESR、CRP、TNF-α高于RA未合并CAS患者(P<0.05)。見表2。

表2 RA合并CAS組與RA非合并CAS組血漿D-Dimer、ESR、CRP、TNF-α比較
2.3 RA患者血漿D-Dimer水平與RA疾病活動及CIMT值的相關分析 血漿D-Dimer水平與RA疾病活動的及CIMT值呈正相關(rs=0.154,P<0.05)。Logistic回歸分析顯示,血漿D-Dimer水平升高為RA患者發生CAS的危險因素(OR=2.52,P<0.05)。見表3。

表3 RA患者血漿D-Dimer水平與RA疾病活動及CIMT值的相關分析
3 討論
有研究顯示,RA患者心血管疾病的病死率比一般人群高出50%[8]。RA患者罹患急性心肌梗死的風險較一般人群可增加2~3倍,罹患急性心力衰竭(CHF)和心源性猝死的風險可增加2倍,罹患缺血性腦卒中的風險可上升1.7倍[9]。Del Rincón等[10]研究表明,RA發病初期就可出現動脈粥樣硬化,RA病程越長,動脈粥樣硬化就越嚴重,罹患CVD的風險越高。因此,近年RA患者合并動脈硬化性疾病備受關注。甚至權威組織歐洲抗風濕聯盟(EULAR)也提出應加強類風濕關節炎患者心血管疾病的監測。
在RA患者疾病進展中,尤其是在疾病活動期,炎性反應不斷增強,致大量炎性細胞因子(C-反應蛋白、白細胞介素-1、白細胞介素-6、腫瘤壞死因子-α等)由關節滑膜組織不斷釋放進入全身體循環,導致機體血管內皮細胞功能障礙、血管平滑肌細胞的遷移和增生、巨噬細胞吞噬脂質、斑塊破裂和血栓形成等[11]。其次,傳統風險因素影響可能加速RA患者動脈硬化進展,如吸煙、高血壓、脂質代謝異常、糖尿病、胰島素抵抗等。RA相關炎性因子不僅在調節機體免疫反應過程中發揮作用,而且可作用于外周組織如肝臟、骨骼肌、脂肪組織、血管內皮等組織,致機體脂代謝紊亂、胰島素抵抗、氧化應激、高凝活性、內皮功能障礙等,從而加速RA患者動脈粥樣硬化加速進展。Hassen Zrour等[12]一項關于RA患者血脂方面的研究發現,HDL-C水平與hx-CPR、ESR呈負相關,Van den Oord等[13]提出HDL-C水平降低可導致動脈粥樣硬化。最后,RA患者關節腔內異常增多的纖維蛋白原或纖維蛋白的沉積促使機體纖溶亢進使微血栓溶解、血管通透性增加。當已經變性的微血管再灌注時,可導致出血、免疫復合物沉積、纖溶系統亢進、微循環障礙[14],促進動脈硬化進展。與此同時,上述各項危險因素又通過復雜的病理生理機制相互影響,進一步促進RA患者動脈壁增厚、動脈僵硬度增加,從而加速動脈硬化的發生及發展,以致RA患者急性血管事件的發生率不斷攀升。
眾所周知,全身各個大中小動脈均可發生動脈粥樣硬化,其中頸動脈、冠狀動脈等大中動脈是最常見的發病部位。由于頸動脈位置較其他大中動脈表淺,易于被體表超聲探及,可作為反應全身動脈硬化情況的縮影,從而證明全身動脈硬化的存在。而且屬于無創性檢測方法,易于操作。通過頸動脈超聲對標準切面的掃描及探查,不僅可以顯示動脈內中膜的厚度[15]、斑塊的部位和大小、管腔狹窄部位和嚴重程度,還能進行血流動力學測定,并可對斑塊進行形態學評價;因此是目前公認的預測大血管粥樣硬化病變可靠的定量指標[16]。本研究中對RA組及對照組進行頸動脈粥樣硬化檢查,發現RA組CIMT值明顯高于對照組;疾病活動期RA患者較非疾病活動期RA患者CIMT值明顯升高,(P<0.05),提示RA患者特別是RA疾病活動期患者為發生頸部動脈硬化的高危群體,與古麗米熱·喀熱等[17]研究基本一致。
在自身免疫性疾病中,血漿D-Dimer水平升高、纖溶活性增強報道逐漸增多[14]。但是關于類風濕關節炎患者中血漿D-Dimer水平與頸部動脈硬化的相關性研究并不多。類風濕關節炎為慢性、炎癥性自身免疫病,異常增多的纖維蛋白原或纖維蛋白的沉積是RA患者關節滑膜炎癥的特征病理表現之一,RA疾病活動時纖溶亢進、微循環障礙,可能是RA患者血管炎形成的原因之一[18]。免疫性血管炎的廣泛存在預示病情活動及疾病進展。有國外研究人員實驗發現,RA患者的血漿D-Dimer水平與類風濕關節炎患者疾病活動度密切相關,血清D-Dimer長時間處于高水平,也是RA患者愈后不良的預測指標[19]。在凝血纖溶系統中,可溶性纖維蛋白在纖溶系統的作用下形成穩定的交聯纖維蛋白,在纖維蛋白酶作用下分解的產物稱為D-Dimer。RA患者的D-Dimer水平升高反映了RA患者高凝纖溶狀態的存在,早期檢測RA患者的D-Dimer水平有利于對高凝狀態的早期預防治療。俞烜華等[20,21]研究發現,FIB、FDP及D-Dimer與RA疾病活動相關指標正相關,FIB、FDP及D-Dimer升高提示體內存在高凝狀態及繼發纖溶亢進,可反映RA疾病活動。通過本研究發現,RA組患者整體血漿D-Dimer水平較對照組顯著升高,且疾病活動期RA患者較非疾病活動期RA患者血漿D-Dimer水平升高,RA合并CAS患者的血漿D-Dimer水平高于無CAS者,差異均有統計學意義(P<0.05),提示高水平的血漿D-Dimer水平可能是RA患者合并CAS的原因之一。相關性分析顯示RA患者CIMT值與血漿D-Dimer水平呈正相關,CIMT值隨血漿D-Dimer水平的升高而升高,由此說明血漿D-Dimer是動脈硬化發生的重要因素。RA患者是動脈硬化發生的高危人群的原因不僅與免疫、血脂代謝紊亂等有關,也與患者血漿D-Dimer的變化密切相關。
綜上所述,RA患者是動脈硬化發生的高危人群且與疾病發展息息相關,在臨床工作中不僅要關注已知因素如免疫、血脂代謝紊亂等的作用,同時也要進一步重視RA、血漿D-Dimer、CAS之間因果關系的變化,以便更有效地綜合評估患者健康狀況,做到疾病一級預防,切實降低患者心腦血管疾病發生率。

