吉西他濱和順鉑新輔助化療聯合手術治療非小細胞肺癌的臨床觀察
李國強 席孝忠 陳 洋
肺癌屬于臨床上最為常見的惡性腫瘤之一,具有發病率高、病死率高的特點。研究稱[1],全世界范圍內每年大約存在160萬人群死于肺癌。根據病理類型,肺癌常分為小細胞肺癌(small cell lung cancer,SCLC)和非小細胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC占80%~85%。目前臨床上主要采用手術治療,但對于晚期患者且伴發淋巴結轉移的患者等,僅僅依靠手術治療效果并不理想,并不能有效切除患者腫瘤組織,且術后復發率高[2]。由此,臨床上常通過手術聯合藥物化療,術前通過予以化療藥物,殺死腫瘤細胞,縮小原發腫瘤組織直徑,同時殺死病灶鄰近腫瘤細胞,可有效降低術后復發率[3]。本次研究探討吉西他濱和順鉑新輔助化療聯合手術治療NSCLC患者效果,內容如下。
1 資料與方法
1.1 一般資料
收集2020年1月至2022年2月在本院就診的NSCLC 100例,根據治療方式的不同進行分組,即對照組、觀察組,均50例。對照組:男性32例、女性18例,年齡42~65歲,平均年齡(55.07±7.15)歲,臨床分期:Ⅱa期16例、Ⅱb期24例、Ⅲ期10例。觀察組:男性33例、女性17例,年齡42~66歲,平均年齡(55.11±7.12)歲,臨床分期:Ⅱa期14例、Ⅱb期25例、Ⅲ期11例。2組一般資料比較,P>0.05。
納入標準:符合NSCLC診斷標準,且經過臨床病理證實;既往無免疫抑制劑、放射及化療治療史;年齡>18歲;入院資料完整。排除標準:合并其他原發性腫瘤疾病、自身免疫性疾病;無法耐受本研究藥物;合并先天性心臟病、嚴重精神疾病;凝血功能異常。
1.2 研究方法
均進行肺癌根治術治療,仰臥位,全身麻醉,腋下取切口,進入至患者胸腔,手術期間密切觀察患者生命體征變化情況,依據患者疾病情況進行全肺切除術、肺葉切除術及袖式肺葉切除術等,若出現淋巴結轉移,完全清除腫瘤組織,關閉手術切口,保留樣本并送檢。觀察組患者于手術前予以注射用鹽酸吉西他濱和順鉑注射液新輔助化療,第1~3天,靜脈滴注順鉑注射液30 mg/m2+氯化鈉注射液500 mL,30 min內滴完;注射用鹽酸吉西他濱,第1、8天靜脈滴注1000 mg/m2吉西他濱+氯化鈉注射液250 mL,30 min內滴完。為預防患者出現頭暈、惡心等癥狀,術前靜脈滴注地塞米松磷酸鈉注射液,10 mg/次。2周為1個化療周期,連續化療2周。
1.3 觀察指標
統計2組患者臨床療效、腫瘤標志物水平、T淋巴細胞亞群水平、不良反應發生率、格拉斯哥昏迷評分。①臨床療效,依據《實體瘤免疫治療療效評價標準》制定相關療效標準[4]。②腫瘤標志物水平,癌胚抗原(Carcinogenic Embryonic Antigen,CEA)、糖鏈抗原19-9(Carbohydrate Antigen 19-9,CA19-9)、糖類抗原CA125(CA125,Carbohydrate antigen 125),分別于治療前后,抽取空腹肘部靜脈血2 mL,離心,3500 r/min,r=8 cm,10 min后,獲取上層血清,并采用酶聯免疫吸附試驗試劑盒檢測。③T淋巴細胞亞群水平,分別于治療前后,抽取空腹狀態下靜脈血2 mL,3500 r/min,r為8 cm,10 min后,獲取上層血清,采用流式細胞儀檢測。④格拉斯哥昏迷評分,分別于治療前、治療2周后、6月統計患者格拉斯哥昏迷評分,分值0~15分,評分越高說明預后越好。
1.4 統計學方法

2 結果
2.1 臨床療效
觀察組臨床有效率為94.00%,高于對照組的62.00%(χ2=14.918,P<0.001)。見表1。

表1 臨床療效/例
2.2 腫瘤標志物水平
治療前,2組CEA、CA19-9、CA125水平比較,P>0.05;治療后,2組CEA、CA19-9、CA125水平均下降,組間比較,觀察組CEA、CA19-9、CA125水平低于對照組,P<0.05)。見表2。
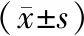
表2 腫瘤標志物水平
2.3 T淋巴細胞亞群
治療前,2組T淋巴細胞亞群水平比較,P>0.05;治療后,2組T淋巴細胞亞群水平均下降,組間比較,觀察組T淋巴細胞亞群水平高于對照組(P<0.05)。見表3。
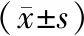
表3 T淋巴細胞亞群
2.4 不良反應發生率
觀察組不良反應發生率為4.00%,低于對照組的20.00%(χ2=6.061,P=0.014)。見表4。

表4 不良反應發生情況/例
2.5 格拉斯哥昏迷評分
治療前,2組格拉斯哥昏迷評分比較,P>0.05;治療2周后、6個月后,2組格拉斯哥昏迷評分均上升,組間比較,P<0.05。見表5。
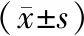
表5 格拉斯哥昏迷評分
3 討論
NSCLC包括鱗癌、腺癌及大細胞癌等,細胞生長較慢,擴散、轉移也較差。與其他類型肺癌進行比較,NSCLC特異度低,早期階段患者臨床癥狀不明顯,且主要好發于中老年男性人群,大部分患者確診后便已發展至中晚期階段,因而易耽誤最佳治療時機,病死率高[5]。相關研究報道,NSCLC患者預后與多種因素存在關系,如臨床分期、淋巴結轉移等[6]。臨床對于NSCLC患者治療,以手術切除為主,化療雖對早期病灶組織具有一定效果,但同時對機體免疫功能產生影響,甚至可能導致耐藥細胞的產生[7]。近幾年,吉西他濱和順鉑新輔助化療用于NSCLC患者,效果理想,并證實可有效提高救治率,改善患者預后[8]。
本次研究結果顯示,與對照組比較,觀察組患者臨床有效率更高,說明吉西他濱和順鉑新輔助化療聯合手術可以有效提高患者臨床療效。惡性腫瘤患者機體內血清腫瘤標志物水平出現明顯異常,臨床上常通過檢測腫瘤標志物水平預測患者病情和預后恢復。CEA、CA19-9、CA125均為廣譜性腫瘤標志物,可通過檢測上述指標水平評估患者病情、療效及預后[9]。本研究發現,與對照組患者比較,觀察組CEA、CA19-9、CA125水平明顯更低,表明吉西他濱和順鉑新輔助化療聯合手術可有效降低腫瘤標志物水平。這一結果與目前相關研究報道具有一致性[10]。分析其原因,手術治療后,可清除能夠分泌上述腫瘤標志物的細胞,從而降低血清中CEA、CA19-9、CA125水平,手術前予以吉西他濱和順鉑新輔助化療,可延緩腫瘤細胞轉移或者殘留細胞病期,最終減少腫瘤標志物水平[11]。化療藥物雖具有一定輔助治療作用,但對機體免疫功能也存在很大影響,因此選取盡可能對機體免疫功能小的藥物尤為重要。而本研究結果顯示,與對照組比較,觀察組患者CD3+、CD4+水平均明顯更高,說明吉西他濱和順鉑新輔助化療聯合手術對患者機體免疫功能影響小。分析其原因,吉西他濱和順鉑新輔助化療可對機體免疫功能發揮抑制作用,可降低腫瘤負荷,改善腫瘤細胞引起的免疫抑制,最終提高機體免疫功能。
研究稱[12],靶向治療NSCLC患者,可以有效改善患者預后,延長患者生存時間。而本研究結果發現,與對照組比較,觀察組治療2周后、6月后格拉斯哥昏迷評分均更高,表明吉西他濱和順鉑新輔助化療聯合手術有利于減緩腫瘤細胞的轉移速度,進而改善預后。分析其原因,可能由于吉西他濱和順鉑控制腫瘤細胞有絲分裂,并對腫瘤新生血管發揮抑制作用,減少腫瘤組織的血流供應以及營養支持,最終促進腫瘤細胞出現壞死。另外本研究還發現,觀察組不良反應發生率明顯低于對照組患者,說明吉西他濱和順鉑新輔助化療聯合手術安全性高。
綜上所述,吉西他濱和順鉑新輔助化療聯合手術治療非小細胞肺癌患者,可降低患者腫瘤標志物水平,提高臨床療效,對機體免疫功能損傷小,安全性高,值得推廣。

