全腔鏡解剖性肺段切除術對早期非小細胞肺癌患者肺功能及術后并發癥的影響
張振世 師智勇 劉圣武
肺癌在臨床的發生率較高,且近些年由于人們生活方式的持續變化,使得該病的患病率不斷提高[1-2]。非小細胞肺癌(NSCLC)為肺癌內的多見類型,約占肺癌總體的80%,且死亡率較高[3-4]。對于早期NSCLC,以手術為主的綜合治療仍是現階段首選的治療手段。傳統開胸手術因創傷大、術后恢復時間長等缺點在NSCLC臨床治療中應用受限。近年隨著微創技術的發展,使得胸腔鏡下手術得以在早期NSCLC患者治療中逐漸運用[5-6]。然而臨床對于早期NSCLC最佳的手術方式是選用全腔鏡下肺葉切除術還是解剖性肺段切除術仍存爭議。基于此,本研究以該院2020年5月至2021年11月診治的100例早期NSCLC患者為研究對象,以全腔鏡肺葉切除術為對照,分析全腔鏡解剖性肺段切除術在早期NSCLC患者中的具體影響。
1 資料與方法
1.1 一般資料
選取該院2020年5月至2021年11月診治的100例早期NSCLC患者。納入標準:CT檢查顯示肺部結節直徑≤2 cm;既往無惡性腫瘤史;患者簽署知情同意書;患者術前肺功能相對較好,可耐受手術;病歷資料齊全;患者具有較高的依從性。排除標準:心肺代償能力差者;淋巴結活檢顯示有轉移情況;合并免疫系統紊亂者;存在凝血功能異常者;存有全身性感染者;存在酒精、藥物依賴史者;意識不清,無法進行正常溝通者。依據隨機數字表法劃分為兩組,均為50例。對照組女性19例,男性31例;年齡38~69歲,平均年齡(50.29±3.48)歲;病灶部位:15例右上肺葉,18例左上肺葉,17例右下肺葉。觀察組女性20例,男性30例;年齡39~70歲,平均年齡(50.31±3.52)歲;病灶部位:19例右上肺葉,15例左上肺葉,16例右下肺葉。兩組一般資料比較,無統計學差異(P>0.05)。
1.2 方法
兩組均采用氣管插管全麻,患側支氣管予以封堵器進行封堵;患者取側臥位,將腋下墊高后,于患者腋中線第7肋間構建1.5 cm觀察孔,腋前線第4肋間構建2.5 cm主操作孔,腋后線第8肋間構建1.5 cm副操作孔,將胸腔鏡置入。觀察組行全腔鏡解剖性肺段切除術:首先在胸腔鏡下確定肺段切除的邊界,對于肺外周的結節,予以楔形切除術將段間淋巴結等進行冷凍切片檢查,按冷凍切片結果再施行手術;對于處在較深區域的結節,可直接施行肺段切除術;切除時按病變所在區域的不一施以各不相同的手術步驟,對于肺裂發育未完備的患者,起初先對肺段靜脈施行處置,打開血管鞘游離出肺葉靜脈并游離遠處對應肺段靜脈,切斷;解剖深面,游離相應肺段支氣管,以綠色切割縫合器切斷支氣管;肺段動脈在游離之后施以雙重結扎,剪斷。肺段邊界:切斷肺段支氣管后,松開支氣管堵塞球囊,標記切除肺段區域邊緣,然后切除相應肺段,手術時需注意與病變組織保持2 cm距離;肺裂發育較為優良的情況,首先由肺裂中分離肺動脈,同樣打開血管鞘,游離對應遠端肺段動脈,雙重結扎,剪斷;深面游離對應肺段支氣管,以綠色切割縫合器切斷,之后游離肺靜脈遠處對應肺段靜脈血管,以白色切割縫合器切斷;而肺段邊界切除步驟與以上相同;之后去除肺段、肺門、縱膈淋巴結。對照組施以全腔鏡肺葉切除術:操作孔構建方式與觀察組相同,明晰病變組織之后,游離肺葉靜脈,以白色切割縫合器切斷,深面游離肺葉支氣管,以綠色切割縫合器切斷,游離肺葉動脈不盡相同的分支,近端結扎后切斷,肺裂以藍色切割縫合器處理,去除肺門、縱膈淋巴結。兩組均隨訪到手術過后的3個月。
1.3 觀察指標
手術相關指標:統計胸腔引流量、手術與住院時間以及術中出血量。肺功能:在術前、術后3個月應用肺功能檢測儀檢測患者的呼氣流量峰值(PEF)、第1秒用力呼氣量(FEV1)、用力肺活量(FVC)。生活質量:于術前、術后3個月以生活質量綜合評定問卷(GQOLI-74)[7]判定,量表共74個條目,4個維度,5級評分,各維度最終評分=(維度粗分-最低分)×100÷滿分,各維度總分100分,分數高低與生活質量呈正相關。并發癥:統計肺部感染、肺不張等發生率。
1.4 統計學分析
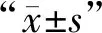
2 結果
2.1 手術相關指標
觀察組手術時間較對照組長,但其他各項手術相關指標均優于對照組,有統計學差異(P<0.05),見表1。
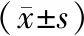
表1 兩組手術相關指標對比
2.2 肺功能
術前兩組PEF、FEV1、FVC相比,無統計學差異(P>0.05);術后3個月觀察組PEF、FEV1、FVC均較對照組高,有統計學差異(P<0.05),見表2。
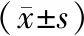
表2 兩組肺功能對比
2.3 生活質量
術前兩組GQOLI-74各維度評分相比,無統計學差異(P>0.05);術后3個月觀察組GQOLI-74各維度評分均較對照組高,有統計學差異(P<0.05),見表3。

表3 兩組生活質量對比分)
2.4 并發癥
兩組并發癥相當,無統計學差異(P>0.05),見表4。
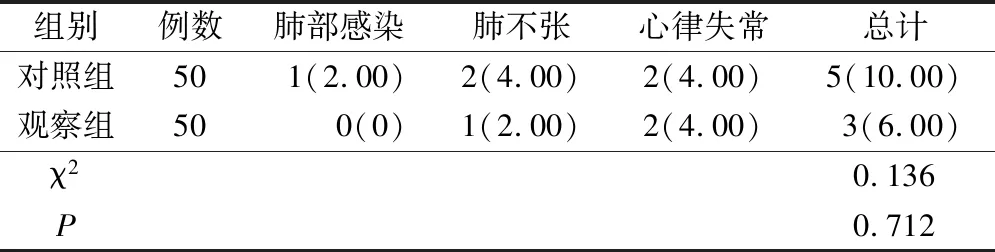
表4 兩組并發癥對比(例,%)
3 討論
早期NSCLC為肺癌的常見類型,且患病率近年呈逐年上升趨勢,嚴重影響人們身心健康[8-9]。對于早期NSCLC,手術為首選治療措施,早期行手術治療可有效去除病灶,延長患者生存周期[10-11]。既往的開胸手術創傷性較大,術后并發癥較多,不利于患者恢復,在臨床的應用逐漸減少,更為安全有效的手術方式也成為臨床研究重點。
胸腔鏡下手術為微創術式,具備損傷小、術后恢復快等優勢,現已在臨床大范圍的運用。全腔鏡下肺葉切除術為現階段臨床治療早期NSCLC的常用方案,可有效去除病灶,提高患者的生存率。然而在手術期間其視野會受出血點的干擾,并易引發血管粘連,不利于肺葉組織分離,從而影響手術效果,無法達到臨床預期。本研究結果顯示,觀察組手術時間長于對照組,分析與肺段解剖的繁復性相關,在手術時對靶肺段血管、支氣管的把握無法準確評判,而對于手術要求快速、準確的定位,故與全腔鏡肺葉切除術比較,全腔鏡解剖性肺段切除術的手術時間更長[12]。本研究結果顯示,觀察組的術中出血量、胸腔引流量少于對照組,住院時間短于對照組,提示全腔鏡解剖性肺段切除術更能夠促進患者術后更快恢復。本研究結果顯示,觀察組PEF、FEV1、FVC與GQOLI-74各維度評分均高于對照組,提示全腔鏡解剖性肺段切除術對早期NSCLC患者的肺功能造成的損害更小,可提高生活質量。其原因為全腔鏡下肺段切除術在手術之中保存較多的健康肺組織,可減少手術創傷,降低出血及術后引流量,有助于患者手術過后的迅速恢復[13-14]。同時,行肺葉切除術后同側殘余的肺葉膨脹會逐漸替代切除肺葉的空間,這種膨脹代償喪失的的肺功能起到一定彌補作用,但會導致殘存肺葉支氣管角度出現轉變,進而使得支氣管原本形態,促使氣道狹窄,增加氣道阻力,繼而給患者殘余肺功能構成損傷。而全腔鏡解剖性肺段切除術因肺組織切除區域較小,膨脹代償作用小,故其肺功能受到支氣管角度轉變的干擾較輕微,有利于術后恢復,進而減輕疾病及手術造成的負面影響,改善生活質量[15]。本研究結果還顯示,兩組并發癥發生率相當,提示全腔鏡解剖性肺段切除術具有較高的手術安全性,其原因為該術式切除組織較小,造成的手術創傷更輕,故并發癥發生率較低。
綜上所述,全腔鏡解剖性肺段切除術雖會延長手術時間,但手術創傷相對較小,術中出血量更少,有利于早期NSCLC患者術后恢復及肺功能改善,進而提高術中,且不會增加并發癥,安全可行,臨床可大力推行。

