鼻咽癌中miR-18a和缺氧誘導因子-1α的表達及其與放療敏感性和預后的相關性
夏新葉 張遠航 李向壘 姜清芳
鼻咽癌(NPC)是中國南方和東南亞最常見的惡性腫瘤之一,其常見的臨床表現包括流鼻血、鼻塞或鼻塞、視力模糊或復視、頸部淋巴結腫大[1]。目前,放療或同步放化療仍是鼻咽癌患者的主要治療手段[2]。在大多數情況下,NPC 對放射治療有中度或高度敏感;然而,在其他一些情況下,NPC對放射治療反應不佳,患者可能在腫瘤轉移后死亡,這給患者及其家屬帶來了巨大的身體、精神和經濟負擔[3]。腫瘤缺氧是NPC治療失敗的主要原因之一[4]。缺氧與腫瘤的發生、侵襲、NPC 的轉移有關,可降低 NPC 對各種治療的敏感性[5]。由于靶向殺傷缺氧腫瘤細胞已成為鼻咽癌治療的重點,作為一種安全、有效、可重復的非侵入性評估鼻咽癌缺氧狀態的方法,對于制定臨床治療方案將尤為重要[6]。缺氧誘導因子 1 α(HIF-1α)是腫瘤細胞適應缺氧的重要調節因子,可調節腫瘤的血管生成、能量代謝、侵襲/轉移和放療耐受性,它已成為近年來應用最廣泛的缺氧標志物之一[7]。有研究發現,miR-18a 在鼻咽癌樣本中上調,在鼻咽癌的發生和發展中發揮作用[8]。有研究報道,miR-18a 可以通過靶向 miRNA 加工酶 DICER112 促進鼻咽癌細胞的增殖[9],然而,尚未研究 miR-18a-3p 在鼻咽癌中的表達模式。因此本研究通過檢測miR-18a和缺氧誘導因子-1α在鼻咽癌中表達水平,探究其與放療敏感性及預后的關系,為臨床制定合理的治療方案提供參考依據。
1 材料與方法
1.1 研究對象
選取2015年2月至2018年2月本院收治鼻咽癌患者91例。①患者符合鼻咽癌的診斷標準[10],經病理檢查確診為鼻咽癌;②入院前患者未接受手術、放療以及化療等;③患者住院后行鼻咽癌根治術,并配合放、化療輔助治療;④患者的臨床資料完整;⑤患者及家屬已簽署知情同意書。排除標準:①合并肝腎功能異常者;②合并其他惡性腫瘤。
1.2 放療敏感性評價
根據實體腫瘤療效評定標準,可將患者分為完全緩解(CR):病灶完全消失;部分緩解(PR):病灶最長徑比化療前減少≥ 30%;穩定(SD):病灶最長徑比化療前減少<30%或者增大<20%;進展(PD):病灶最大徑比化療前增大≥20%。CR+PR為放療敏感組(n=24),SD+PD為放療抵抗組(n=67)。
1.3 檢測 miR-18a及HIF-1α表達水平
于患者入院次日早晨抽取空腹靜脈血3 ml,離心取血清,采用ELISA(試劑盒購自上海生工生物科技有限公司)測定血清HIF-1α水平,具體步驟均按照試劑說明書嚴格操作。采集患者外周靜脈血5 ml,分離血清,并于-20 ℃保存待檢。采用RNA提取試劑盒(購自上海生工生物有限公司),嚴格按照產品說明書步驟進行提取樣本RNA,應用ABI 7500型熒光定量 PCR儀進行熒光定量PCR反應。以下為RT-PCR擴增條件:95 ℃預變性10 min,95 ℃變性30 s,58 ℃退火30 s,72 ℃延伸30 s,以上步驟共重復45個循環。采用2-ΔΔCt法計算miR-18a的相對表達水平。
1.4 統計學分析

2 結果
2.1 miR-18a 、HIF-1α表達與鼻咽癌臨床參數的相關性
miR-18表達水平與鼻咽癌患者年齡、性別、T分期、M分期、N分期以及臨床分期等臨床參數無關(P>0.05); HIF-1α表達水平與鼻咽癌患者年齡、性別、T分期、M分期以及N分期等臨床參數無關(P>0.05),但與臨床分期有關(P<0.05),見表1。
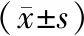
表1 miR-18a 、HIF-1α表達與鼻咽癌臨床病理參數的關系
2.2 兩組臨床病理資料及miR-18a、HIF-1α表達水平的比較
兩組患者年齡、性別、T分期、M分期、N分期以及臨床分期方面比較無統計學意義(P>0.05),化療敏感組miR-18a、HIF-1α的表達水平明顯低于化療抵抗組,差異有統計學意義(P<0.05),見表2。

表2 兩組臨床病理資料及miR-18a、HIF-1α表達水平比較/例
2.3 多因素分析miR-18a、HIF-1α表達與放療敏感性的關系
多因素分析結果發現,miR-18a、HIF-1α表達水平與放療敏感性有關(P<0.05),見表3。

表3 多因素分析結果
2.4 miR-18a 、HIF-1α表達水平與鼻咽癌患者預后的相關性
統計學分析發現:復發、遠處轉移以及死亡患者的 miR-18a 、HIF-1α表達水平明顯高于無復發、遠處轉移以及生存患者(P<0.05),見表4。
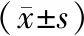
表4 miR-18a 、HIF-1α表達水平與鼻咽癌患者預后的關系
3 討論
鼻咽癌起源于鼻咽壁,是由多種因素引起的惡性腫瘤,涉及遺傳變異、環境因素和EB病毒感染[11]。由于其放射敏感性行為和深層解剖位置,自1965年以來,放射治療已被確立為主要治療方法[12]。1990年代之前,常規二維放射治療是主要的放射治療技術[13]。然而,傳統的頭頸部放療由于其適應度的限制,粘膜炎是口腔黏膜輻射引起的最常見的急性副作用,伴有劇烈疼痛、吞咽困難和營養不良[14]。其他影響包括口干和味覺障礙、聽力喪失、持續性口干、下頜骨放射性骨壞死和吞咽困難。即使對生存結果沒有明顯影響,生活質量也會嚴重受損[15]。放療是針對惡性腫瘤的輔助治療之一,鼻咽癌癌患者使用放療后可在短時間起效果,包括單純放療、術前放療和術后放療[16-17]。放療容易造成患者厭食、惡心、嘔吐、免疫力下降,破壞正常組織等毒副作用[18]。在臨床上,放療敏感性常表現為腫瘤的變小或穩定[19]。在細胞水平上,表現為增殖速度變緩或腫瘤細胞凋亡。因此,研究鼻咽癌放療抵抗的影響因素,對于增強放療敏感性及改善患者預后具有重要意義。
研究報道,失調的miRNA與NPC腫瘤發生、轉移、侵襲和對放療和化療的抵抗有關[20]。MicroRNA在人類的腫瘤發生和癌癥進展中起關鍵作用[21]。特別是,miR-17-92是一種多順反子,編碼六種成熟miRNA,即miR-17、miR-18a、miR-19a、miR-20a、miR-19b和miR-92a,是最有效的致癌miRNA 之一[22]。盡管miR-17-92簇在多種癌癥類型中過度表達,但其他研究表明miR-17-92簇在幾種不同的癌癥中經歷了雜合性的喪失并充當腫瘤抑制因子[23]。miR-18a在NPC組織中顯著上調,可能在NPC的發育中起重要作用[24]。然而,miR-18a在NPC中的作用以及miR-18a促進NPC發育的潛在分子機制仍不完全清楚。缺氧微環境普遍存在于實體瘤中,腫瘤細胞缺氧會導致一系列生物學行為發生變化[25]。HIF-1α是一種異二聚體,在缺氧條件下穩定表達[26]。HIF-1α 具有高靶基因譜,參與調節腫瘤生長、增殖和血管生成[27]。它作為一種重要的轉錄因子調節下游元件,影響腫瘤細胞的能量代謝、增殖和凋亡,從而增強腫瘤的侵襲、進展和轉移[28]。本研究中HIF-1α表達水平與鼻咽癌患者臨床分期有關。化療敏感組miR-18a、HIF-1α的表達水平明顯低于化療抵抗組。多因素分析結果發現,miR-18a、HIF-1α表達水平與放療敏感性有關。復發、遠處轉移以及死亡患者的miR-18a 、HIF-1α表達水平明顯高于無復發、遠處轉移以及生存患者。
綜上所述,鼻咽癌患者miR-18a和缺氧誘導因子-1α水平與放療敏感性有關,發掘出關于鼻咽癌放療敏感性的新預測因子,對提高鼻咽癌的預后效果,制定個體化治療。但是本研究存在局限性,首先它是針對單一中心的研究,其次樣本量不足,因此在今后的研究中注意擴大樣本量以及多中心調查,以此彌補本次研究的不足。

