COX-2、MSS表達與結直腸癌臨床病理特征及其預后的相關性研究
陳曉靜
結直腸癌為臨床常見病,且近年因人們生活結構與飲食習慣的不斷轉變,促使該病的發生率呈逐年上升趨勢[1-2]。結直腸癌的發病機制較為復雜,臨床尚未完全明晰,通常認為該病是遺傳、環境等多種因素共同作用而引發[3-4]。結直腸癌病死率較高,及時明晰本病的發病機制,指導臨床施行針對性的治療,對于改善患者預后至關重要。伴隨分子生物學與遺傳學的持續發展,臨床在分子水平致癌機制的研究中愈發深入。環氧化酶-2(COX-2)能夠于病理條件下被多種損傷迅速激活,尤其是在惡性腫瘤中表現為高表達[5]。微衛星不穩定性(MSI)是該病的發病原理之一,但臨床關于微衛星穩定性(MSS)與結直腸癌發生的關系并不明確[6]。MSS說明腫瘤發生的過程無錯配修復基蛋白(MMR)參與,存在其他分子機制。基于此,本研究分析兩者表達與結直腸癌臨床病理特征以及預后之間的聯系,以及時明晰結直腸癌患者的發病機制,指導臨床進行針對性的治療。
1 材料與方法
1.1 一般資料
選取本院2018年2月至2019年2月收治的64例結直腸癌患者,采集所有患者的病灶組織新鮮樣本(病灶組)與正常腸黏膜(距癌組織≥5 cm)新鮮標本(對照組)。納入標準:所有患者的病歷有關資料齊全;患者經實驗室相關檢查證實。排除標準:存在酒精、藥物依賴史者;合并凝血功能異常者;存在免疫系統病癥者;嚴重電解質紊亂者;合并嚴重的腦器質性疾病者;存有心肝腎等重要臟器功能不全者;合并血液系統疾病者;存有精神疾病,無法配合進行研究者。所有患者中男性38例,女性26例;年齡34~75歲,平均年齡(61.48±2.39)歲;腫瘤直徑3~9 cm,平均直徑(6.45±0.87)cm;分化程度:25例高分化,18例中分化,21例低分化;臨床分期:35例Ⅰ+Ⅱ期,29例Ⅲ+Ⅳ期。
1.2 方法
標本采集:采集全部患者病灶組織新鮮樣本與正常腸黏膜(距癌組織≥5 cm)新鮮標本,全部樣本均經由10%福爾馬林固定,脫水、凈蠟、包埋,切成4 μm切片,之后評分為兩份,于-80 ℃冰箱內保存。COX-2、MSS檢測:采用免疫組化法檢測COX-2表達,應用3%過氧化氫(H2O2)室溫賦育10 min去除過氧化物酶,微波爐內高溫抗原修復10 min;二甲苯脫脂后,行免疫組織化學染色,COX-2滴加抗COX-2單克隆抗體(稀釋度1∶200,北京中杉金橋生物計數有限公司),陰性對照組以磷酸鹽緩沖液(PBS)替代一抗,于4 ℃環境下過夜,之后以PBS反復清洗3次,5 min/次,蘇木精染色,封片鏡檢。陽性判斷標準:嚴格按照染色強度、陽性細胞所占百分比乘積判定,其中染色強度:0分:無色;1分:淡黃色;2分:棕黃色;3分:棕褐色。陽性細胞所占百分比計分:計數1000個腫瘤細胞,陽性表達率10%之下提示無明顯陽性反應,10%以上提示陽性反應,其中陽性表達率≤5%為0分,6%~25%為1分,26%~50%為2分,>50%為3分;兩者相乘為最終評分,其中陰性為0~1分,陽性為2分及以上。MSS檢測:采用免疫組化法測定病灶組織內錯配修復蛋白MLH1、MSH2、MSH6、PMS2的表達,固定病灶組織,包埋,石蠟切片;考片、脫蠟后,以PBS清洗3次,3 min/次,之后以30%H2O2-甲醇混合液浸泡切片10 min,放進染缸(檸檬酸鈉),煮沸10 min,恢復到室溫;之后依據1∶300稀釋兔抗MLH1、MSH2、MSH6、PMS2,50 μL滴至切片組織之上,于4 ℃環境下過夜;完畢后室溫平衡0.5 h,PBS洗滌3次,二抗于組織之上,并以室溫溫育0.5 h;染色、水洗、吹干,封片鏡檢。陽性判斷:MLH1、MSH2、MSH6、PMS2均不見表達缺失(即染色均為陽性)判定為陽性;陰性判斷:4個修復蛋白內任意1個或1個以上表達缺失則判斷為陰性。
1.3 觀察指標
(1)病灶組與對照組COX-2、MSS陽性表達率對比。(2)COX-2、MSS表達與患者臨床病理特征的關系。(3)COX-2、MSS陽性表達與患者預后的關系。
1.4 統計學分析
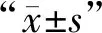
2 結果
2.1 病灶組與對照組COX-2、MSS陽性表達情況對比
病灶組COX-2、MSS陽性表達率顯著高于對照組,有統計學差異(P<0.05),見表1。
2.2 COX-2、MSS表達與患者臨床病理特征的關系
COX-2、MSS陽性表達與結直腸癌患者年齡、性別無關(P>0.05);與腫瘤分化程度、淋巴結轉移、臨床分期以及腫瘤直徑密切相關(P<0.05),見表2。

表2 COX-2、MSS表達與患者臨床病理特征的關系(例,%)
2.3 COX-2、MSS陽性表達與患者預后的關系
Kaplan-Meier結果顯示:COX-2、MSS陽性表達患者的3年生存率明顯低于COX-2、MSS陰性表達患者,有統計學差異(P<0.05),見圖1~2。

圖2 MSS陽性表達者Kaplan-Meier生存曲線分析
3 討論
結直腸癌具有較高的患病率、致死率,亦是影響人們身心健康的重大常見疾病[7-8]。結直腸癌早期確診、治療后患者預后較為好,但結直腸癌早期無明顯特異性癥狀,導致多數患者經臨床診斷時已位于中晚期,且多伴有轉移,難以完全根治,預后較差[9-10]。因此,需探尋具有特異性的生物標志物,以盡早診斷結直腸癌,從而指導臨床施行更為規范的個體化治療,以提高生存率。
COX-2為前列腺素合成所需酶之一,正常組織內其較少表達,但在胃癌等惡性腫瘤中呈現為高表達。相較于MSI,MSS指的是MLH1、MSH2、MSH6 3個MMR均無表達缺失,存在其他分子機制致癌。但臨床關于COX-2、MSS與結直腸癌患者的關系尚未探明,還需進一步探究。本研究結果顯示,病灶組的COX-2、MSS陽性表達率顯著高于對照組,表明COX-2、MSS與結直腸癌的發生、發展聯系緊密。其原因為COX-2存在原癌基因活性,可參與細胞生長、侵襲并阻礙細胞凋亡,并會加快腫瘤增殖[11-12]。而MMS能夠激活下游TGF-β/Smads信號通路,從而加快腫瘤惡化[13-14]。本研究結果顯示,結直腸癌患者的COX-2、MSS陽性表達與分化程度、淋巴結轉移、臨床分期以及腫瘤直徑密切相關,說明COX-2、MSS的陽性表達與結直腸癌惡性程度有關。其原因在于COX-2可加快腫瘤細胞增殖,增強癌細胞入侵功能,并阻礙機體中的抗腫瘤免疫反應。COX-2還可通過刺激腫瘤細胞分泌前列腺素,加快內皮細胞生長,促使血管形成,并通過提高血管內皮生長因子濃度,誘導腫瘤血管形成,促使病情加重[15]。本研究Kaplan-Meier結果顯示:COX-2、MSS陽性表達患者的3年生存率明顯低于COX-2、MSS陰性表達患者,差,提示COX-2、MSS陽性表達的患者預后較差,臨床需予以積極的重視。
綜上所述,COX-2、MSS在結直腸癌患者機體內表達水平較高,COX-2、MSS與患者的臨床病理特征及預后密切相關,且表達水平越高則患者預后越差,臨床可通過檢測COX-2、MSS水平為患者后續治療的開展提供參考。

