基于FDA 不良反應報告系統的瑞德西韋藥品不良反應信號分析
劉肅
廣州市藥品不良反應監測中心,廣東 廣州 510160
2020 年2 月11 日,世界衛生組織宣布,新型冠狀病毒感染的肺炎正式被命名為“2019冠狀病毒病”(COVID-19)。COVID-19的常見癥狀為發熱、咳嗽和全身肌痛,還包括咳痰、頭痛和腹瀉[1]。瑞德西韋(remdesivir)由吉利德科學公司(Gilead Sciences)開發,具有廣譜抗RNA 病毒的活性,對冠狀病毒科的SARS-CoV、MERS-CoV、SARS-CoV-2 和能夠感染人呼吸道上皮細胞的蝙蝠冠狀病毒株等多個RNA 病毒具有很強的抑制活性,對副黏病毒科的Nipah 病毒、呼吸道合胞病毒和Hendra 病毒及絲蟲科的埃博拉病毒也有抑制作用[1]。2020 年5 月1 日,美國食品藥品監督管理局(Food and Drug Administration,FDA)為尚在研究中的瑞德西韋發放治療COVID-19 的緊急使用授權(emergency use authorization,EUA),用于治療疑似或確診COVID-19 的成年和兒童重癥患者。同年10 月22 日FDA 批準瑞德西韋注射液上市,用于治療因COVID-19 住院的成人和年齡≥12 歲、體質量≥40 kg 的住院兒科患者[2-4]。瑞德西韋的不良反應報道大部分來自隨機對照臨床試驗研究,我們需要搜集和分析更多的藥物使用安全數據來評價瑞德西韋在COVID-19 中的作用,尤其是對真實世界數據的挖掘和分析,來監測和評價藥品上市后的應用現狀,為更安全的使用前景提供參考。
1 資料與方法
1.1 數據來源
本研究數據來源于FDA 建立的藥品不良事件自發呈報系統(FDA Adverse Events Reporting System,FAERS),該系統是一個開放的自發性上報系統,采用國際醫學用語詞典(Medical dictionary for regulatory activities,MedDRA)中的首選術語(Preferred terms,PT)編碼和定義各種不良事件(adverse drug reaction event,ADE)。在FAERS 系統中,不良事件是指和用藥相關的所有醫學事件,包括癥狀、體征、疾病的發生,診斷、治療各種手段的應用等。各種身份的人包括醫生、藥師、患者和制藥公司都可以登錄報告。
1.2 數據查詢
以瑞德西韋的通用名“remdesivir”為關鍵檢索詞在FAERS 系統專業查詢ADE,檢索結果包括年份報告數量、年齡性別分布、不良事件名稱、結果、報告者來源等內容。
1.3 數據提取
本研究使用應用程序OpenVigil2.0 作為數據提取工具,直接獲取FAERS 數據庫中的原始信息,用Web 分析工具選擇“DRUG”檢索“remdesivir”,選擇不良事件角色檢索“PT”提取數據,篩選出以瑞德西韋為PT 的ADE 報告。
1.4 數據分析
本研究①采用描述性方法,查詢時間范圍為2020 年1 月1日至2022 年6 月30 日,將FAERS平臺獲得的全部ADE 報告從各個方面進行列表分析;②采用報告比值比(reporting odds ratio,ROR)法作為信號檢測方法[5]對例數較高的不良事件分析,從ROR 值來判斷該信號與瑞德西韋的使用的關聯性。該方法基于比例失衡法四格表,獲取首要懷疑藥物(PT)的目標ADE 報告數及ADE 發生的背景數據,根據公式計算ROR 值。報告數≥3,ROR 值≥2,ROR 的95%CI置信區間下限>1,為滿足閾值條件,即生成一個信號[5],有信號則提示ADE 與PT 之間存在統計學上的關聯性。
1.5 ADE 信號歸類
本研究將7 846 例ADE 報告按例數進行統計,將較高例數的信號PT 術語按照系統器官分類(system organ class,SOC)進行歸類。
2 結果
2.1 ADE 基本情況
報告總數7 846 份,其中以瑞德西韋為名上報的有6 407 份,以商品名Vekiury 上報的有1 439份。2020 年收到4 560 份報告,2021 年收到2 380份,2022 年906 份。其中嚴重報告數6 097 份,死亡報告1 906 份。絕大部分由醫療專業人士上報,其余由消費者等人群報告。男性患者占比多,為58.30%,女性患者占比37.15%,不詳的占4.55%。18~64 歲人群占比最大,為44.35%,其次為65~85歲患者,為36.74%。報告例數排前5 的國家依次為美國、英國、日本、葡萄牙及意大利報告基本信息見表1。
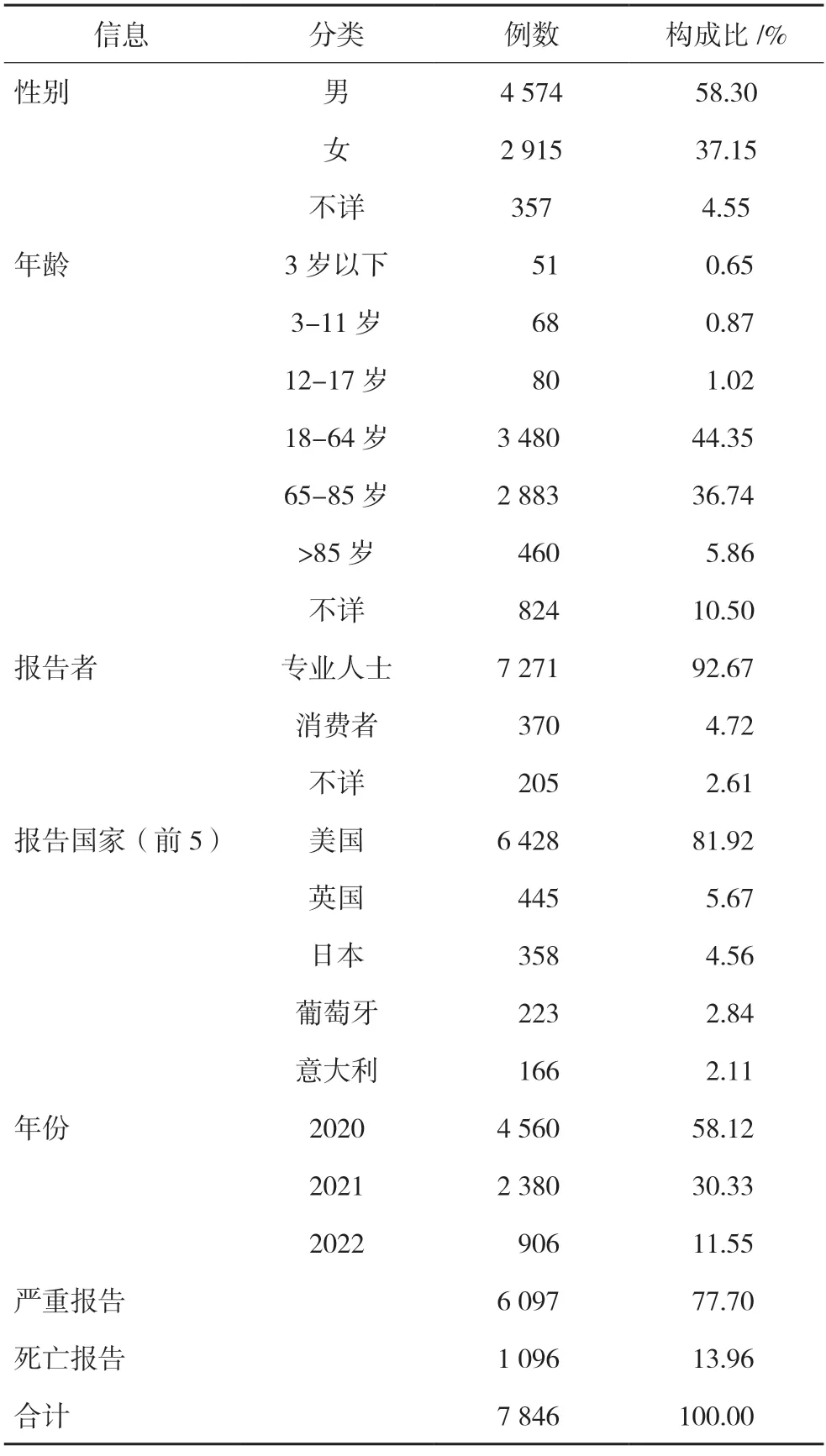
表1 不良事件報告基本信息
2.2 ADE 的例數統計及信號分析
按報告數量統計,7 846 份ADE 報告中,例數最多的依次為谷丙轉氨酶(ALT)和谷草轉氨酶(AST)的升高,分別有1 016 例、680 例;超適應證使用有662 例,死亡585 例,急性腎損傷532 例,心動過緩503 例等,詳細信息見表2。值得說明的是,該表顯示的是與使用瑞德西韋相關的不良事件,包括癥狀、體征、診療操作和結果等,與國內的“不良反應事件”有所區別,后者是指使用藥物后患者身體或精神出現的有害反應。
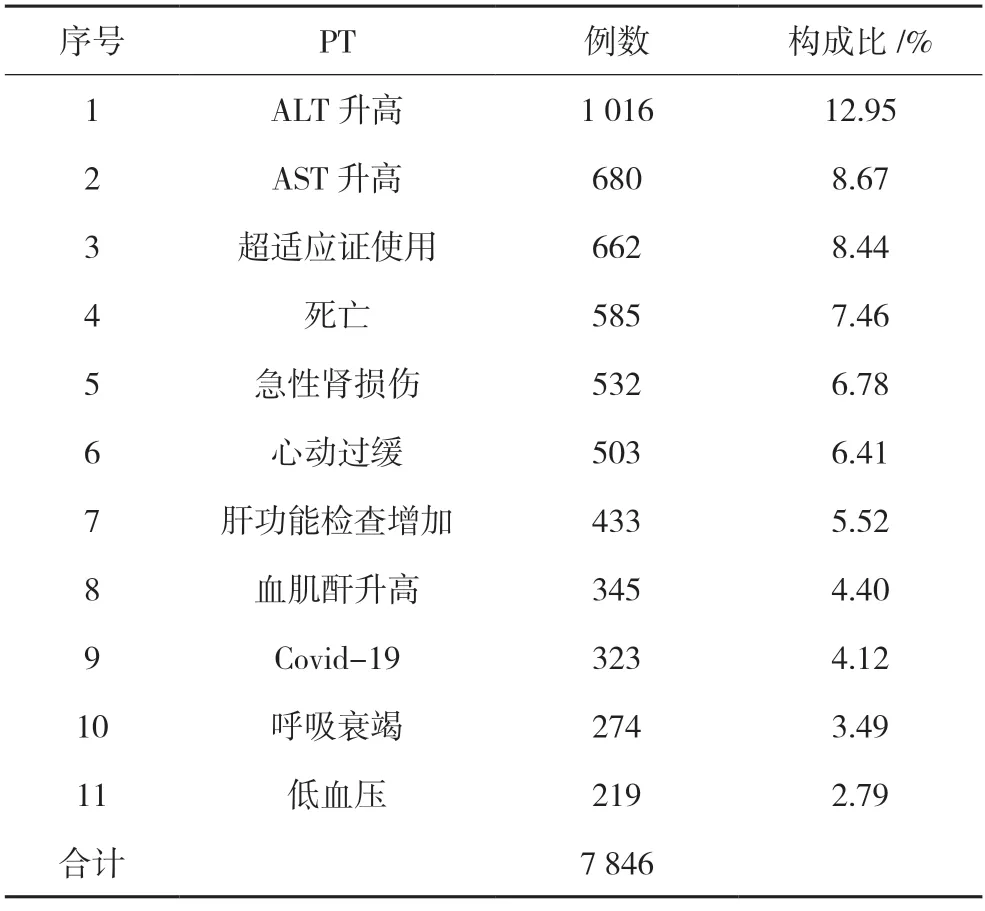
表2 不良反應事件報告的分類
對以瑞德西韋為PT 的不良反應信號進行篩除,最終獲得滿足ROR 法信號生成標準的250 個信號數,PT 報告總數為5 381 例。表3 列出了信號較強,且具有臨床意義的前15 位PT 對應的報告,總數為1 512 例。信號越強,表示ADE 的發生與PT 的使用相關性越高[6]。相關性由高到低依次為呼吸道霉菌病、ALT 升高、竇性心動過緩、AST 升高和心動過緩等。
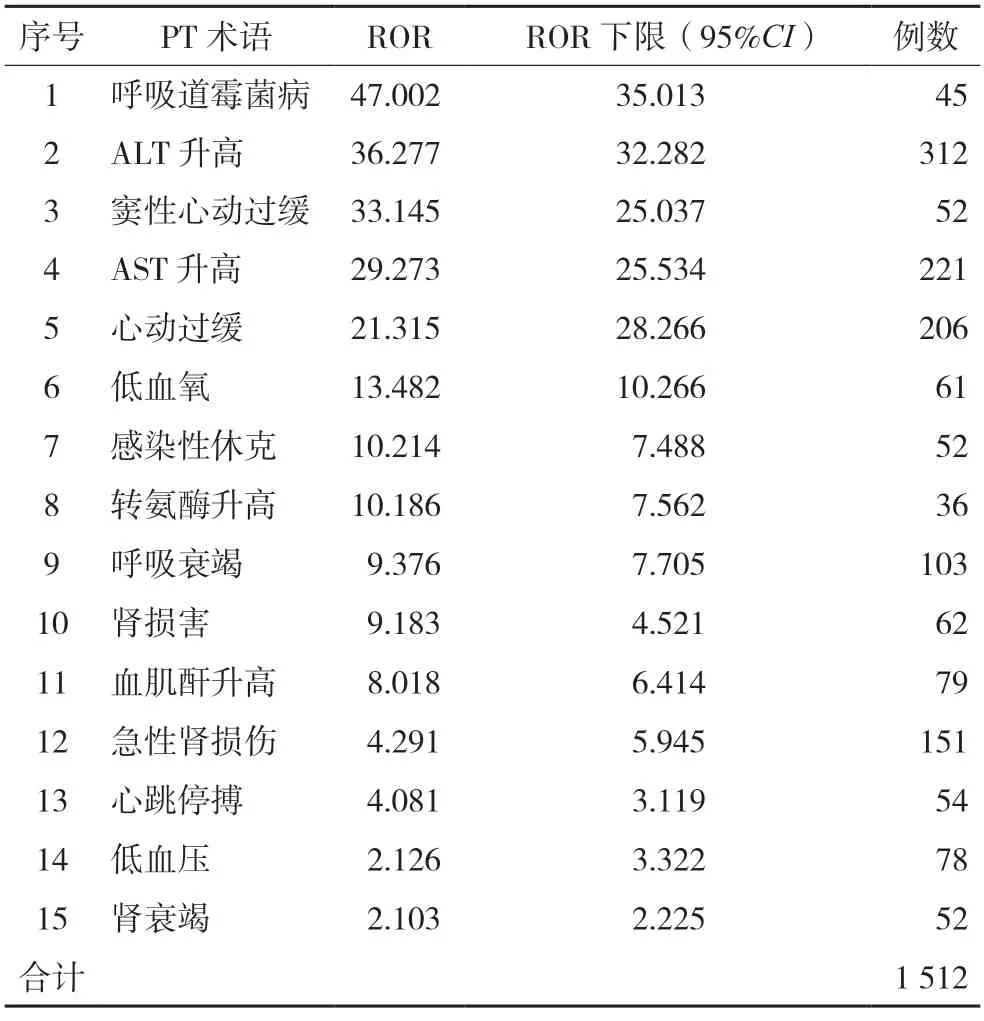
表3 信號強度排名靠前的不良反應報告(n=1 512)
2.3 系統器官分類不良反應報告及信號分類
對FAERS 數據庫的7 846 份報告進行SOC 分類排序,去除掉沒有臨床意義的SOC 項目,例如各類檢查、各種操作與治療,例數較高的ADE 主要累及的器官系統有:全身性疾病及注射部位各種反應925 例,各類損傷、中毒及手術并發癥有898 例,心臟器官疾病743 例,呼吸、胸及縱隔疾病662 例等。一共是5 208 例。詳細信息見表4。
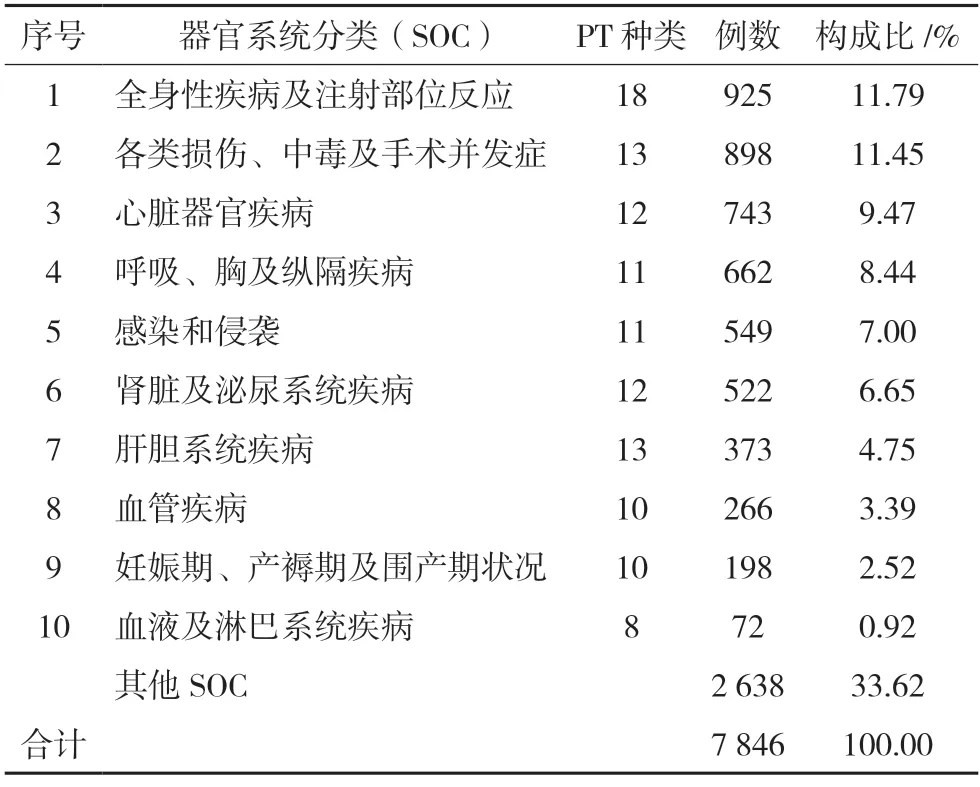
表4 SOC項下不良反應信號排名(n=7 846)
3 討論
3.1 基于FAERS 數據庫的數據挖掘特點
相較于臨床試驗研究,基于不良反應自發呈報系統數據庫的藥物安全性監測研究的優勢在于面向范圍廣,收集渠道開放,更易于發現發生率較低的不良反應;且數據庫的體量大,部分數據庫可以提供開源下載,方便學術研究。
3.2 不良反應發生的人群特點
使用瑞德西韋發生不良反應的男性多于女性,男性占比58.3%,女性37.15%。在年齡分布中,18~64 歲人群的不良反應發生率最大,占44.35%。其次是65-85 歲的老人,占36.74%。死亡病例報告1 906 份(24.29%),嚴重(包括死亡結果)不良事件6 097 份(77.7%)的比例相當之高,這可能歸結于兩個原因:第一,FDARS 是自發收集系統,獲知的瑞德西韋有關不良事件,不一定是以瑞德西韋首要懷疑藥物的事件,患者本身可能有各種基礎疾病,死亡是自身疾病進展的結果;第二,瑞德西韋的適用證是中到重度的Covid-19 患者,本身情況已經比較差,預后不樂觀。報告數量最多的國家是美國,其次是英國、日本,然后是葡萄牙、意大利、印度等。當前吉利德并沒有把中國納入到有條件免費許可的國家范圍,所以暫時未見到來自中國的自發報告。但在中國的隨機對照研究(RCT)中,瑞德西韋組也檢測到了與血液、循環、內分泌和其他系統相關的不良事件[7]。
3.3 超適應證使用的研究意義
從統計的數據得出,超適應證使用發生不良反應的報告數近三年達到662 例,與瑞德西韋使用關聯性較大的有537 例,其中12 歲以下的兒童不良反應發生例數為119 例,3 歲以下嬰幼兒為51 例。瑞德西韋的臨床使用適應證為12 歲以上的中重度患者,但在實際應用中,兒童患者使用該藥物非絕對禁忌,尤其是在沒有接種疫苗或者有先天免疫缺陷疾病的患兒中[8]。進一步挖掘兒童使用的不良反應信號,從系統分類、嚴重程度分類等研究,可以為今后更加準確地使用劑量和臨床大規模使用提供證據。其他超適應證的使用可能涉及其他病毒感染,隨著對瑞德西韋藥物機理的研究進一步深入,未來不排除說明書范圍的擴大或修訂。
3.4 不良反應事件發生的器官及系統特點
瑞德西韋常見的不良反應:肝臟損害包括肝酶升高;胃腸道癥狀包括惡心、嘔吐、腹瀉、食欲下降和胃輕癱;呼吸系統包括呼吸衰竭或急性呼吸抑制綜合征;心血管系統包括低血壓、房顫、高鈉血癥和心臟停搏;腎毒性包括腎損害、急性腎損傷和血尿。有報道指出埃博拉病毒感染的病人使用瑞德西韋治療,出現了一過性的血清淀粉酶升高[9],以及Covid-19 病人治療后出現肺、肝、胃腸道、心臟和腎臟等多器官損傷[10-12]。
本研究發現,轉氨酶升高的ADE 接近2 000 例,與已知臨床試驗的報道相符。腎小球濾過率下降、血肌酐升高、氮質血癥等也占了相當比例,這些信號都提示瑞德西韋在經過肝腎代謝時,容易對器官造成器質性損害,在治療原則中指出:臨床醫生會對患者先做肝功能水平評估,對于肝功能不好,尤其是肝酶水平大于正常值5 倍以上的患者慎重使用瑞德西韋[13]。在治療前和治療期間的所有患者應檢測腎小球濾過率(eGFR)、凝血酶原時間和肝臟生化等指標,以確定是否適合臨床治療[14]。這些提示臨床內科醫生為了達到更好的治療效果,要實時跟蹤、評估患者的肝腎功能,必要時對于臨床使用劑量也要進行相應的調整。
3.5 特殊人群中的安全性
妊娠期、產褥期及圍產期狀況SOC 有10 個信號合計198 例ADE 值得關注:包括妊娠期胎兒暴露54 例、妊娠期母體暴露41 例、早產兒28 例、早產22 例、低體重出生兒13 例等。主要集中在感染、呼吸和肝臟系統功能損害,還有新生兒整體狀況不良(營養不良、低體重等)的現象。動物生殖和發育毒性研究表明[8],瑞德西韋對雄性大鼠的生殖功能、胚胎-胎兒和產后發育沒有影響,但對雌性大鼠的生育參數有顯著影響。根據以往對埃博拉病毒的研究,瑞德西韋對人類懷孕是安全的[15],孕產婦感染Covid-19 的情況如果是比較危重的,可能會納入超適應證使用范圍。
3.6 研究局限
FAERS 是自發呈報系統,在此可以收集與瑞德西韋使用相關的不良反應,但無法獲得使用瑞德西韋的全部不良事件;報告數據可能存在重復、模糊、錯誤、不規范等問題,也不能排除假陽性的信號,同時還可能漏查部分信號。本研究的信號挖掘結果僅表示不良反應與瑞德西韋存在統計學上的關聯,為藥物的安全性提出論據,呈報的不良反應和藥品之間的關聯性還需要其他數據和資料的輔助分析來進一步論證。
4 結論
本研究對FAERS 數據庫瑞德西韋的不良反應事件報告進行了較為全面的分析,結果顯示瑞德西韋對多個系統有影響,對心臟和肝腎功能的損害尤其值得關注。嬰幼兒和孕產婦的使用也較為普遍。在臨床應用該藥物時,關注患者基礎狀況和潛在發生不良事件的可能性,制定更為精準的治療方案,以期獲得更大的風險-效益比。

