3.0T MRI結合不同b值的DWI對HIFU治療子宮肌瘤的療效評估
葛 煒 李鳳蓮 賈 銳
子宮肌瘤是常見的女性良性腫瘤,臨床上以手術治療為主,保留子宮、微創傷是治療的前提,其中強度聚焦超聲(high intensity focused ultrasound,HIFU)治療可保留子宮及生殖功能,且具有創傷小、術后恢復快等優點,已成為常規治療方案[1-2]。HIFU治療過程中,腫瘤鄰近組織的能量積累可能損傷子宮肌瘤周圍非靶區組織,從而影響治療效果[3]。臨床上常采用MRI增強掃描評估HIFU術后消融效果,但掃描時間較長,且容易引起對比劑相關腎損傷、過敏等不良反應,使得臨床運用受限[4]。磁共振擴散加權成像(diffusion weighted imaging,DWI)通過反映不同組織的彌散程度而有效區分病灶組織、病變類型,并通過表觀擴散系數(apparent diffusion coefficient,ADC)進行量化評估,已在宮頸癌、乳腺癌等癌癥的診斷、預后中得到應用[5]。研究發現ADC值會隨著b值的變化而變化,評估腫瘤治療效果的效能也會相應的變化,而目前關于不同b值的DWI成像差異仍不明確[6],因此本文將通過實例進一步探討不同b值的DWI在評估子宮肌瘤療效中的應用價值。
1 資料與方法
1.1 資料
選取2018年6月至2021年6月于我院接受治療的72例子宮肌瘤患者,均接受HIFU術,且于術前、術后1 d接受3.0 T MRI檢查。年齡23~38歲,平均年齡(30.25±2.14)歲,子宮肌瘤直徑2~8 cm,平均直徑(5.14±1.64)歲。
納入標準:①符合子宮肌瘤的診斷標準[7],影像學可清晰顯示肌瘤的部位、體積,感覺子宮內膜有突起或不平感,子宮不規則增大,且排除盆腔其他腫瘤;②要求保留子宮(有生育要求),非月經期,未絕經;③積極配合治療、復查,能交流HIFU過程中的感受。排除標準:①合并子宮肉瘤樣變、子宮肌腺癥、輸卵管疾病、宮頸惡性病變;②短期內子宮肌瘤迅速生長;③盆腔手術史,下腹部放療史;④合并盆腔炎、陰道嚴重出血等疾病者。
1.2 檢查過程
入組患者于HIFU治療前1 d以及HIFU治療(HIFUNIT 9000型聚焦超聲腫瘤消融機購自于上海愛申公司)后1 d采用3.0 T MR成像設備進行掃描(Philips Achieva)。檢查前禁食4 h,并適量飲水保證膀胱充盈,保持仰臥位,選取相控陣16通道線圈,從恥骨聯合掃描至髂動脈分叉處。TSE-T1WI軸位、矢狀位TR/TE為530/10 ms、層間距為1 mm、層厚為5 mm、矩陣320×250以及250×200。TSE-T2WI軸位TR/TE為3000/80 ms、層間距為1 mm、層厚為4 mm、矩陣320×250。T2WI矢狀位TR/TE為3600/70 ms、層間距為1 mm、層厚為4 mm、矩陣80×80。b值為150 s/mm2、500 s/mm2以及1000 s/mm2。
1.3 檢查指標
應用Philips Extend MR WorkSpace 2.6.3.4軟件分析子宮周圍組織(腹壁、恥骨聯合、骶)MRI信號值的變化,其中HIFU術后出現異常信號則表明該處為損傷區,根據損傷情況分為無損傷組、損傷組。術后肌瘤仍有強化區域則判定為殘留未消融灶。比較不同b值DWI成像下消融及未消融區域的ADC值差異,并評估各b值DWI成像下ADC值對于消融情況的診斷效能。
1.4 統計學方法
應用SPSS 20.0軟件處理數據。數據服從正態分布且組間方差齊,兩組間計量資料比較采用獨立樣本t檢驗,治療前后計量資料比較采用配對t檢驗,三組間比較F檢驗。采用受試者工作特征(ROC)曲線評價各b值DWI成像下的ADC值對消融、未消融區域的診斷效能,并采用Hanley-McNeil方法比較ROC曲線下面積(AUC)。
2 結果
2.1 不同組織不同分組HIFU術前、術后的定量信號值比較
無損傷組不同組織術前、術后的定量信號值差異無統計學意義 (P>0.05),而損傷組信號值差異有統計學意義 (P<0.05),其中骶骨術后信號明顯低于術前,恥骨聯合、腹壁術后信號明顯高于術前,見表1。
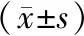
表1 MRI T2WI壓脂序列的各組織定量信號值比較
2.2 各b值DWI成像下鄰近組織損傷區HIFU術后ADC值比較
不同b值DWI成像下子宮鄰近組織損傷區HIFU術后ADC值差異有統計學意義,隨著b值的增加ADC值明顯降低(P<0.05),見表2。

表2 不同b值DWI成像下鄰近組織損傷區HIFU術后的ADC值比較
2.3 各b值DWI成像下未消融和消融部位的ADC值比較
各b值下,消融處的ADC值均明顯低于術前肌瘤、未消融處的ADC值,且術前肌瘤、未消融處的ADC值無差異 (P>0.05)。三組b值之間的術前肌瘤、未消融處以及消融處的ADC值有差異 (P<0.05),且隨著b值的增加,術前肌瘤、未消融處以及消融處的ADC值均明顯降低,見表3。
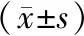
表3 不同b值DWI成像下消融和未消融部位的ADC值比較
2.4 不同 b值DWI成像下ADC值的診斷效能
b=150、 500、1000 s/mm2時,診斷消融部位的AUC分別為0.883(95%CI 0.846~0.927)、0.836(95%CI 0.796~0.877)、0.788(95%CI 0.738~0.826)。b=150 s/mm2時的AUC值明顯高于500 s/mm2、1000 s/mm2(Z=2.005、2.541,P=0.045、0.011),見表4、圖1。

圖1 ROC曲線分析

表4 不同b值DWI成像下ADC值的診斷效能
3 討論
子宮肌瘤的主要體征是子宮平滑肌增生,可引起經期延長、經血量增加、繼發盆腔疼痛等病癥,最終改變子宮解剖結構,以及引起子宮異常出血[8-9]。HIFU在超聲引導下精準地將消融天線置入病灶,并借助消融天線產生的微波而在周圍瘤體引發偶極子加熱、離子加熱等熱效應,導致腫瘤組織、細胞在極短時間內發生不可逆組織變性、凝固性壞死等,同時破壞瘤體血供,發揮良好的治療效果[10]。子宮肌瘤組織邊界模糊不清,輻射容易照到子宮肌瘤鄰近組織,或者在非目標組織中高能沉積,從而損傷子宮鄰近組織。王智等[11]研究發現高強度聚焦超聲治療子宮肌瘤時,輻射會照射到卵巢而影響卵巢功能,Clark等[12]報道術區及其附近組織(恥骨聯合、骶骨)發生疼痛,腹壁皮膚出現熱損傷反應,且癥狀以一過性為主。
在不同的軟組織界面,聲通道上波反射系數較小,絕大部分聲波能量可通過該界面,而恥骨聯合、骶骨與腹壁組織結構差別較大,吸聲系數存在較大的反差,容易形成骨性高聲波阻抗界面,導致聲能沉積,增加了組織損傷風險,引起恥骨聯合、骶尾部的疼痛[13]。同時恥骨聯合、骶尾距離子宮肌瘤距離較短,往往處于聲場內,特別是子宮肌瘤病灶直徑較大或者需要輸入較多的聲波能量時,則會進一步增加非靶區組織聲波能量累積,引起鄰近組織損傷。本次研究發現,恥骨損傷區HIFU術后ADC值較術前均明顯增加,表明可通過3.0T MRI結合DWI成像準確反映損傷部位、類型。分析認為,病灶內微血管被破壞,并存在一定程度的出血癥狀,且損傷區組織壞死、細胞膜破壞等束縛細胞內水分子運動的功能喪失,使得細胞內液流出,細胞之間與血管間的間隙增大,水分子彌散增加,故而ADC值增加。另外,黃君文等[14]研究認為,放療后癌細胞大量調亡、壞死,細胞膜完整性消失,細胞外間隙增加,以及細胞密度降低,可通過對比放療前后ADC值的變化檢測腫瘤治療效效果。同時,可根據患者腫瘤分期、腫瘤大小優化治療功率,也有學者認為術前于子宮肌瘤內注入碘海醇、無水乙醇可增加靶區能量沉積,提高治療效率[15],或者術中涂抹皮膚超聲耦合劑、術后局部冷敷等可減少輻射灼傷腹壁,降低并發癥風險。
子宮肌瘤經過HIFU術后,消融部位微循環灌注、水分子擴散效應的變化是導致ADC值變化的重要原因,因此通過ADC值評估治療效果已成為臨床研究的熱點話題。b值是DWI成像過程的一個彌散權重指數,隨著b值增加,DWI彌散敏感度增加,但選擇高b值時,圖像質量、圖像的信噪比也明顯降低,從而影響醫師診斷準確度和療效評估[16],因此選擇合適的b值對于療效的評估至關重要。本次研究發現,消融處的ADC值明顯低于未消融處的ADC值,與Rheinheimer等[17]報道一致,即HIFU熱能效應破壞了子宮肌瘤病灶處豐富的血管系統,導致消融處快速流動的血液水分子數量明顯減少,從而使得ADC值較未消融處明顯降低。隨著b值的增加,術前肌瘤、未消融處以及消融處的ADC值均明顯降低,分析認為隨著b值的增加,組織信號根據非單指數衰減的形式進行衰減,能夠間接反映子宮肌瘤組織毛細血管微循環灌注量明顯下降,有效評估子宮肌瘤消融與否[18-19]。相同的TE時間內,血流灌注效應中的水分子運動距離遠長于單純水分子,故而成像體素內血流灌注效應對MRI信號的衰減作用明顯強于單純的彌散運動,在低b值時,血流灌注效應對DWI信號的衰減作用較大,相應的ADC值可有效反映組織的彌散信息以及灌注信息。同時,通過ROC曲線分析發現b=150 s/mm2時的AUC值明顯高于500、1000 s/mm2,進一步表明小b值更佳有利于HIFU術后消融療效的評估。另外,張俊成等[20]認為小b值的ADC圖可清晰顯示患者靶區、殘留未消融灶的界限,從而利于判斷消融灶的輪廓并計算消融體積,提高了子宮肌瘤患者HIFU術后的療效評估價值。本研究納入病例數較少可能影響結果準確性,同時隨訪時間較短,未能評估ADC值與最終預后的相互關系,所以需加大樣本量進一步研究。
綜上所述,3.0T MRI結合不同b值的DWI可有效評估HIFU術對子宮肌瘤的消融效果以及對周圍鄰近組織的影響,其中較低的b值(b=150 s/mm2)具有更高的應用價值。

