羽扇豆醇調控miR-100-5p對非小細胞肺癌NCI-H1299細胞生物學行為的影響
黃昱剛,譚伶娟,陳廣
非小細胞肺癌(NSCLC)是最常見的肺癌類型,多數患者在初診時已發生轉移,目前針對NSCLC的化療藥物多存在不良反應和多藥耐藥。羽扇豆醇是存在于多種蔬菜、水果、藥用植物中的五環三萜,具有抗氧化、抗腫瘤、抗炎等藥理活性[1]。羽扇豆醇對骨肉瘤[2]、乳腺癌[3]、肝癌[4]的影響已被證實。近期研究顯示,羽扇豆醇具有抗肺癌轉移的作用[5],還可抑制NSCLC細胞增殖,改變細胞形態,誘導細胞凋亡[6]。然而,羽扇豆醇對NSCLC轉移的影響及其機制鮮有報道。微小RNA(miRNA)是短鏈非編碼RNA,其可與靶mRNA結合參與腫瘤細胞的惡性進展過程。在不同類型的癌癥中均可以觀察到異常表達的miRNAs,這些miRNAs在促進或抑制惡性腫瘤的進展中起著至關重要的作用[7-8]。已發現多種miRNA表達失調參與NSCLC進展[9-10]。NSCLC組織中miR-100-5p表達降低,其可通過靶向成纖維細胞生長因子受體3(FGFR3)抑制NSCLC細胞遷移、侵襲和糖酵解[11]。既往研究顯示,藥物可通過調控miRNA影響NSCLC細胞發生發展[12],可見miRNA可作為藥物作用的靶點。而miR-100-5p是NSCLC細胞的潛在靶點,由此推測miR-100-5p也可能是羽扇豆醇影響NSCLC細胞惡性進展的作用靶點。本研究旨在探討羽扇豆醇對NSCLC細胞增殖、遷移和侵襲的影響,并以miR-100-5p為切入點探討其在NSCLC進展中的調控機制。
1 材料與方法
1.1 材料 miR-100-5p模擬物(miR-100-5p mimic,5′-AACCCGUAGAUCCGAACUUGUG-3′)及 其 陰 性 對 照miRNC(5′-UUUGUACUACACAAAAGUACUG-3′)、miR-100-5p抑 制 物(anti-miR-100-5p,5′-CACAAGUUCGGAUCUAC?GGGUU-3′)及其陰性對照anti-miR-NC(5′-CAGUACUUUU?GUGUAGUACAA-3′)購自廣州銳博生物公司。人NSCLC細胞NCI-H1299、胎牛血清(FBS)、青/鏈霉素混合液(P/S)、RPMI-1640培養液(武漢普諾賽生物公司);Lipofectamine 2000購自Invitrogen;羽扇豆醇(貨號B21602,純度大于98%,上海源葉生物公司);CCK-8試劑盒、ECL發光液、RIPA緩沖液(北京索萊寶生物公司);miRNA cDNA合成試劑盒、SYBR Premix Ex Taq、TRIzol試劑(大連Takara公司);兔單克隆抗體細胞周期蛋白D1(CyclinD1,貨號bs-20596R)、MMP2(貨號bs-0412R)和MMP9(貨號bs-4593R)、β-actin(貨號bs-0061R)及辣根過氧化物酶標記羊抗兔IgG二抗(貨號bs-0295P-HRP)購自北京博奧森生物公司。Transwell小室(貨號3450)購自科站生物科技有限公司;實時熒光定量PCR儀MA-6000購自山東高芯生物傳感器研究院有限公司。
1.2 方法
1.2.1 細胞培養和分組 NCI-H1299細胞接種于含10%FBS、1%P/S的RPMI-1640培養基,置于37℃,含95%空氣、5%CO2培養箱孵育。細胞80%融合時,加入胰蛋白酶消化,1∶4傳代。每周換液2~3次。將對數生長期NCI-H1299細胞以2×104個/孔接種于24孔板中,用含0、12.5、25、50μmol/L羽扇豆醇[4]的培養液孵育NCI-H1299細胞48 h,分別記為正常對照(NC)組、低劑量組、中劑量組、高劑量組。使用Lipofectamine 2000將miR-NC、miR-100-5p mimic轉染細胞,記為miR-NC組、miR-100-5p組;細胞轉染anti-miR-NC、anti-miR-100-5p后用含50μmol/L羽扇豆醇培養,記為anti-miR-NC+高劑量組、anti-miR-100-5p+高劑量組。每組3個復孔。
1.2.2 CCK-8法檢測細胞活力 將各組細胞以5×103個/孔接種于96孔板中,按照實驗分組分別給予對應濃度的羽扇豆醇處理48 h。更換為100μL新鮮培養液,加入10μL CCK-8試劑,繼續孵育2 h。酶標儀檢測450 nm處光密度(OD)值。
1.2.3 克隆形成實驗檢測細胞增殖能力 胰酶消化各組NCI-H1299,按照5×102個/孔接種于6孔板中,輕旋平板使細胞均勻分散,于37℃培養箱孵育,直至出現細胞集落。棄去培養液,PBS沖洗2次,4%多聚甲醛固定后,用1%結晶紫染色。顯微鏡下拍照計數大于50個細胞的集落數。
1.2.4 Transwell實驗檢測細胞遷移和侵襲 胰酶消化各組NCI-H1299細胞,用無血清培養基調整為1×106個/mL單細胞懸液。向Transwell上室、24孔板下室分別加入100μL細胞懸液、500μL含血清培養基。于37℃孵育24 h后,用濕棉簽去除Transwell上室殘留細胞,用4%多聚甲醛固定穿膜細胞,1%結晶紫染色。顯微鏡下隨機讀取3個視野計數,取其均值作為細胞遷移數。侵襲測定時采用包被基質膠的小室,其余步驟和遷移測定一致。
1.2.5 qPCR檢測miR-100-5p表達 采用TRIzol試劑從NCI-H1299細胞中分離總RNA。用miRNA cDNA合成試劑盒進行逆轉錄,再以其產物為模板用SYBR Premix Ex Taq進行熒光定量PCR(qPCR)。miR-100-5p和U6的引物序列由廣州銳博生物公司合成。miR-100-5p引物序列:上游5′-GAACCCGTAGATCCGAACT-3′,下 游5′-CAGTGCGTGTC?GTGGAGT-3′,產物大小168 bp;U6引物序列:上游5′-CTC?GCTTCGGCAGCACA-3′,下游5′-AACGCTTCACGAATTTGC?GT-3′,產物大小185 bp。擴增條件為95℃10 min;95℃10 s,60℃30 s,40次循環。miR-100-5p表達值以U6為內參基因,用2-ΔΔCt法進行相對定量分析。
1.2.6 Western blot檢測CyclinD1、MMP2和MMP9蛋白的表達 RIPA緩沖液裂解各組NCI-H1299細胞,收集蛋白-80℃暫時保存。蛋白定量后,等量的蛋白通過SDS-PAGE分離,并轉移到PVDF膜上。在25℃下5%脫脂奶粉封閉1 h;在4℃下用CyclinD1、MMP2、MMP9和β-actin一抗(均1∶2 000稀釋)孵育過夜;第2天,在25℃下用二抗孵育1 h。將ECL發光液滴加至膜正面,暗室顯色5 min。顯影、定影。用Image J軟件定量蛋白表達。
1.3 統計學方法 采用SPSS 21.0軟件進行數據分析,計量數據以表示,2組間比較用獨立樣本t檢驗,多組間比較用單因素方差分析,組間多重比較用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 羽扇豆醇對NCI-H1299細胞活力、增殖及CyclinD1蛋白表達的影響 與NC組比較,低、中、高劑量組NCI-H1299細胞CyclinD1蛋白表達、細胞活力、細胞克隆數逐漸降低,差異有統計學意義(均P<0.05),見圖1、2,表1。
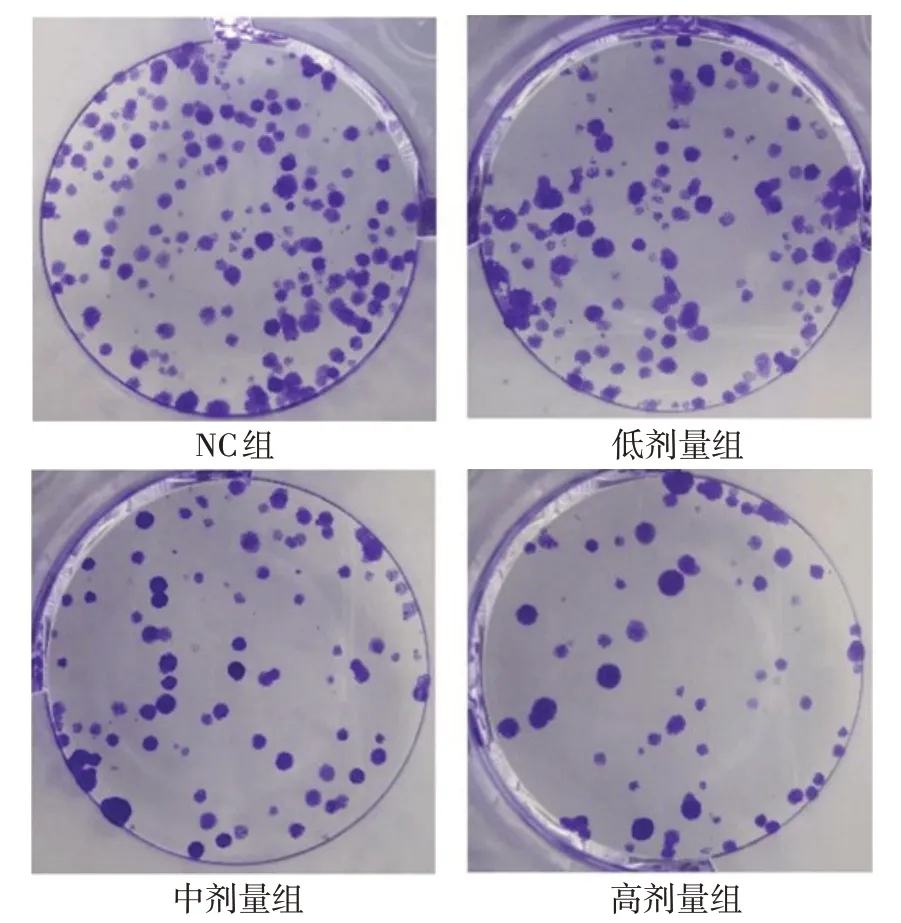
Fig.1 Effects of lupeol on NCI-H1299 cell clone圖1 羽扇豆醇對NCI-H1299細胞克隆的影響

Fig.2 The expression of CyclinD1 protein detected by Western blot assay圖2 Western blot檢測CyclinD1蛋白的表達
2.2 羽扇豆醇對NCI-H1299遷移和侵襲及MMP2、MMP9蛋白表達的影響 與NC組比較,低、中、高劑量組NCI-H1299細胞遷移數、侵襲數、MMP2和MMP9蛋白表達逐漸降低,差異均有統計學意義(P<0.05),見圖3、4,表2。
Tab.1 Comparison of proliferation and expression level of CyclinD1 protein in NCI-H1299 cells between four groups表1 各組NCI-H1299細胞增殖和CyclinD1蛋白表達水平比較 (n=9)
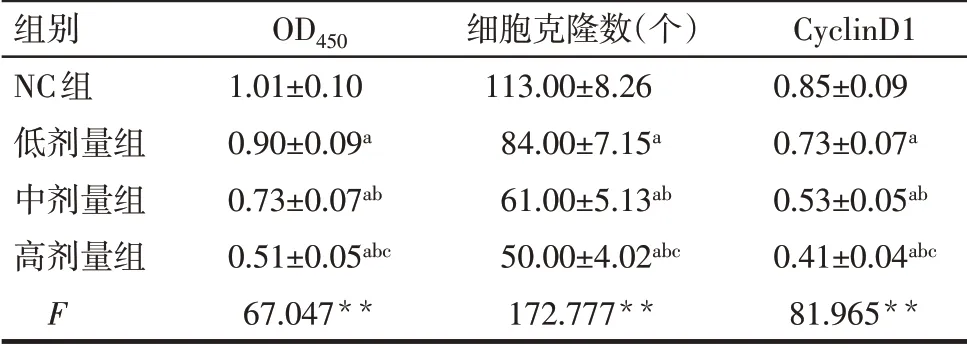
Tab.1 Comparison of proliferation and expression level of CyclinD1 protein in NCI-H1299 cells between four groups表1 各組NCI-H1299細胞增殖和CyclinD1蛋白表達水平比較 (n=9)
**P<0.01;a與NC組比較,b與低劑量組比較,c與中劑量組比較,P<0.05。
組別NC組低劑量組中劑量組高劑量組F OD450 1.01±0.10 0.90±0.09a 0.73±0.07ab 0.51±0.05abc 67.047**細胞克隆數(個)113.00±8.26 84.00±7.15a 61.00±5.13ab 50.00±4.02abc 172.777**CyclinD1 0.85±0.09 0.73±0.07a 0.53±0.05ab 0.41±0.04abc 81.965**

Fig.4 Expressions of MMP2 and MMP9 proteins detected by Western blot assay圖4 Western blot檢測MMP2和MMP9蛋白的表達
Tab.2 Comparison of migration and invasion of NCIH1299 cells and the expression levels of MMP2 and MMP9 proteins between four groups表2各組NCI-H1299細胞遷移、侵襲及MMP2、MMP9蛋白表達水平比較 (n=9,)

Tab.2 Comparison of migration and invasion of NCIH1299 cells and the expression levels of MMP2 and MMP9 proteins between four groups表2各組NCI-H1299細胞遷移、侵襲及MMP2、MMP9蛋白表達水平比較 (n=9,)
**P<0.01;a與NC組比較,b與低劑量組比較,c與中劑量組比較,P<0.05。
組別NC組低劑量組中劑量組高劑量組F細胞遷移數(個)154.00±12.25 127.00±10.13a 100.00±9.24ab 62.00±5.16abc 152.245**細胞侵襲數(個)136.00±13.32 101.00±10.03a 88.00±8.02ab 51.00±4.01abc 123.809**MMP2 0.83±0.08 0.70±0.07a 0.57±0.05ab 0.42±0.04abc 72.156**MMP9 0.75±0.06 0.62±0.06a 0.48±0.04ab 0.37±0.03abc 101.567**
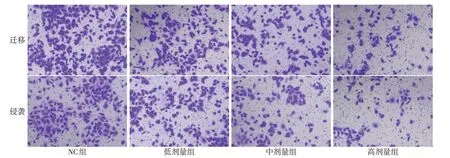
Fig.3 Effects of lupeol on migration and invasion of NCI-H1299 cells detected by Transwell assay圖3 Transwell檢測羽扇豆醇對NCI-H1299細胞遷移、侵襲的影響
2.3 羽扇豆醇對miR-100-5p基因表達的影響 與NC組(1.00±0.09)比較,低(1.36±0.11)、中(1.83±0.15)、高(2.31±0.21)劑量組NCI-H1299細胞miR-100-5p表達水平逐漸升高,差異均有統計學意義(F=134.392,P<0.05)。
2.4 過表達miR-100-5p對NCI-H1299細胞增殖、遷移和侵襲及CyclinD1、MMP2、MMP9蛋白表達的影響 與miR-NC組比較,miR-100-5p組NCI-H1299細胞中miR-100-5p表達水平增加,細胞活力降低,細胞克隆數、遷移數、侵襲數減少,CyclinD1、MMP2、MMP9蛋白表達降低(P<0.05),見圖5~7,表3。
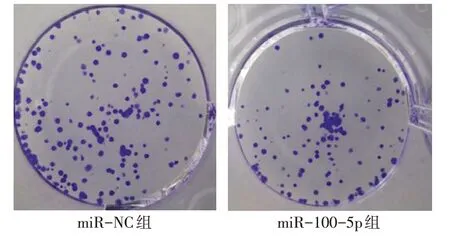
Fig.5 Effects of miR-100-5p on NCI-H1299 cell clone圖5 miR-100-5p對NCI-H1299細胞克隆的影響
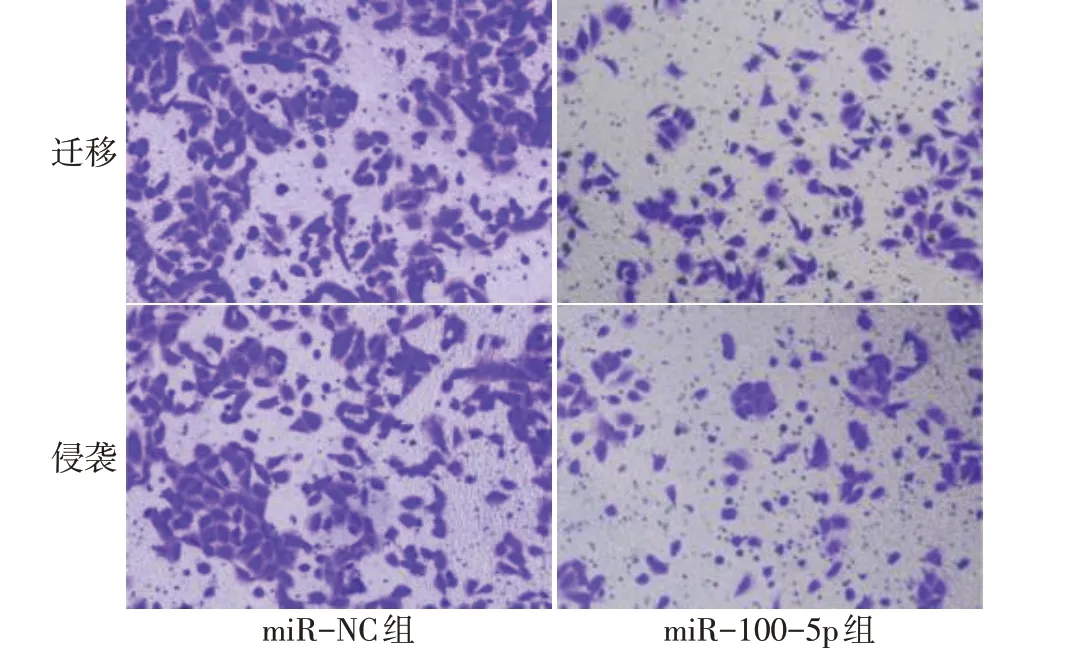
Fig.6 Effects of miR-100-5p on migration and invasion of NCIH1299 cells detected by Transwell assay圖6 Transwell檢測miR-100-5p對NCI-H1299細胞遷移、侵襲的影響
2.5 抑制miR-100-5p表達可逆轉羽扇豆醇對NCIH1299細胞增殖、遷移和侵襲及CyclinD1、MMP2、MMP9蛋白表達的影響 與anti-miR-NC+高劑量組比較,anti-miR-100-5p+高劑量組NCI-H1299細胞miR-100-5p表達水平降低,細胞活力升高,細胞克隆數、遷移數、侵襲數增多,CyclinD1、MMP2、MMP9蛋白表達增加(P<0.05),見圖8~10,表4。
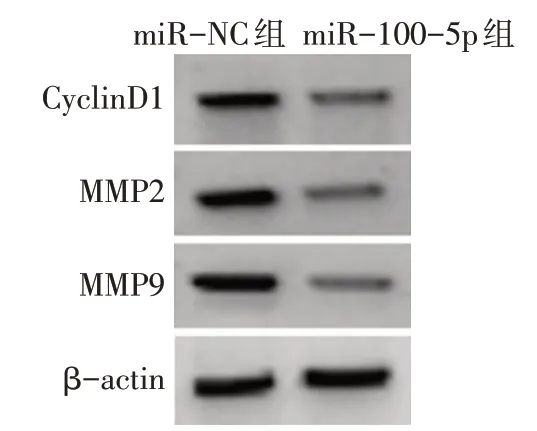
Fig.7 Expression of CyclinD1,MMP2 and MMP9 proteins detected by Western blot assay圖7 Western blot檢測CyclinD1、MMP2和MMP9蛋白的表達
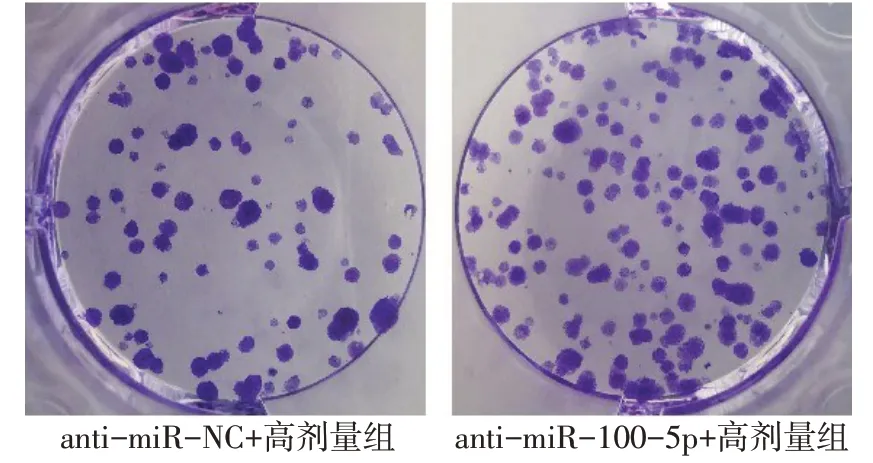
Fig.8 Inhibition of miR-100-5p expression reversed the effect of lupeol on NCI-H1299 cell clone圖8 抑制miR-100-5p表達可逆轉羽扇豆醇對NCI-H1299細胞克隆的影響
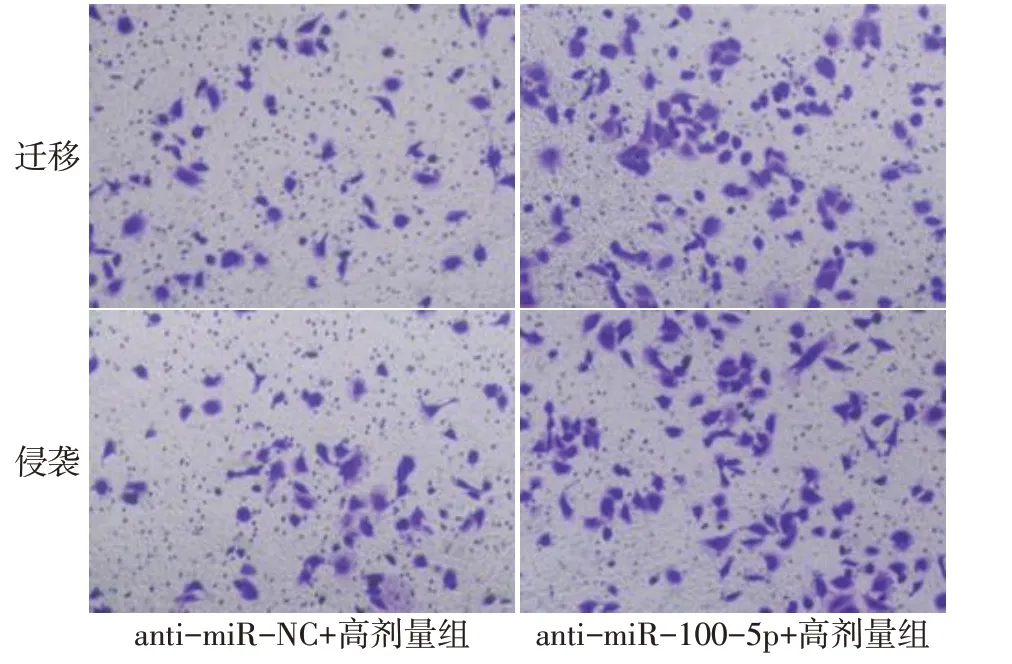
Fig.9 Effects of inhibition of miR-100-5p expression on migration and invasion of NCI-H1299 cells after lupeol intervention detected by Transwell圖9 Transwell檢測抑制miR-100-5p表達對羽扇豆醇干預后NCI-H1299細胞遷移、侵襲的影響
Tab.3 Comparison of proliferation,migration,invasion and the expression levels of CyclinD1,MMP2 and MMP9 proteins in NCI-H1299 cells between two groups after overexpression of miR-100-5p表3 過表達miR-100-5p后2組NCI-H1299細胞增殖、遷移和侵襲及CyclinD1、MMP2、MMP9蛋白表達水平比較(n=9,)
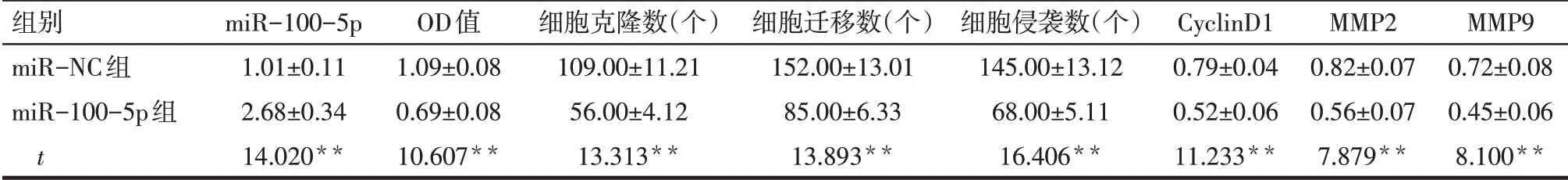
Tab.3 Comparison of proliferation,migration,invasion and the expression levels of CyclinD1,MMP2 and MMP9 proteins in NCI-H1299 cells between two groups after overexpression of miR-100-5p表3 過表達miR-100-5p后2組NCI-H1299細胞增殖、遷移和侵襲及CyclinD1、MMP2、MMP9蛋白表達水平比較(n=9,)
**P<0.01。
組別miR-NC組miR-100-5p組t miR-100-5p 1.01±0.11 2.68±0.34 14.020**OD值1.09±0.08 0.69±0.08 10.607**細胞克隆數(個)109.00±11.21 56.00±4.12 13.313**細胞遷移數(個)152.00±13.01 85.00±6.33 13.893**細胞侵襲數(個)145.00±13.12 68.00±5.11 16.406**CyclinD1 0.79±0.04 0.52±0.06 11.233**MMP2 0.82±0.07 0.56±0.07 7.879**MMP9 0.72±0.08 0.45±0.06 8.100**
Tab.4 Comparison of proliferation,migration and invasion of NCI-H1299 cells and the expression levels of CyclinD1,MMP2,MMP9 proteins between two groups after inhibition of miR-100-5p表4 抑制miR-100-5p表達后2組NCI-H1299細胞增殖、遷移和侵襲及CyclinD1、MMP2、MMP9蛋白表達水平比較(n=9,)
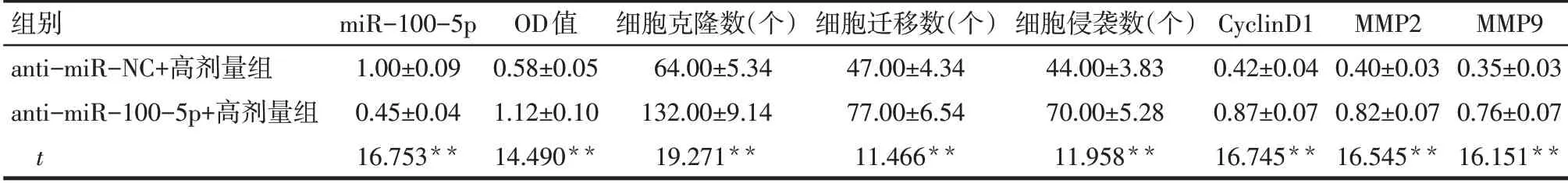
Tab.4 Comparison of proliferation,migration and invasion of NCI-H1299 cells and the expression levels of CyclinD1,MMP2,MMP9 proteins between two groups after inhibition of miR-100-5p表4 抑制miR-100-5p表達后2組NCI-H1299細胞增殖、遷移和侵襲及CyclinD1、MMP2、MMP9蛋白表達水平比較(n=9,)
**P<0.01。
組別anti-miR-NC+高劑量組anti-miR-100-5p+高劑量組t miR-100-5p 1.00±0.09 0.45±0.04 16.753**OD值0.58±0.05 1.12±0.10 14.490**細胞克隆數(個)64.00±5.34 132.00±9.14 19.271**細胞遷移數(個)47.00±4.34 77.00±6.54 11.466**細胞侵襲數(個)44.00±3.83 70.00±5.28 11.958**CyclinD1 0.42±0.04 0.87±0.07 16.745**MMP2 0.40±0.03 0.82±0.07 16.545**MMP9 0.35±0.03 0.76±0.07 16.151**
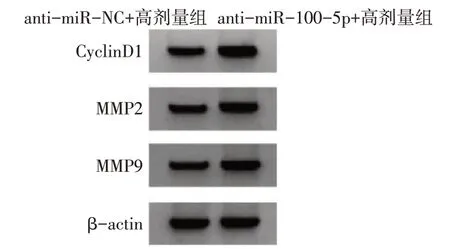
Fig.10 Expression of CyclinD1,MMP2 and MMP9 proteins detected by Western blot Assay圖10 Western blot檢測CyclinD1、MMP2和MMP9蛋白的表達
3 討論
植物來源化合物可通過誘導腫瘤細胞凋亡、阻滯細胞周期、抑制細胞增殖等途徑發揮抗腫瘤活性,是潛在的抗腫瘤藥物。研究證實羽扇豆醇通過誘導S期周期阻滯和細胞凋亡來抑制宮頸癌細胞生長[13]。羽扇豆醇還可增強沉默ST3GalⅢ對乳腺癌細胞侵襲轉移的抑制作用[14]。本研究表明,羽扇豆醇以劑量依賴方式降低NCI-H1299細胞活力,抑制其克隆形成,這表明羽扇豆醇可抑制NSCLC細胞增殖。CyclinD1與細胞增殖相關,其通過激活G1期特有的細胞周期蛋白依賴性激酶4(CDK4),推動細胞由G1期進入S期,進而促進增殖。本研究發現羽扇豆醇干預后NCI-H1299細胞中的CyclinD1蛋白水平明顯下調,與CCK-8和克隆形成實驗的結果一致,說明羽扇豆醇可能通過抑制CyclinD1表達阻滯細胞周期進展從而抑制增殖。MMP2和MMP9是MMP家族中被廣泛研究的成員,其在肺癌的侵襲和轉移中起主導作用[15]。MMP2和MMP9上調,細胞遷移和侵襲能力增強。羽扇豆醇以劑量依賴方式下調NCI-H1299細胞中MMP2、MMP9表達水平,影響細胞外基質降解,進而抑制NCI-H1299細胞遷移和侵襲能力。
miRNA作為生物標志物和治療靶點在癌癥研究中引起了廣泛關注,其通過調節CyclinD1、MMP2和MMP9表達影響腫瘤增殖和遷移、侵襲[16-17]。另有研究表明miRNA還可能是植物來源化合物抗腫瘤的潛在靶標[18]。Zhong等[2]發現羽扇豆醇通過上調miR-212-3p的表達來抑制骨肉瘤細胞活力和侵襲。張小鷹等[19]證實羽扇豆醇可增強miR-145-5p對前列腺癌細胞的抗增殖和促凋亡作用。以上研究證實miRNA可作為羽扇豆醇抗腫瘤進展的靶點。miR-100-5p的抑瘤功能已有多項研究報道,miR-100-5p在脊索瘤組織中表達下調,過表達miR-100-5p在體內外均能抑制脊索瘤的生長,并通過抑制上皮-間充質轉化進而抑制脊索瘤細胞的遷移和侵襲[20];miR-100-5p可下調mTOR基因表達進而抑制前列腺癌細胞的增殖、遷移及侵襲能力[21]。本研究顯示,隨著羽扇豆醇濃度的增加,NCI-H1299細胞miR-100-5p表達水平顯著上調,提示miR-100-5p表達升高可能介導羽扇豆醇的抗癌作用。過表達miR-100-5p抑制NSCLC細胞增殖、遷移和侵襲,并降低CyclinD1、MMP2、MMP9蛋白表達,說明miR-100-5p通過下調相關蛋白表達抑制細胞的增殖和轉移。本研究發現,在羽扇豆醇處理的基礎上抑制miR-100-5p表達,細胞增殖、遷移及侵襲能力增強,CyclinD1、MMP2、MMP9蛋白上調,提示抑制miR-100-5p表達可部分減弱羽扇豆醇對NCI-H1299細胞的抑制作用,進一步表明羽扇豆醇通過上調miR-100-5p表達抑制NSCLC細胞惡性生物學行為。
綜上所述,羽扇豆醇具有抑制NSCLC細胞增殖、遷移和侵襲活力,其機制可能是通過上調miR-100-5p實現的。本研究初步揭示了羽扇豆醇的抗NSCLC機制,為羽扇豆醇用于防治NSCLC提供了依據。由于本研究僅為細胞水平研究,未進行動物模型實驗,故有待后續通過體內實驗驗證本研究結果,為羽扇豆醇用于臨床治療NSCLC奠定基礎。

