雙能量CT成像聯合DCE-MRI在結腸癌術前評估中的應用
劉瑞華 宗志恩
(ThePracticalJournalofCancer,2023,38:0122~0125)
目前臨床治療結腸癌主要以手術為主,術后輔助放化療為輔,但術前精準評估腫瘤分期是手術方案制定及預后評估的重要前提[1]。結腸鏡及活檢是結腸癌術前評估的金標準,但結腸鏡檢查僅可觀察病灶大小、形態情況,對病灶是否發生浸潤及周圍侵犯等情況無法進行有效評估,在術前病理分期鑒別中存在一定不足[2]。雙能量CT是一種通過兩套探測系統及兩套X射線球管系統同時采集圖像的一種CT裝置,可提高軟組織對比度,分離不同能量的信息,提高成像質量,常用于小病灶及難以定性組織的定性分析評估中[3-4]。磁共振對軟組織具有較高分辨率,可清晰將腫瘤與鄰近組織關系通過影像學呈現,而動態增強磁共振成像(dynamic contrast enhancement magnetic resonance imaging,DCE-MRI)可通過對比劑進出腫瘤的血流動力學情況及腫瘤形態學的變化,對腫瘤分期進行評估[5]。鑒于此,本研究將雙能量CT成像與DCE-MRI聯合應用于結腸癌患者術前評估中,分析其在結腸癌術前腫瘤分期中的評估價值。現報告如下。
1 資料與方法
1.1 一般資料
收集2019年1月至2021年8月期間醫院收治的經病理證實為結腸癌的76例患者病歷資料,其中男性48例、女性28例,年齡35~75歲,平均年齡(58.64±5.75)歲。納入標準:①術前均行雙能量CT及DCE-MRI檢查者;②檢查后2周內進行手術治療,且經術后組織病理檢查確診為結腸癌;③臨床資料、病理資料及相關影像學檢查資料完整。排除標準:①術前接受輔助放化療者;②合并其他惡性腫瘤疾病者;③結腸充氣不耐受,且存在碘劑禁忌證者;④影像學檢查圖像質量不滿足評估要求者。
1.2 方法
1.2.1 腸道準備 檢查前2 d叮囑患者以低脂、半流質、少渣飲食為主;檢查前1 d僅進食流食,檢查前8 h口服聚乙二醇等滲溶液2~3 L,2 h內服用完,待排澄澈清水便則認為腸道準備充分。若腸道準備不充分者則需在檢查當日清晨進行高滲甘露醇溶液灌腸。
1.2.2 雙能量CT檢查 采用西門子SOMATOM Definition Flash 掃描儀進行能譜CT成像檢查。患者腸道準備充分,檢查前1~5 min肌內注射山茛菪堿10~20 mg,叮囑患者在檢查床上取左側臥位,先進行常規平掃,待平掃結束后切換至雙能量掃模式進行增強掃描,采用高壓注射器經肘靜脈注射碘比醇(350 mgI/ml)對比劑,劑量1~1.5 ml/kg,流速為4.2 ml/s,以腹主動脈為感興趣區(閥值100 Hu),當達到峰值后進行動脈期自動掃描,待60 s后進行靜脈期掃描,管電壓為140 kV、100 kV。得到動脈期及靜脈期雙能量圖像。將數據上傳至syngoMMWP軟件工作站進行多平面重建及CT仿真內鏡等多項后處理,對病灶本身及轉移性病變進行多方位、多角度觀察。
1.2.3 DCE-MRI檢查 采用GE Discovery MR750w HD 3.0T磁共振進行檢查,18通道體部線圈,應用呼吸觸發閥門。灌腸輕度擴張腸管后,在注射對比劑前進行冠狀位壓脂穩態采集快速成像序列(FIESTA)(TR為4 ms,TE為1 ms,層厚為5 mm,層距為1 mm,矩陣為440×440)及單激發快速自旋回波序列(SSFSE)(TR為1400,TE為87 ms,層厚為5 mm,層距為1 mm,矩陣為440×440);橫斷位FIESTA(TR為4,TE為1 ms,層厚為4 mm,層距為1 mm,矩陣為440×440)、SSFSE(TR為1300,TE為87 ms,層厚為5 mm,層距為1 mm,矩陣為440×440)、擴散加權成像(層厚為4 mm,層距為0,矩陣440×440,DWI序列b值均取1000 s/mm2)序列。采用雙通道型高壓注射器注射器經右側肘靜脈注射扎噴替酸葡胺(0.25 ml/kg)對比劑,速度為3.5 mk/s,進行動態增強掃描(TR為5.36,TE為2.46 ms,層厚為3 mm,層距為0.2 mm,矩陣為440×440)。將檢查數據上傳至GE ADW4.6工作站,對獲得的灌注圖像進行層面校對,并結合DCE-MRI序列確定腫瘤范圍,勾畫出感興趣區域,進行觀察分析。
1.3 病理TNM分期
參照食管癌TNM分期標準[6]進行TNM分期。原發腫瘤(T):腫瘤侵犯黏膜基層,未侵入固有肌層為T1期;侵犯固有肌層為T2期;穿透固有肌層,但尚未穿透腹膜臟層至結直腸旁組織為T3期間;侵犯腹膜臟層或粘連或侵犯于附近器官及結構為T4期。區域淋巴結(N):無淋巴結轉移為N0期;有1~3枚區域淋巴結轉移為N1期;4枚以上區域淋巴結轉移為N2期。遠處轉移(M):有轉移為M1,無轉移為M2。
1.4 圖像分析
由本院2名資深醫師獨立閱片后,若意見不一致可討論給出一致評估結果。主要病變部位及大小,是否有侵犯鄰近器官,病灶影像學表現,腸周有無轉移淋巴結,腹腔內及腹膜后是否有轉移病灶等。最終以術后病理檢查結果為“金標準”,雙能量CT聯合DCE-MRI鑒別評估結腸癌分期中,任意一項確診即可判定。
1.5 統計學方法
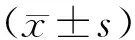
2 結果
2.1 病理結果
76例結腸癌患者經手術病理評估T1期10例,T2期15例,T3期28例,T4期23例;N0期38例,N1期26例,N2期12例。
2.2 雙能量CT成像、DCE-MRI判斷結腸癌T分期結果
雙能量CT成像術前評估結腸癌T分期與病理T分期一致性一般(kappa=0.689,P<0.05) ; DCE-MRI術前評估結腸癌T分期與病理T分期一致性一般(kappa=0.726,P<0.05);雙能量CT成像聯合DCE-MRI術前評估T分期與病理T分期一致性好(kappa=0.871,P<0.05)。結果見表1。

表1 雙能量CT成像、DCE-MRI判斷結腸癌T分期結果/例
2.3 雙能量CT成像、DCE-MRI判斷結腸癌N分期結果
雙能量CT成像術前評估N分期與病理N分期一致性一般(kappa=0.676,P<0.05) ; DCE-MRI術前評估N分期與病理N分期一致性一般(kappa=0.718,P<0.05);雙能量CT成像聯合DCE-MRI術前評估N分期與病理N分期一致性好(kappa=0.850,P<0.05)。結果見表2。

表2 雙能量CT成像、DCE-MRI判斷結腸癌N分期結果/例
3 討論
結腸癌早期可通過腫瘤根治術及區域淋巴結清掃治療,但大部分患者入院就診時病情多發展至中晚期,錯失手術最佳治療時機,常需要通過術前放化療縮小腫瘤病灶后行手術治療,以提高腫瘤切除率[7]。因此術前有效評估結腸癌腫瘤分期對手術及放化療方案的制定具有重要指導意義。
目前鋇灌腸、腸鏡及影像學檢查是術前評估結腸癌分期的有效方法,其中鋇灌腸痛苦大,患者耐受性較差,且輻射劑量較大,并無法觀察病灶情況,而腸鏡可觀察腸腔內病灶大小及形態,對是否侵犯周圍組織評估受限,尤其以腸梗阻患者應用局限性較大,無法觀察病灶遠端情況[8-9]。影像學檢查具有無創、可重復、安全性高等特點,常用于結腸癌術前評估中,其中以CT及MRI最為常見[10]。雙能量CT是具有兩個X線球管及兩套探測系統,掃描可獲得兩組圖形,且低能與高能檢查數據均為同層掃描所得,不存在位置及時間差,且在不同能量的X線穿過的物質不同時,衰減度存在一定差異性,繼而完成物質分離,經由雙能量后處理軟件獲碘圖,以反映腫瘤組織內血流灌注情況,是病變組織強化特征的有效評估指標之一[11-12]。DCE-MRI是經靜脈注射造影劑后,進行多期掃描的檢查方式,可通過造影劑觀察腫瘤血管分布,其中定量分析主要依據藥代動力學模型,生理及病理改變的基礎是腫瘤血管生成的數量及血管通透性增加,使腫瘤內血流動力學發生改變,強化程度增加,利于臨床結果的判定[13-14]。
本研究將雙能量CT與DCE-MRI聯合應用于結腸癌術前腫瘤分期評估中,結果顯示,雙能量CT成像聯合DCE-MRI術前檢查結果與病理T分期、N分期結果一致性較好。提示上述能量CT成像聯合DCE-MRI應用于結腸癌術前檢查中,能很好判斷腫瘤T分期,為臨床鑒別評估提供有價值的影像學信息。分析其原因雙能量CT檢查可通過3D 圖像全方位觀察腸腔內病灶情況、腫瘤向腸腔外結構侵犯及有無淋巴結轉移情況,且雙能量CT能夠完全顯示整個結直腸,且能夠通過MPR重建圖像,精準定位,不僅利于術前分期評估,還可指導手術定位[15-16]。但CT檢查仍存在一定局限,如對軟組織分辨率較低,無法清晰分辨結直腸黏膜層與肌層,僅通過觀察腸壁厚度、狹窄程度及形態進行腫瘤T1~T3判定,對腫瘤浸潤深度情況上存在一定不足。而DCE-MRI檢查在對比劑注射后隨濃度梯度在血管內內外轉移,而當血管通透性及滲透面積增加時,對比劑進入血管外細胞間隙增多,則T1馳豫時間縮短,腫瘤出現強化,而T分期越高,新生血管增加,血流灌注增加,腫瘤對血管及周圍組織浸潤破壞更嚴重,血管通透性上升,對比劑進入血管外細胞間隙增多[17-18]。因此DCE-MRI可彌補CT檢查無法評估腫瘤浸潤深度的不足。此外T1期在DCE-MRI顯示為病灶外緣光整,肌層連續,T3則顯示信號穿透至脂肪組織中,出現肌層連續性中斷,外緣不光整。且結腸系膜內腫瘤微小轉移結節在DCE-MRI均呈輕度強化。DCE-MRI檢查1.0 cm以上的轉移性淋巴多表現為不均勻強化,且部分淋巴結內部可見壞死,出現無強化區。因此雙能量CT成像與DCE-MRI聯合可優勢互補,通過影像、量化分析及血流灌注等情況進行綜合分析,能夠更敏感地反映結腸癌患者腫瘤分期情況,為臨床術前治療方案擬定提供客觀參考依據,提高術前腫瘤分期評估率。
綜上所述,雙能量CT成像聯合DCE-MRI在結腸癌術前分期評估中具有較高價值,可為結腸癌患者術前分期評估、術前治療方案的制定提供參考依據。

