帕金森病和抑郁癥患者腦組織Brodman9區域共同差異基因的生物信息學分析
白 雪, 趙淑敏, 陳冉冉, 張晶晶
(內蒙古自治區赤峰市醫院神經內科, 內蒙古 赤峰 024000)
帕金森病(Parkinson Disease,PD)是一種以黑質多巴胺能神經元進行性丟失為主要病理表現,肌強直和行動遲緩為核心運動癥狀,容易伴發認知和精神障礙等非運動癥狀的慢性神經退行性疾病,我國65歲以上人群患病率為1.7%[1]。抑郁癥(Major depressive disorder,MDD)是一類情緒低落、快感缺失、意志活動減退等為主要癥狀的情緒障礙。認知癥狀是MDD重要的3個維度之一,病程中持續存在損害[2]。PD患者常伴發抑郁和認知損害癥狀,PD和MDD共病能夠降低患者自身運動功能認知,更容易導致抽象推理等認知功能缺陷,影響生活質量。前額葉皮層Brodman9(BA9)區域在認知、運動和記憶相關功能中起著重要作用,此區域GABA能神經傳遞缺陷參與MDD發病過程[3]。PD患者BA9區也存在神經元損傷、路易小體形成、以及線粒體功能和蛋白折疊相關通路的轉錄組異常[4],重復經顱磁刺激前額葉背外側皮層的能夠改善PD患者伴發的MDD和認知功能障礙[5]。因此,PD和MDD患者可能在BA9區域存在共同的分子病理變化。本研究中,我們利用生物信息學方法,分析PD和MDD患者在BA9區的共同差異基因及富集通路,挖掘關鍵致病基因,為PD和MDD共同發病機制研究提供參考。
1 材料與方法
1.1芯片數據來源與預處理:應用在線GEO數據庫(http://www.ncbi.nlm.nih.gov/geo/)下載GSE20168、GSE54567、GSE54568和GSE54570的芯片數據。其中,GSE20168數據使用GPL96平臺,包含14例PD患者和15例對照患者的BA9區域腦組織轉錄組數據,PD和對照腦組織來源于美國馬里蘭大學腦組織庫、哥倫比亞大學紐約腦組織庫、弗吉尼亞州西洛杉磯脊髓液資源VA醫療中心、哈佛大學麥克萊恩醫院和邁阿密腦組織銀行。PD診斷標準為通過神經病理學診斷證實的PD患者,排除具有其他神經病理疾病病例。對照組要求無腦部疾病病史。GSE54567數據使用GPL570平臺,包含14例MDD和14例對照患者的BA9區域腦組織轉錄組數據;GSE54568數據使用GPL570平臺,包含15例MDD和15例對照患者的BA9區域轉錄組數據;GSE54570數據使用GPL570平臺,包含15例MDD和15例對照患者的BA9區域轉錄組數據;MDD和對照腦組織來源美國紐約州哥倫比亞大學精神病學研究所人類生物學中心腦庫,MDD入組標準:生前依據美國DSM-Ⅲ-R精神障礙診斷標準診斷重度抑郁暴力自殺病例。排除毒理學篩查中有精神藥物或非法藥物中毒,因長期痛苦的疾病死亡或內科疾病猝死患者。對照組入組標準:沒有精神障礙,沒有使用藥物,由于自殺以外的原因且沒有長時間的痛苦的突然死亡患者。全部數據使用R軟件(版本號為3.6.3)調取limma包的normalizeBetweenArrays函數標準化處理。
1.2差異表達基因提取及共表達差異基因分析:我們分別對4個芯片數據集進行差異表達分析,首選調取limma包分析各個數據集的差異表達基因(Differential genes,DEGs),使用P<0.05并logFC絕對值≥0.3作為標準篩選差異基因,應用ggplo2包繪制火山圖和熱圖。然后提取GSE20168、GSE54567、GSE54568和GSE54570數據DEGs并依據表達上調或下調進行韋恩圖分析,鑒定PD和MDD患者BA9區共表達差異基因。
1.3差異基因富集分析:基因本體(Gene Ontology,GO)數據庫把基因的功能分成了三類:生物過程(biological process,BP)、細胞組分(cellular component,CC)和分子功能(molecular function,MF)。應用GO數據庫可以了解目標基因在CC.MF和BP三個層面上有什么關聯。京都基因百科全書和基因組(Kyoto Encyclopedia of Genes and Genomes,KEGG)的PATHWAY數據庫整合了當前在分子互動網絡的知識。我們使用R語言調取clusterProfiler包(V3.14.3)分別對PD和MDD的上調或下調DEGs進行GO和KEGG富集分析。應用p.adj<0.05且qvalue<0.2作為有意義富集條目的篩選條件進行篩選,并對排名前10的GO條目和KEGG通路繪制氣泡圖展示。應用GO plot包(V1.0.2)繪制和弦圖展示PD和MDD涉及的共同GO_BP條目及各自涉及DEGs。
1.4蛋白-蛋白相互作用網絡及關鍵基因分析:為了系統分析PD和MDD共表達DEGs生物學功能,我們將共表達DEGs導入String數據庫(V11.5; https://string-db.org)分析表達蛋白質間相互作用(PPI)網絡,互作評分設置為0.15。然后將String數據庫分析的蛋白相互作用數據導入cytoscape軟件(V3.9.1)作圖展示蛋白相互作用網絡。使用CytoHubba插件根據最大團中心性(MCC)方法對PPI網絡中的基因進行從高到低排序,確認前10位關鍵DEGs。
2 結 果
2.1差異表達基因:GSE20168數據分析顯示:與對照組相比,PD患者存在12548個DEGs。MDD患者與對照組比較,GSE54567數據獲得21655個DEGs,GSE54568數據也有21655個DEGs,GSE54570數據獲得12548個DEGs。應用P<0.05并logFC絕對值≥0.3作為條件篩選后,GSE20168數據中上調DEGs 736個,下調DEGs 829個;GSE54567數據中上調DEGs 13個,下調DEGs 14個;GSE54568數據中上調DEGs 64個,下調DEGs 82個;GSE54570數據中上調DEGs33個,下調DEGs34個(圖1A)。將四個數據集上調及下調DEGs分別進行韋恩圖分析(圖1B),結果顯示PD(GSE20168)和MDD(GSE54567、GSE54568、GSE54570)患者均上調的DEGs有21個,分別為:SLC35E1、ATP8B1、TSR1、ZNF721、RIOK3、FBXW12、ZNF160、POLR1B、CACNA1I、MZT2B、PGF、RP11-403P17.4、RPL23AP32、DBT、PRR11、USP34、LRRFIP1、DSERG1、DIP2A、AEBP1和DNAJB2基因,均表達減少的DEGs有13個,分別為:NPTX2、PCSK1、SST、PPP1CB、SEC22B、ENPP4、NME5、CAPZA2、GLRB、ITFG1、GLIPR1、TM6SF1和DUSP6基因。相應結果使用熱圖展示(圖1C)。
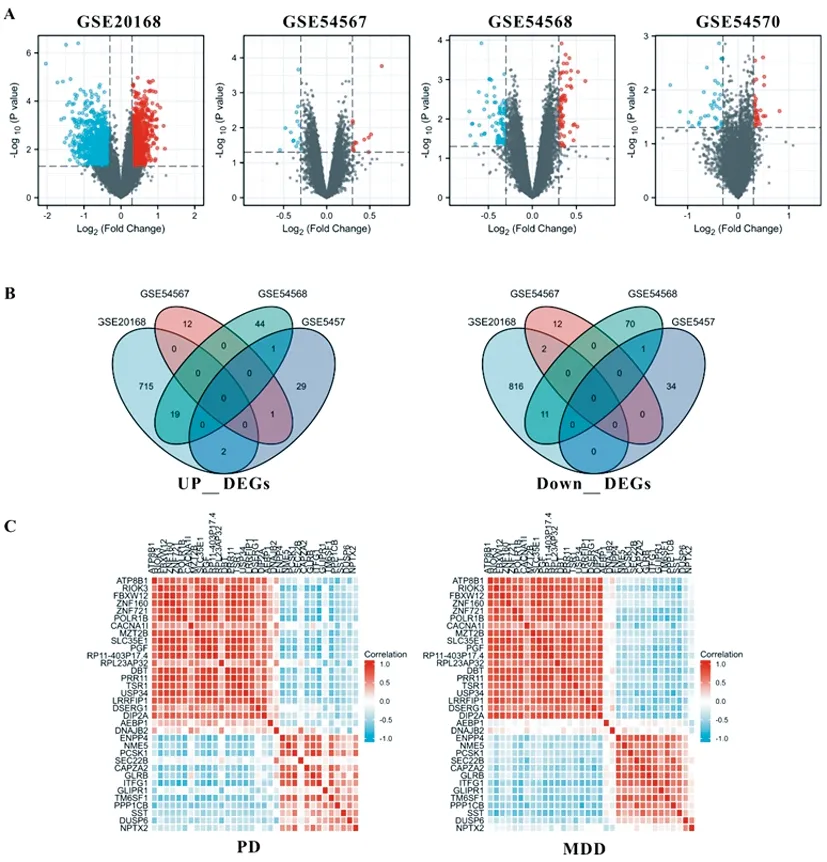
圖1 DEGs表達可視化
A.火山圖展示各數據集DEGs:紅色的點代表高表達的DEGs,藍色的點代表低表達的DEGs,篩選條件:P<0.05并logFC絕對值≥0.3;B.韋恩圖分析PD和MDD共表達DEGs(左側:上調DEGs,右側:下調DEGs);C.熱圖展示共表達DEGs水平(左側:PD樣本,右側:MDD樣本),紅色代表高表達信號,藍色代表低表達信號。
2.2DEGs功能富集分析:PD患者上調的736個DEGs功能富集分析獲得有意義GO_BP條目188條,包括銅離子解毒、銅離子應激反應、細胞對銅離子的反應等(圖2A,左側),GO_CC條目41條,GO_MF條目12條;獲得KEGG通路17條,前10位包括人乳頭瘤病毒感染、MAPK信號通路、胰島素抵抗、mTOR信號通路等(圖2A,右側)。PD患者下調的829個DEGs功能富集分析發現有意義GO_BP條目383條,包括神經元投射發育的調節、樹突發育及形態發生、囊泡定位、學習或記憶等(圖2B,左側),GO_CC條目164條,GO_MF條目56條,獲得KEGG通路41條,包括阿爾茨海默病、帕金森綜合癥、肌萎縮側索硬化、亨廷頓病、脊髓小腦性共濟失調等通路(圖2B,右側),多數為神經退行性疾病相關通路。MDD患者上調DEGs功能富集分析未獲得有意義BP、CC、MF條目及KEGG通路;下調DEGs功能富集分析獲得有意義GO_BP條目84條,包括認知、學習和記憶、細胞因子產生的負調控等條目(圖2C)。
韋恩圖分析顯示PD與MDD下調DEGs有5個共同的GO_BP富集條目,分別是:GO:0007611(學習與記憶)、GO:0050890(認知)、GO:0007612(學習)、GO:0051384(對糖皮質激素的反應)、GO:0008306(聯想學習)條目,提示PD和MDD均存在認知、學習、記憶及糖皮質激素反應通路功能障礙。這些共同條目在PD患者涉及的基因主要包括:NPTX2、ATXN1、PAFAH1B1、NLGN4X、VIP、PLCB1、BRINP1、FEN1、SHC3、CDK5、BHLHB9、SERPINF1、KRAS等45個基因(圖2E,左側),在MDD患者涉及的基因主要包括:NPTX2、ARC、CRH、CRHBP、HLA-DRA、X3CR1、FOS、JUN、CLDN5、BTG2等14個基因(圖2E,右側)。
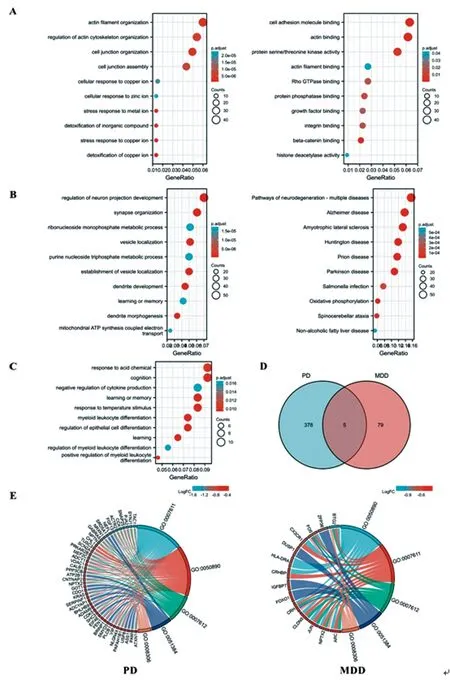
圖2 PD與MDD患者DEGs GO和KEGG富集分析可視化
A.PD患者上調DEGs在GO_BP條目(左側)和KEGG(右側)通路前10位;B.PD患者下調DEGs在GO_BP條目(左側)和KEGG(右側)富集通路前10位;C.MDD患者下調DEGs在GO_BP條目前10位;D.PD和MDD患者下調DEGs在GO_BP條目韋恩圖分析;E.左側:和弦圖展示PD患者共差異GO_BP條目及涉及DEGs,右側:和弦圖展示MDD患者共差異GO_BP條目及涉及DEGs。
2.3PPI網絡及關鍵DEGs分析:為了了解PD和MDD共同DEGs表達蛋白間相互作用及鑒定關鍵基因,我們使用在線工具String及cytoscape軟件構建了34個共同DEGs表達蛋白的PPI網絡(圖3A),進一步使用CytoHubba插件分析了PPI網絡中的前10個關鍵DEGs,關鍵程度從高到低排序依次為NPTX2、PCSK1、SLC35E1、ATP8B1、DUSP6、SST、TSR1、SEC22B、PPP1CB、ZNF721基因(圖3B)。在這些基因中,NPTX2、PCSK1、DUSP6、SST、PPP1CB基因在PD和MDD患者BA9區域均顯著表達下調(圖3C,3D,P<0.05)。
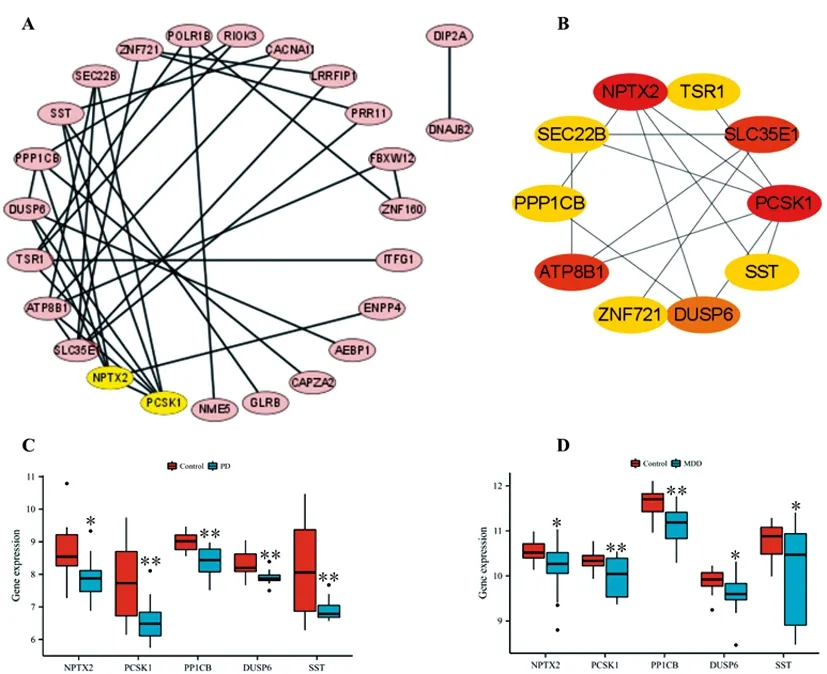
圖3 PD和MDD共同DEGs PPI網絡及關鍵基因分析A.PD和MDD共同DEGs的PPI網絡圖;B.關鍵DEGs的PPI;C.PD患者關鍵下調DEGs表達箱圖;D.MDD患者關鍵下調DEGs表達箱圖,*P<0.05,**P<0.01
3 討 論
MDD是PD的常見伴發疾病,并且越來越多證據顯示MDD患者更容易患PD[1]。PD和MDD患者均會出現前額葉病理變化及認知功能障礙,我們推測前額葉認知相關通路異常可能是PD和MDD共同的致病基礎。在本研究中,我們應用GEO數據庫中PD和MDD患者BA9區域的轉錄組數據進行生信分析,結果發現PD和MDD患者前額葉BA9區域存在34個共同的DEGs,其中上調21個,下調13個。DEGs功能富集分析顯示PD和MDD存在5個共同的GO_BP條目,主要與認知、學習、記憶有關。進一步的PPI網絡作圖及關鍵基因分析顯示NPTX2、PCSK1、DUSP6、SST、PPP1CB基因表達減少可能是PD和MDD在基因表達層面共同的改變。
人類前額葉整合來自眾多輸入結構的信息,并通過與其他皮層和皮層下區域的連接將更新的信息匯聚到輸出結構,發揮認知過程、情緒調節、動機和社交能力。分子影像研究發現PD早期前額葉區域多巴胺攝取增加,但在疾病晚期中外側和內側前額葉多巴胺和D2受體明顯減少,患有抑郁癥的PD患者左側背外側前額葉皮層活動顯著降低,且內側額葉網絡的失活與認知損傷相關[6],恢復內側前額葉皮層的突觸可塑性能夠改善帕金森病小鼠模型抑郁樣行為[7]。因此,深入研究PD和MDD患者前額葉區域分子病理改變對于理解PD合并MDD的發病機制和制定治療策略具有重要意義。我們的研究發現PD和MDD患者在前額葉BA9區存在共同的認知、學習、記憶功能相關條目及相應DEGs,說明前額葉區域認知相關基因表達改變可能是PD和MDD患者共同的分子病理基礎。約20%~33%的PD患者在診斷時已經出現輕度認知障礙,高達60%~80%的PD患者在12年內進展為帕金森癡呆。MDD同樣可導致前額葉抑制及認知靈活性受損,出現認知中不靈活的負面偏見,包括僵化的負面信念等。20~50%的MDD患者伴有認知障礙,經常導致患者對認知功能惡化的抱怨,而認知缺陷導致對抑郁的抱怨。因此,前額葉區域認知相關基因的表達變化也可能是PD容易伴發MDD及癡呆的原因。
目前,已知的PD和MMD共同相關基因極少,有研究報道國人Tef、5HTR1A、SLC6A15和TPH2單核苷酸多態性改變可能與PD伴發MDD相關,這些基因均與5羥色胺等神經遞質合成、調控及代謝相關。我們發現編碼神經元五聚體蛋白Ⅱ的NPTX2基因在PD和MDD的BA區域均表達減少,而該基因主要參與γ氨基丁酸(GABA)信號調節,在神經元激活和腦源性神經營養因子誘導下,主要神經元突觸前表達釋放NPTX2蛋白,調節其和GABA能中間神經元之間的興奮性突觸傳遞,較低的NPTX2水平能夠降低GABA能抑制信號傳導[8]。本研究發現PD患者BA9區域NPTX2表達減少與既往研究不一致,既往全基因組表達芯片研究發現NPTX2在PD患者黑質和大腦皮層路易小體內表達上調[9],我們認為這可能與PD病程及腦組織取材部位不同有關,因為同為α突觸核蛋白相關疾病,路易體癡呆患者腦脊液中NPTX2表達減少且與α突觸核蛋白水平及視覺空間域認知下降有關,該結果支持我們的發現[10]。動物實驗顯示NPTX2表達減少能夠導致小鼠抑郁樣癥狀及海馬區域炎癥反應激活[8]。α突觸核蛋白在多巴神經元內異常聚集是PD的重要病理表現,我們認為異常聚集α突觸核蛋白可能促進PD患者神經元突觸喪失和功能減少,繼而NPTX2表達減少,導致NF-κB信號通路激活和腦內炎癥反應過渡激活,從而出現抑郁癥狀,NPTX2表達變化與PD合并MDD的關系值得深入研究。
我們還發現BA9區PCSK1、DUSP6、SST、PPP1CB基因表達降低在PD和MDD同時存在,PCSK1是中樞黑皮質素系統成分阿片黑皮質素原(POMC)的重要表達調控基因,PCSK1缺失導致POMC不能剪接為促腎上腺皮質激素(ACTH)和α-黑色素細胞刺激素(α-MSH),參與機體應激反應、能量平衡、免疫調節等生理活動[11],而應激障礙、能量平衡和免疫調節異常均是PD和MDD發病的重要機制。DUSP6基因編碼的雙特異性磷酸酶6是蛋白酪氨酸磷酸酶亞家族的成員,可以使細胞外信號調節蛋白激酶1/2去磷酸化,從而調節信號并影響細胞氧化應激、增殖、分化和凋亡,下調DUSP6誘導錐體神經元興奮性和應激敏感性,增加DUSP6表達能夠減輕六羥基多巴對多巴胺神經元的損傷。SST基因編碼生長抑素,能夠調控GABA神經元異質性神經遞質,在神經退行性疾病和精神疾病表達較低,包括PD和MDD[12]。PPP1CB基因可編碼蛋白磷酸酶(PP1)的一個亞基,PP1是重要的絲/蘇氨酸蛋白磷酸酶,與蛋白激酶作用相反,使蛋白脫磷酸化,參與晝夜節律調節[13],而晝夜節律異常是PD、MDD和認知障礙患者常見癥狀。上述這些基因可能參與了PD和MDD在前額葉共同的發病分子機制。
綜上,雖然我們的研究尚缺乏實驗驗證,但仍能為PD和MDD共同發病分子機制研究提供重要線索,前額葉BA9區域認知通路功能障礙及NPTX2等關鍵基因表達減少可能是PD和MDD共同的分子病理。

