Fe基催化劑物相演變及CO2加氫反應性能影響
梁 潔 , 王欣宇 ,高新華,,* ,田菊 梅 ,段 斌 ,張 偉 ,江永軍, ,Prasert Reubroycharoen ,張建利,* ,趙天生
(1.寧夏大學化學化工學院 省部共建煤炭高效利用與綠色化工國家重點實驗室, 寧夏 銀川 750021;2.國家能源集團寧夏煤業有限責任公司煤炭化學工業技術研究院, 寧夏 銀川 750411;3.寧夏計量質量檢驗檢測研究院 國家煤及煤化工產品質量檢驗檢測中心(寧夏), 寧夏 銀川 750200;4.朱拉隆功大學理學院化學工藝系 生物能源和可再生化學品催化卓越中心, 泰國 曼谷 10330)
CO2過度排放導致全球氣候變暖,如何實現“碳減排”已成研究熱點。通過發展綠色能源(生物質、光伏、天然氣、核能等)或將CO2資源化利用,有望逐步減少碳排放[1]。采用熱催化技術將CO2加氫轉化為甲烷(CH4)、甲醇、甲酸,以及低碳烯烴(-)等短鏈碳氫化物已取得較大進展[2-11]。基于費托合成 (Fischer-Tropsch synthesis,FTS),人們發展了CO2加氫制烴類化合物路徑。包括兩個步驟:CO2先通過逆水煤氣反應(Reverse Water Gas Shift,RWGS)生成一氧化碳 (CO),CO 再通過 FTS反應轉化為烴類化合物,稱為CO2-FTS路徑。Fe基催化劑資源儲備豐富、價格低廉且RWGS活性高,被廣泛用于CO2-FTS反應研究[12,13]。
Fe基催化劑CO2加氫反應的產物選擇性與FTS反應類似,服從Anderson-Schulz-Flory (ASF)分布規律[14],需要加入助劑調控。同時,堿金屬助劑可以改變催化劑表面酸堿度、調變催化劑活性位點電子密度,提高CO2吸附量,從而提高反應活性。Zhao等[15]研究了Na、Mn助劑對CO2加氫反應中RWGS和FTS反應活性和產物選擇性的影響,發現Na的加入減弱了Fe與Mn之間的強相互作用,使Mn轉變成為對CO2加氫轉化有利的助劑,提高了CO2的加氫活性和烯烴的選擇性。在Fe基催化劑中加入助劑可以顯著改善Fe基催化劑性能,調節產物分布。Yao等[16]通過共沉淀法制備了FeNaS催化劑,發現Na改性有助于CO解離和抑制CH4產生,而Na與S共同作用能夠降低反應能壘,增強催化劑活性,提高產物選擇性。但是,助劑對預處理過程中的還原及碳化機理的相關研究報道較少。
研究認為,CO2加氫Fe基催化劑需同時具有Fe3O4和Fe5C2兩種活性相,分別催化RWGS和FTS反應,這兩種活性相的比例及協同作用是影響CO2加氫反應活性和產物選擇性的關鍵[15]。在FTS反應中對Fe基催化劑物相的變化展開研究發現,Fe基催化劑的FTS反應還原過程一般分兩步進行:第一步Fe2O3被還原為Fe3O4;第二步Fe3O4被緩慢還原為金屬鐵[17,18]或碳化鐵[19]。Fe基催化劑在FTS反應還原過程產生復雜的物相變化[20]。但在CO2加氫反應中對于此類的研究報道則較少,而且就Fe基催化劑在FTS反應中物相的變化來說,CO2加氫反應這一催化體系中,Fe基催化劑的活性相變化更為復雜。因此,研究Fe基催化劑在CO2-FTS反應中的物相演變具有重要意義。
本研究采用等體積浸漬法制備不同Na修飾量的Fe2O3樣品,采用原位XRD技術分別對Fe基催化劑在H2或合成氣(CO/H2= 1∶2)氣氛中的物相演變進行研究,揭示Na助劑和預處理氣氛對Fe基催化劑物相控制及CO2加氫反應性能影響規律。
1 實驗部分
1.1 催化劑的制備
取適量 Fe(NO3)3·9H2O 置于馬弗爐中,400 ℃空氣氛圍焙燒5 h,得到氧化鐵樣品,記為Fe2O3。
等體積浸漬法制備Na-Fe2O3,取適量Na2CO3粉末(Fe/Na物質的量比為10∶1或10∶2)配成等體積浸漬液,超聲條件下逐滴加至Fe2O3粉末中,繼續超聲至充分混合,80 ℃干燥12 h。干燥后的樣品造粒(20-40目)備用,記作1Na-Fe2O3和2Na-Fe2O3。
1.2 催化劑的表征
催化劑物相由XRD表征,儀器型號為Rigaku SmartLab,Cu Kα 輻射 (λ = 0.154 nm),X 射線管電壓40 kV、管電流 40 mA。測試條件:測試 10°-85°、步長 0.02°,掃描速率 6(°)/min。
催化劑還原或反應過程中物相演變由in-situ XRD表征,儀器型號和測試條件與XRD一致。還原氣 (H2/合成氣 (CO/H2= 1∶2),20 mL/min)或反應氣 (CO2+ H2,CO2/H2= 1∶3)在常壓下由轉子流量計(20 mL/min)通入原位反應池:溫度25-450 ℃,升溫速率10 ℃/min,在相應溫度點停留2 min后XRD線掃。
使用全自動程序升溫化學吸附儀(Auto ChemⅡ 2920)進行H2程序升溫還原(H2-TPR)表征催化劑還原行為。測試條件:50 mg樣品He氣氛(30 mL/min)下350 ℃預處理1 h,冷卻至50 ℃。通入10% H2/Ar (30 mL/min)進行還原,樣品以10 ℃/min的升溫速率從50 ℃線性增加至800 °C,由熱導檢測器(TCD)記錄還原曲線。
Fe2O3催化劑樣品的合成氣程序升溫表面反應實驗通過微型評價裝置儀器進行。催化劑樣品首先在300 ℃ Ar氣氛下(20 mL/min)預處理1 h,降至室溫后通入合成氣(CO/H2= 1∶2, 20 mL/min),以10 ℃/min的升溫速率升至500 ℃,產物通過QGA氣體分析質譜儀在線檢測。
1.3 催化劑性能評價
在微型固定床反應器上進行CO2加氫反應性能評價。0.5 g Fe2O3催化劑樣品首先在H2或合成氣(CO/H2= 1∶2)中 450 ℃ 還原 4 h (1000 h-1,0.1 MPa),繼續在還原氣氛下降至室溫。然后通入原料氣(H2/CO2/Ar = 72∶24∶4),反應 溫度 320 ℃,3 MPa、1000 h-1進行CO2加氫性能評價。產物經氣相色譜儀(GC-2014C)在線分析,有機組分采用Rtx-1(60 m × 0.32 mm)毛細管柱,無機組分采用MS-13X(3 m × 1/8)填充柱,甲烷關聯法定量。
1.4 計算方法
反應物轉化率和產物選擇性計算過程如下:

2 結果與討論
2.1 熱力學計算
在CO2加氫反應體系中,Fe基催化劑前驅體主要物相為Fe2O3,需要經過預處理還原至RWGS反應的活性組分Fe3O4。利用公式(4)-(6)計算得出該反應在不同還原氣氛下的反應焓變、吉布斯自由能變以及平衡常數[21],對還原過程進行熱力學分析,結果如表1所示。從表1可以看出,兩個反應的反應焓變和吉布斯自由能變均小于0,表明反應放熱、還原過程熱力學可行。

表1 Fe2O3還原反應的熱力學分析Table 1 Thermodynamic analysis of Fe2O3 reduction reaction
2.2 催化劑物相(XRD)
圖1為不同催化劑樣品XRD譜圖。由圖1可知,Fe2O3催化劑樣品在 2θ為 24.1°、33.1°、35.6°、40.8°、49.5°、54.1°、62.5°、64.1°出現 Fe2O3(PDF#33-0664) 特征衍射峰[22],說明本實驗制備出晶型結構單一的Fe2O3催化劑樣品;經等體積浸漬法制備出的1Na-Fe2O3和2Na-Fe2O3催化劑樣品物相并沒有發生變化,且未檢測出Na2CO3的峰,表明Na在Fe2O3催化劑表面均勻分散,未發生團聚現象。通過JADE Pro (Materials Data)軟件對樣品的XRD譜圖進行精修擬合,得到催化劑樣品的晶粒尺寸,如表2所示。結果表明,Na助劑的添加減小了Fe2O3的晶粒尺寸,Na助劑的修飾量為10∶1時,1Na-Fe2O3的晶粒尺寸最小;而修飾量增加至10∶2時,2Na-Fe2O3的晶粒尺寸略有增大。

表2 Fe2O3樣品的晶粒尺寸Table 2 Crystal size for different samples
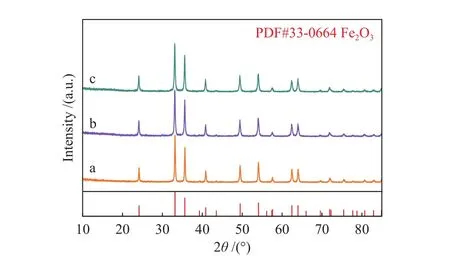
圖1 Fe2O3樣品的XRD譜圖Figure 1 XRD patterns of the Fe2O3 samples
2.3 催化劑還原性能
2.3.1 H2-TPR表征
圖2為不同Na助劑修飾量Fe2O3樣品的H2-TPR譜圖。由圖2可知,所有催化劑樣品在測試溫度范圍內表現出三個還原峰,被認為分別對應Fe2O3→ Fe3O4→ FeO → Fe 的 連 續 還 原 過 程[23]。其中,未改性的Fe2O3催化劑樣品在300-400 ℃出現第一個還原峰,峰頂溫度385 ℃,對應于Fe2O3→Fe3O4的還原。隨著Na助劑的加入,1Na-Fe2O3和2Na-Fe2O3催化劑樣品的該還原峰峰頂溫度向高溫偏移,表明Na助劑的修飾提高了Fe2O3物種的初始還原溫度。由于Fe3O4→ FeO → Fe物相的還原過程連續同時進行[23,24],FeO物種不能穩定存在,導致未改性的Fe2O3樣品后兩個還原峰沒有明顯裂分[25]。加入Na助劑后,1Na-Fe2O3和2Na-Fe2O3催化劑樣品第二個還原峰峰頂溫度向低溫偏移,表明Na的修飾促進Fe3O4物種的還原[26],使后兩個還原峰明顯裂分。為了直接確認Fe2O3在H2氣氛下的物相還原過程,本工作進一步采用in-situXRD進行了研究。
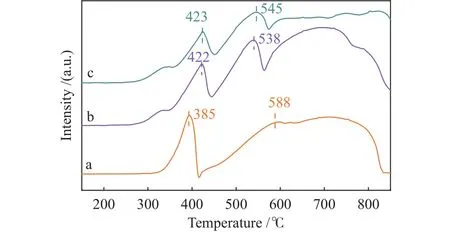
圖2 樣品的H2-TPR譜圖Figure 2 H2-TPR profiles of the samples
2.3.2 In-situ XRD表征
圖3為不同Na助劑修飾量Fe2O3樣品在H2氣氛下還原過程的in-situXRD譜圖。如圖3(a)所示,未改性的Fe2O3催化劑樣品在325 ℃時出現Fe3O4特征衍射峰 (PDF#19-0629)[27];而圖3(b)、(c)中,1Na-Fe2O3和2Na-Fe2O3催化劑樣品在350 ℃時出現Fe3O4特征衍射峰,表明Na助劑的修飾會提高Fe2O3物種的初始還原溫度,這與圖2中H2-TPR結果一致。
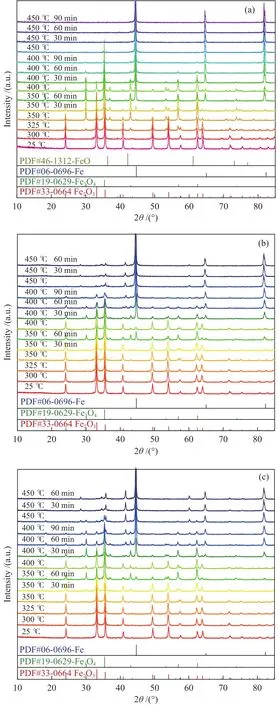
圖3 樣品在H2氣氛下還原的原位XRD譜圖Figure 3 In-situ XRD patterns of the samples under a H2 reduction atmosphere
對Fe2O3催化劑樣品繼續升溫還原,在350 ℃并保持溫度60 min時,圖3(a)觀察到單質Fe的特征衍射峰(PDF#06-0696)[27];繼續升高溫度時,Fe2O3特征衍射峰逐漸消失,單質Fe成為主要物相;而圖3(b)、(c)中,1Na-Fe2O3和 2Na-Fe2O3催化劑樣品中Fe2O3的特征衍射峰升溫至450 ℃時完全消失,Fe3O4和單質Fe成為主要物相。在原位XRD譜圖中未檢測到FeO的特征衍射峰(PDF#46-1312),這可能是由于FeO的衍射峰強度較低,或已被還原為單質Fe而未被檢測到。此外,發現對于Fe2O3樣品(圖3(a)),當溫度升高至450 ℃只顯示出單質Fe的特征衍射峰,說明鐵氧化物已被完全還原,這與傳統H2-TPR結果分析的“三步還原”過程 (Fe2O3→ Fe3O4→ FeO → Fe)略有不同,因此,對于H2氣氛下的Fe2O3還原過程可能為Fe2O3→Fe3O4→ Fe“兩步還原”。
圖4為不同Na助劑修飾量Fe2O3樣品在合成氣(CO/H2= 1∶2)氣氛下還原過程的in-situXRD譜圖。三組催化劑樣品在300 ℃時,物相均發生變化,出現Fe3O4特征衍射峰(PDF#19-0629),與H2相比,催化劑樣品在合成氣氣氛下所需初始還原溫度更低,說明在相同條件下合成氣的還原能力要強于H2。由圖4(a)可以看出,在400 ℃保持60 min時,出現Fe5C2特征衍射峰(PDF#51-0997),這被認為是CO2加氫制烯烴的活性物相[28];但圖4(b)、4(c)可以看出,1Na-Fe2O3和2Na-Fe2O3催化劑樣品在350 ℃保持60 min時就已經出現Fe5C2特征衍射峰,這說明Na助劑可以降低Fe2O3樣品的碳化反應溫度。繼續升溫至400 ℃時,三組催化劑樣品中Fe2O3的特征衍射峰逐漸消失,Fe5C2和Fe3O4成為主要物相;450 ℃時,在XRD譜圖中只能觀察到Fe5C2的特征衍射峰,說明Fe3O4已被完全碳化。研究發現,與圖3在H2氣氛下還原過程不同,采用合成氣還原時,并未出現Fe物相,而是直接生成了Fe5C2。因此,Fe2O3在合成氣 (CO/H2= 1∶2)氣氛下的還原及碳化過程可概括為:Fe2O3→ Fe3O4→ Fe5C2。
2.3.3 TPSR-MS表征
通過圖4原位XRD譜圖可以清楚觀察到,在合成氣(CO/H2= 1∶2)氣氛下,Fe2O3樣品先被還原為Fe3O4,然后發生碳化反應生成Fe5C2,并且在引入Na助劑后,會降低碳化反應的溫度,促進表面Fe5C2物種的生成。為進一步探究還原過程中Fe2O3樣品復雜物相演變,采用TPSR-MS對鐵氧化合物及鐵碳化合物的變化進行了研究。
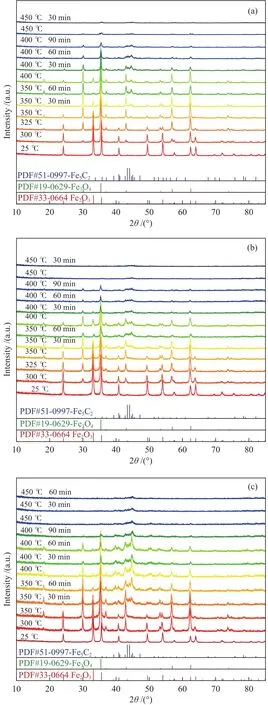
圖4 樣品在合成氣氣氛下還原的原位XRD譜圖Figure 4 In-situ XRD patterns of the samples under a H2 + CO(CO/H2 = 1∶2) reduction atmosphere
圖5為合成氣在催化劑樣品進行的CO + H2-TPSR-MS 譜圖。Fe2O3、1Na-Fe2O3和2Na-Fe2O3三個催化劑樣品在300 ℃后出現了H2消耗峰(3Fe2O3+H2= 2Fe3O4+ H2O)和第一個CO消耗峰(3Fe2O3+CO = 2Fe3O4+ CO2),檢測到了 H2O 和 CO2,對應Fe2O3→ Fe3O4物相變化;由圖5(b)、5(c)可以看出,1Na-Fe2O3和2Na-Fe2O3催化劑樣品CO消耗峰溫度低于圖5(a)中的Fe2O3樣品,說明Na修飾有助于CO解離[17];CO消耗量及CO2生成量增加,同時催化劑樣品還原溫度略有降低,說明Na修飾提高了樣品的還原能力。催化劑樣品CO第二個消耗峰對應Fe3O4→ Fe5C2的物相變化,由于Fe3O4碳化反應消耗CO生成CO2和Fe5C2,使得氣體分壓減小,故H2消耗峰面積升高。由圖5(b)、5(c)可以看出,1Na-Fe2O3和2Na-Fe2O3催化劑樣品CO第二個消耗峰溫度低于圖5(a)中的Fe2O3樣品,且消耗峰面積增加,表明Na修飾促進了樣品的碳化。
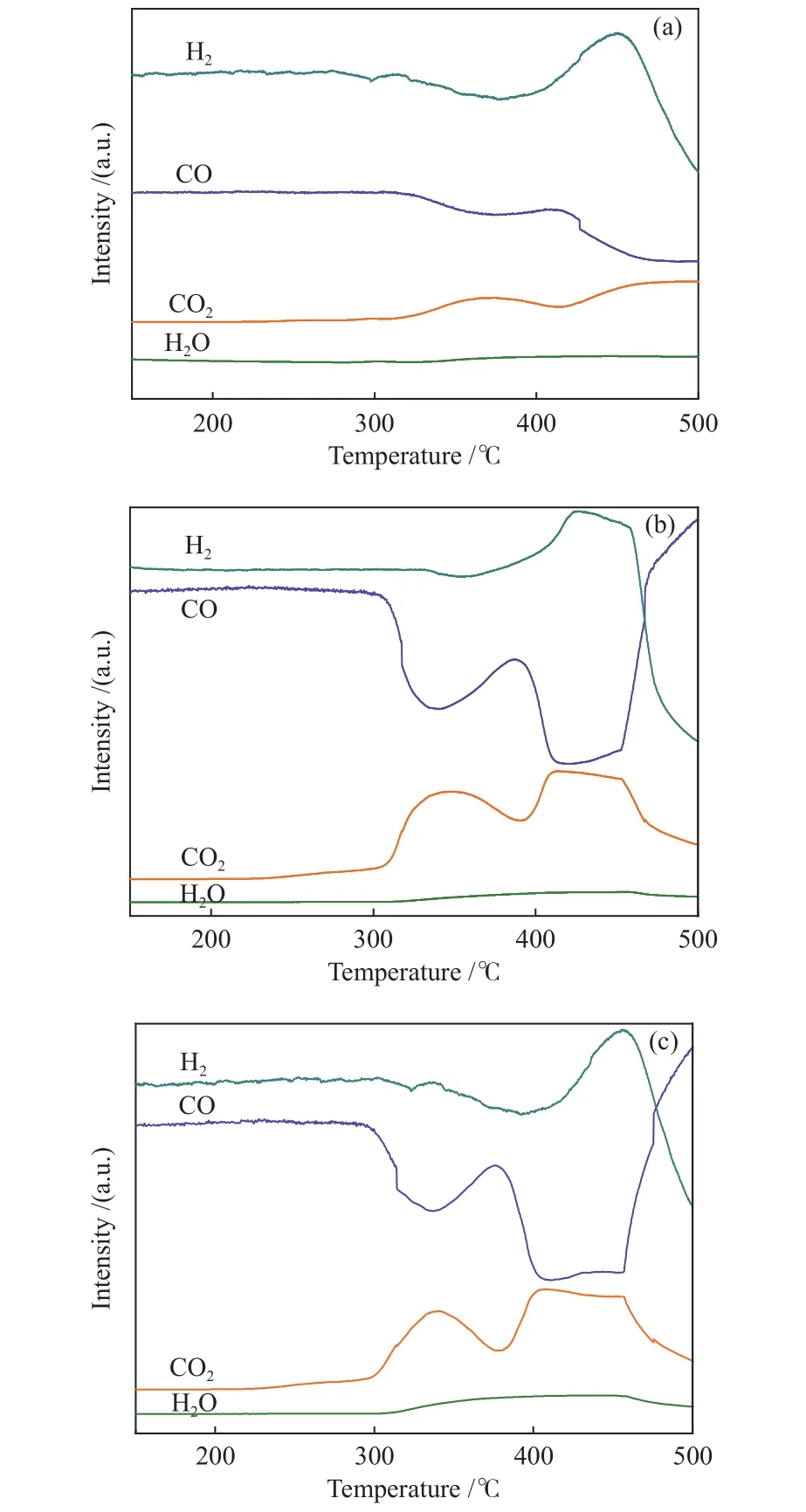
圖5 樣品的CO + H2-TPSR-MS譜圖Figure 5 CO + H2-TPSR-MS profiles of the samples
2.4 催化性能測試
圖6和圖7分別為不同預處理氣氛(H2、合成氣)還原后催化劑樣品用于CO2加氫性能評價圖和對應鐵物種含量圖。圖6 a為采用H2氣氛還原后的樣品,其CO2轉化率7.3%,CH4選擇性50.6%,物相以Fe3O4為主(圖7);圖6 b為采用合成氣還原后的樣品,其CO2轉化率較a催化劑升高至25.8%,CH4選擇性降至43.2%,及C5+選擇性升高。由于Fe5C2物種有利于C-C偶聯,促進C5+的生成,抑制CH4的生成[29],所以催化劑b產物中及C5+含量明顯增加。同時發現,與氫氣還原相比,經合成氣還原后催化劑上CO2轉化率明顯提升,這可能是因為合成氣還原生成了碳化鐵物種,有利于CO2經RWGS反應生成的CO迅速進行FTS反應。圖6c、6d為Na助劑修飾后的Fe2O3催化劑樣品,反應產物中CH4選擇性明顯降低,C5+選擇性明顯增加,相對應的圖7中c、d催化劑Fe3O4含量降低,Fe5C2含量增加。研究發現[30],在FTS反應中,堿金屬Na的修飾可降低CO加氫反應中CH4的選擇性。進一步提高助劑Na的添加量后,催化劑的產物選擇性并未發生明顯變化,但CO2轉化率略微降低,這是由于與1Na-Fe2O3樣品相比,2Na-Fe2O3樣品Fe5C2含量降低,Fe2O3含量略有增加,不利于CO2加氫反應的進行,導致CO2的轉化率降低。綜上所述,控制Fe基催化劑氧化物與碳化物比例非常關鍵,Na助劑修飾和合成氣預處理都可以促進Fe5C2物種生成,其中,1Na-Fe2O3樣品在進行CO2加氫實驗時表現出最佳反應性能,CO2轉化率達26.0%,C5+選擇性42.7%。
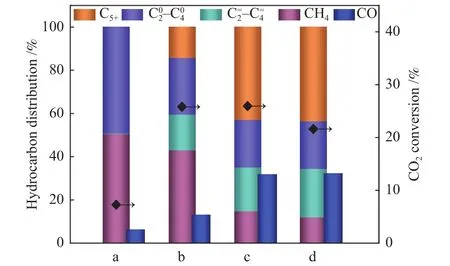
圖6 催化劑CO2加氫反應性能Figure 6 Catalytic performance of samples on CO2 hydrogenation
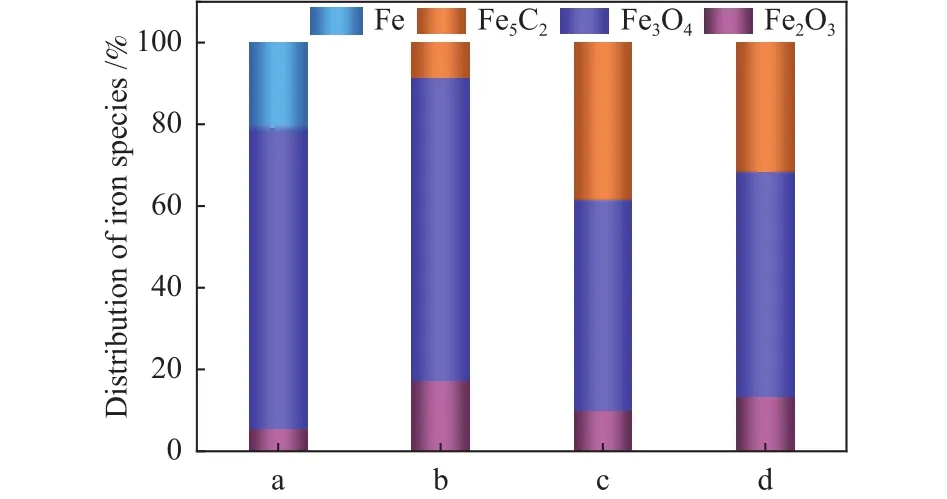
圖7 樣品預處理后鐵物種含量Figure 7 Iron species content of different samples
為了進一步研究催化劑物相在反應中的演變規律,對經合成氣(CO/H2= 1∶2)還原后的1Na-Fe2O3樣品進行了CO2加氫in-situXRD測試,結果見圖8。由圖8可以看出,催化劑樣品在10 h的測試中,主要物相為Fe3O4和Fe5C2且未發生明顯變化,說明催化劑在CO2加氫反應中較為穩定。在Fe基催化劑催化CO2加氫反應中存在多個活性位,一般來說Fe3O4是RWGS反應的活性相,Fe5C2是FTS反應的活性相,兩者比例對CO2催化加氫活性及產物選擇性至關重要。通過in-situXRD和TPSR-MS等原位表征技術,對Fe基催化劑還原、活化及CO2加氫反應時的物相演變過程進行追蹤,結合反應性能評價數據,可以準確構建催化劑結構與性能關系,揭示反應機理。

圖8 1Na-Fe2O3樣品CO2加氫反應原位XRD譜圖Figure 8 In-situ XRD patterns of 1Na-Fe2O3 for CO2 hydrogenation
3 結 論
本實驗研究了不同還原氣氛對助劑Na改性后Fe2O3催化劑物相演變的影響。研究發現,在相同還原條件下,合成氣還原Fe2O3的能力要強于H2,Fe2O3在H2氣氛下的還原過程可概括為Fe2O3→Fe3O4→ Fe;在合成氣(H2/CO = 2)氣氛下的還原及碳化過程可概括為:Fe2O3→ Fe3O4→ Fe5C2。盡管Na助劑的修飾提高了H2氣氛下Fe2O3樣品的還原溫度,但在合成氣氣氛下還原和滲碳反應過程的溫度會降低,并增加Fe5C2物種的含量。實驗表明,對CO2加氫Fe基催化劑進行適當的Na助劑修飾并通過合成氣預處理,可提高催化劑中Fe5C2含量,進而提高CO2轉化率和C5+產物選擇性。

