番茄紅素對人內皮祖細胞增殖、遷移、成管能力的影響觀察及其機制探討
陳俊求,蔡潔娜,劉強,熊龍根
1 廣州醫科大學附屬第二醫院心內科,廣州 510000;2 中國醫學科學院阜外醫院深圳醫院心內科;3 廣東省普寧市人民醫院檢驗科
動脈粥樣硬化(AS)是動脈粥樣硬化性心血管疾病(ASCVD)的病理基礎,對AS 發生發展以及調控機制的研究是心腦血管疾病防治的重要一環。血管內皮細胞功能障礙被認為是AS 發病機制中最重要的事件,因此通過減輕血管內皮損傷來防治ASCVD 是一種可行的策略[1]。內皮細胞功能失穩主要與外周血內皮祖細胞(EPCs)數量減少和功能障礙有關,目前已知氧化型低密度脂蛋白(ox-LDL)通過激活內皮細胞AMP依賴的蛋白激酶(AMPK)—哺乳動物雷帕霉素靶蛋白(mTOR)—自噬促進AS 形成[2-3]。然而,ox-LDL 是否誘導 EPCs 自噬以及誘導EPCs 功能損傷的潛在機制仍知之甚少。番茄紅素(Lyc)是一種天然類胡蘿卜素,具有極強的抗氧化和抗炎作用,對高糖或終末糖基化產物誘導的EPCs損傷具有保護作用,可以通過激活AMPK-mTOR 通路激活自噬[4-7]。2020 年 10 月—2021 年 11 月,我們觀察了 Lyc 對 ox-LDL 誘導的 EPCs 細胞增殖、遷移、成管能力的影響,并探討其可能作用機制。
1 材料與方法
1.1 EPCs及主要試劑、儀器 EPCs:普寧市人民醫院中心實驗室提供的健康志愿者外周血來源單個核細胞體外誘導分化的晚期EPCs。主要試劑:ox-LDL(北京索萊寶,H7950),Lyc(上海源葉生物,S24983-20 mg),內皮細胞培養基(ECM,美國 ScienCell,1001),CCK-8 試劑盒(上海碧云天,C0042),matrigel基質膠(美國 BD,356234),AMPK(Abcam 公司,ab131512),p-AMPK(Abcam 公司,ab23875),mTOR(Abcam 公 司 ,ab32028),p-mTOR(Abcam 公 司 ,ab109268),β-Actin(賽維爾,GB11001),LC3B(Abcam 公司,192890),小分子化合物C(CC)(APExBio,B3252)。主要儀器:細胞生化恒溫孵育箱(美國Thermo,371),Western blot 電泳儀(美國伯樂,1658033),凝膠成像顯影儀(美國Thermo,E-Gel),超凈工作臺(江蘇蘇凈,SW-CJ-iFD),酶標儀(瑞士Tecan,F50)。
1.2 EPCs分組、Lyc給予方法以及細胞增殖活力測算 采用CCK-8 法。將EPCs 接種至96 孔板,每孔3 000細胞,細胞培養24 h。24 h后將細胞分為4組,分別為 A 組、B 組、C 組、空白組(D 組)。A 組加入含10%胎牛血清的培養基和ox-LDL(10 mg/L)的培養基培養24 h 后棄去上清,再加入含10%胎牛血清和 Lyc(10 mg/L)的培養基培養 24 h;B 組加入含10%胎牛血清和ox-LDL(100 mg/L)的培養基培養48 h;C 組加入含 10%胎牛血清和 Lyc(10 mg/L)的培養基培養48 h;D 組細胞加入含10%胎牛血清的培養基培養48 h。細胞處理結束后收集細胞,CCK8試劑盒取出平衡至室溫30 min,每孔加100 μL 的ECM 與CCK8(按1 000∶100 比例)混合液。放回培養箱中孵育1~3 h,利用酶標儀檢測反應液檢測450 nm 處的OD 值,計算細胞增殖活力,細胞增殖活力(%)=(實驗組OD 值-空白組OD 值)/(對照組OD值-空白組OD值)×100%。
1.3 EPCs 分組、Lyc 給予方法以及細胞劃痕愈合率、形成小管直徑測算 分組方法同“1.2”。細胞鋪滿板底后,用1 mL 槍頭垂直于孔板制造細胞劃痕,清洗后加入無血清ECM,鏡下觀察并拍照記錄,放回入培養箱培養,24 h 和48 h 鏡下觀察并拍照記錄,以劃痕愈合率(%)評價遷移能力。細胞成管實驗:預冷 96 孔板,每孔加入 50 μL 的 Matrigel,每孔加入 100 μL 濃度為 4×105/mL 細胞,24 h 和48 h 后鏡下觀察,以形成小管直徑(mm)評價成管能力。
1.4 EPCs分組、Lyc給予方法以及細胞自噬相關蛋白檢測 采用Western blot 法。分組方法同“1.2”。收集EPCs提取蛋白樣品鑒定,電泳、轉膜后予以抗體孵育,本次檢測的主要是自噬接頭蛋白(P62)、微管相關輕鏈蛋白3(LC3)的剪切成分LC3-1、LC3-Ⅱ及自噬相關蛋白Beclin-1和信號通路蛋白(MAPK,mTOR)表達情況,一抗、二抗孵育結束后予以顯影,用image J軟件進行條帶灰度值分析,以β-actin作為內參,并計算目標條帶與β-actin 的比值進行統計學分析。以p-AMPK/AMPK、p-mTOR/mTOR 的比值分別表示AMPK、mTOR蛋白的磷酸化水平,以LC3-Ⅱ/LC3-Ⅰ的比值表示LC3-Ⅱ的表達水平,以ox-LDL+Lyc處理時LC3-Ⅱ的表達水平評估細胞自噬水平。
1.5 EPCs 分組、CC 給予方法以及細胞增殖活力測算 采用CCK-8 法。將EPCs 接種至96 孔板,每孔3 000細胞,細胞培養24 h。24 h后將細胞分為4組,分別為 E 組、F 組、G 組、H 組。E 組首先加入含 10%胎牛血清和CC的培養基溫箱孵育30 min,然后加入含10%胎牛血清和ox-LDL(10 mg/L)的培養基培養24 h 后棄去上清,最后再加入含10%胎牛血清和 Lyc(10 mg/L)的培養基培養 24 h;F 組加入含10%胎牛血清的培養基和ox-LDL(10 mg/L)的培養基培養24 h 后棄去上清,再加入含10%胎牛血清和 Lyc(10 mg/L)的培養基培養 24 h;G 組加入含10%胎牛血清和ox-LDL(100 mg/L)的培養基培養48 h;H 組加入含10%胎牛血清的培養基培養48 h。細胞處理結束后收集細胞,CCK8 試劑盒取出平衡至室溫 30 min,每孔加 100 μL 的 ECM 與 CCK8(按1 000∶100 比例)混合液。放回培養箱中孵育1~3 h,利用酶標儀檢測反應液檢測450 nm 處的OD值,計算細胞增殖活力,細胞增殖活力(%)=(實驗組OD 值-空白組OD 值)/(對照組OD 值-空白組OD值)×100%。
1.6 EPCs 分組、CC 給予方法以及細胞劃痕愈合率、形成小管直徑測算 分組方法同“1.5”。細胞鋪滿板底后,用1 mL 槍頭垂直于孔板制造細胞劃痕,清洗后加入無血清ECM,鏡下觀察并拍照記錄,放回入培養箱培養,24 h和48 h鏡下觀察并拍照記錄,以劃痕愈合率(%)評價遷移能力。細胞成管實驗:預冷 96 孔板,每孔加入 50 μL 的 Matrigel,每孔加入100 μL 濃度為4×105/mL 細胞,24 h和48 h后鏡下觀察,以形成小管直徑(mm)評價成管能力。
1.7 EPCs 分組、CC 給予方法以及細胞自噬相關蛋白檢測 采用Western blot 法。分組方法同“1.5”。收集EPCs 提取蛋白樣品鑒定,電泳、轉膜后予以抗體孵育,本次檢測的主要是自噬相關蛋白Beclin-1、微管相關輕鏈蛋白3(LC3)的剪切成分LC3-Ⅰ和LC3-Ⅱ、自噬接頭蛋白(P62)以及信號通路蛋白(MAPK、mTOR)表達情況,一抗、二抗孵育結束后予以顯影,用image J 軟件進行條帶灰度值分析,以βactin 作為內參,并計算目標條帶與β-actin 的比值進行統計學分析。以p-AMPK/AMPK、p-mTOR/mTOR的比值分別表示AMPK、mTOR 蛋白的磷酸化水平,以LC3-Ⅱ/LC3-Ⅰ的比值表示LC3-Ⅱ的表達水平,以ox-LDL+Lyc 處理時LC3-Ⅱ的表達水平評估細胞自噬水平。
1.8 統計學方法 采用SPSS25.0 和R4.0.2 統計軟件。符合正態分布的計量資料以表示,組間單一協變量間比較采用one-way ANOVA 分析。P<0.05為差異有統計學意義。
2 結果
2.1 各組細胞增殖活力、細胞劃痕愈合率、形成小管直徑比較 細胞增殖活力、細胞劃痕愈合率、形成小管直徑比較見表1。
表1 各組細胞增殖活力、細胞劃痕愈合率、形成小管直徑比較()
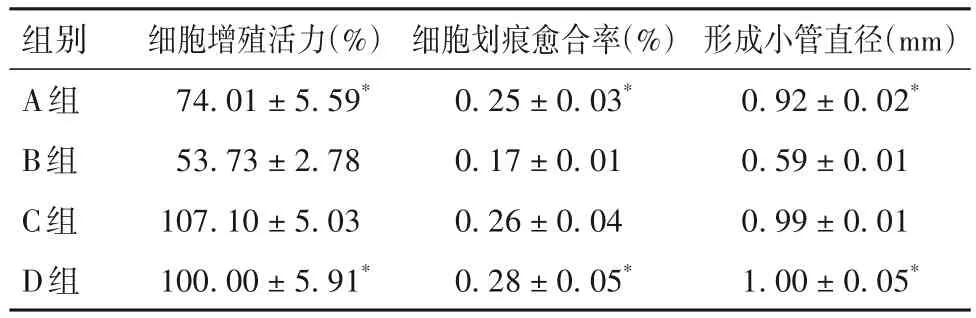
表1 各組細胞增殖活力、細胞劃痕愈合率、形成小管直徑比較()
注:與B組比較,*P<0.05。
組別A組B組C組D組形成小管直徑(mm)0.92±0.02*0.59±0.01 0.99±0.01 1.00±0.05*細胞增殖活力(%)74.01±5.59*53.73±2.78 107.10±5.03 100.00±5.91*細胞劃痕愈合率(%)0.25±0.03*0.17±0.01 0.26±0.04 0.28±0.05*
2.2 各組細胞p62、LC3-Ⅱ、Beclin-1 蛋白相對表達量比較 細胞p62、LC3-Ⅱ、Beclin-1 蛋白相對表達量比較見表2。
表2 各組細胞p62、LC3-Ⅱ、Beclin-1蛋白相對表達量比較()
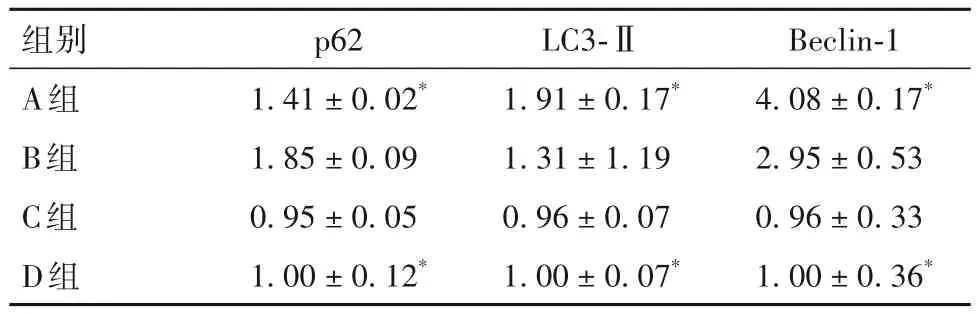
表2 各組細胞p62、LC3-Ⅱ、Beclin-1蛋白相對表達量比較()
注:與B組比較,*P<0.05。
組別A組B組C組D組LC3-Ⅱ1.91±0.17*1.31±1.19 0.96±0.07 1.00±0.07*p62 1.41±0.02*1.85±0.09 0.95±0.05 1.00±0.12*Beclin-1 4.08±0.17*2.95±0.53 0.96±0.33 1.00±0.36*
2.3 各組細胞p-AMPK/AMPK、p-mTOR/mTOR蛋白相對表達量比較 細胞p-AMPK/AMPK、p-mTOR/mTOR蛋白相對表達量比較見表3。
表3 各組細胞p-AMPK/AMPK、p-mTOR/mTOR蛋白相對表達量比較()
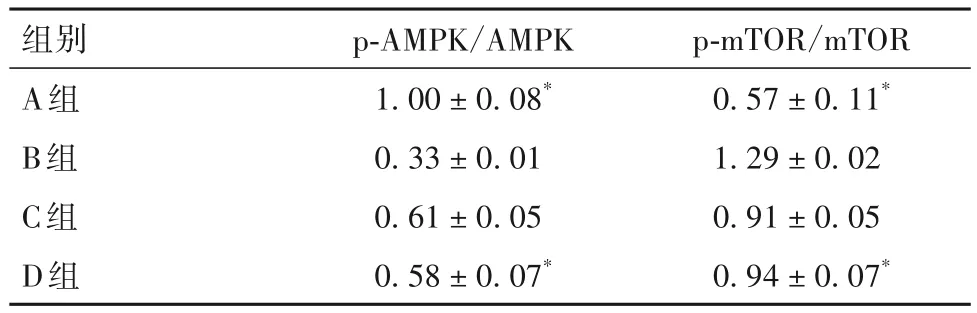
表3 各組細胞p-AMPK/AMPK、p-mTOR/mTOR蛋白相對表達量比較()
注:與B組比較,*P<0.05。
組別A組B組C組D組p-mTOR/mTOR 0.57±0.11*1.29±0.02 0.91±0.05 0.94±0.07*p-AMPK/AMPK 1.00±0.08*0.33±0.01 0.61±0.05 0.58±0.07*
2.4 阻斷AMPK后各組細胞增殖活力、細胞劃痕愈合率、形成小管直徑比較 阻斷AMPK 后細胞增殖活力、細胞劃痕愈合率、形成小管直徑比較見表4。
表4 阻斷AMPK后各組細胞增殖活力、細胞劃痕愈合率、形成小管直徑比較()
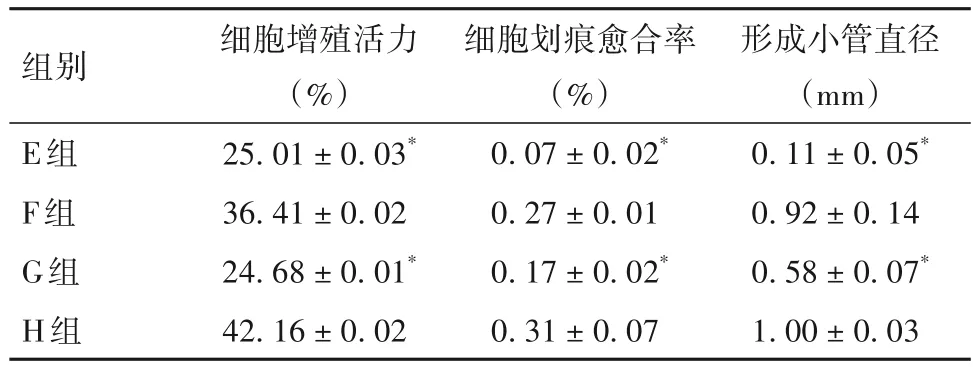
表4 阻斷AMPK后各組細胞增殖活力、細胞劃痕愈合率、形成小管直徑比較()
注:與F組比較,*P<0.05。
組別E組F組G組H組形成小管直徑(mm)0.11±0.05*0.92±0.14 0.58±0.07*1.00±0.03細胞增殖活力(%)25.01±0.03*36.41±0.02 24.68±0.01*42.16±0.02細胞劃痕愈合率(%)0.07±0.02*0.27±0.01 0.17±0.02*0.31±0.07
2.5 阻斷 AMPK 后各組細胞 p62、LC3-Ⅱ、Beclin-1蛋白相對表達量比較 阻斷AMPK 后細胞p62、LC3-Ⅱ、Beclin-1蛋白相對表達量比較見表5。
表5 阻斷AMPK后各組細胞p62、LC3-Ⅱ、Beclin-1蛋白相對表達量比較()
注:與G組比較,*P<0.05。
組別E組F組G組H組Beclin-1 1.26±0.16*0.79±0.18 1.34±0.02 1.00±0.16*p62 1.19±0.08*1.57±0.08 1.15±0.07 1.00±0.24*LC3-Ⅱ1.33±0.13*1.86±0.06 1.41±0.06 1.00±0.06*
3 討論
ASCVD 是全球范圍內最主要的血管疾病,AS是其病理基礎。雖然抗動脈硬化治療的進步已經使心臟病和腦卒中的病死率顯著下降,但是全球疾病負擔研究顯示,這種下降在低收入或中等收入國家呈現非可持續性[8]。目前,心腦血管病死率的下降主要是腦卒中病死率下降,而ASCVD 的病死率下降幅度并不大,甚至在亞洲某些國家,報告的ASCVD病死率甚至有所上升趨勢[9],《中國心血管健康與疾病報告2020 概要》指出我國心血管疾病已超過腫瘤性疾病成為我國城鄉居民總體死亡原因的首位病因,報告推算我國冠心病的現患病人數約為1 100萬,我國心血管疾病患病人數總體上仍呈現上升趨勢[10],因此對AS發生發展以及調控機制的研究和探索是心腦血管疾病防治的重要一環。
AS 的始動因素包括低密度脂蛋白膽固醇(LDL)、炎癥以及內皮細胞損傷:動脈長期累積暴露于LDL 仍然是AS 發生和進展的主要決定因素,ox-LDL 是促動 AS 的關鍵[11],同時 ox-LDL 顆粒的成分會誘發炎癥并提供適應性免疫的新表位,炎癥反過來又可以以驅動AS 的方式改變動脈壁細胞的功能。ox-LDL 處理巨噬細胞或內皮細胞可以激活NLRP3炎癥小體,隨后導致巨噬細胞或內皮細胞IL-1β的分泌,而下調NLRP3 炎癥小體可提高內皮細胞功能和巨噬細胞存活,從而抑制AS[3]。這些經由危險因素或疾病介導的系統性全身炎癥以及血管壁細胞功能損傷引起的局部炎癥(例如損傷的血管內皮細胞激活內膜細胞釋放炎癥細胞因子的炎癥過程)均會釋放可溶性炎癥介質,進而觸發以及加速AS的過程[12]。除了脂質學說和炎性學說,早在 1993 年,血管內皮細胞功能障礙就被認為是心血管疾病發病機制中最重要的事件[13]:內皮細胞暴露于導致AS的風險因素后出現內皮細胞功能障礙從而導致脂質沉積、免疫炎癥細胞浸潤,血管內皮損傷被認為是AS的始動環節,因此通過減輕血管內皮損傷來防治AS是一種可行的策略,而內皮細胞功能失穩則主要與外周血 EPCs 數量減少和功能障礙有關[2]。EPCs 是在血液中循環的單核細胞,來自不同的組織,表達類似于成熟內皮細胞的細胞表面標志物。EPCs 的發現為血管修復和AS 帶來了新的方向,也為動AS 的血管穩態修復提供了新的理論。來自骨髓和其他一些器官的EPCs 通過遷移到遠處的血管來幫助血管修復,在那里它們分化為成熟的內皮細胞并替換舊的和受損的內皮細胞。EPCs 修復血管損傷的能力則取決于它們的數量和功能[14],因此如何通過減少危險因素對于EPCs 損傷進而維護血管內皮細胞的功能穩態免于ox-LDL 和炎癥的損傷是預防AS 這一病理過程的關鍵步驟之一。
Lyc 是一種天然類胡蘿卜素,具有極強的抗氧化和抗炎作用,能預防心血管疾病,包括高血脂與AS[15]。已有研究[5-6]報道,Lyc 對高糖或糖基化終產物誘導的EPCs損傷具有保護作用。Lyc可以通過激活AMPK活性抑制炎癥[16]和激活自噬[17]。值得注意關注的是AMPK激活可在冠心病、糖尿病心肌病、腦卒中等病理過程中減弱NLRP3 炎性小體的上調[18-19]。既往研究表明,AMPK/mTOR 信號通路激活自噬下調NLRP3炎性小體[20-23]。然而,Lyc是否對ox-LDL 誘導的EPCs 損傷具有保護作用及其調控機制尚未明確。因此,在本研究擬在體外研究Lyc 對ox-LDL 誘導EPCs 的自噬信號的影響,并進一步探討了Lyc 參與AMPK/mTOR 信號通路的潛在機制,為Lyc 治療AS 的機制提供了新的見解。本研究在細胞水平上揭示Lyc對ox-LDL誘導的EPCs增殖、遷移和成管能力的保護作用:在我們用ox-LDL 誘導刺激EPCs 后出現了EPCs 細胞增殖能力的下降,遷移能力和成管能力的減退,而在補充Lyc 干預后,這種損傷能夠得到很大程度上的改善,表現為EPCs增殖活力的增加,細胞劃痕愈合率增加,小管平均長度的增加,進一步的研究提示這種功能保護作用可能與Lyc 激活AMPK-mTOR-自噬通路有關,在我們加入AMPK 磷酸化激活的阻斷劑CC 后進一步驗證AMPK 磷酸化激活是Lyc 發揮保護作用的關鍵信號分子,而AMPK 磷酸化介導的自噬是Lyc 發揮保護作用的關鍵通路。EPCs 功能障礙在ox-LDL 誘導的AS發病機制中起關鍵作用,大量研究應用于尋找改善EPCs功能的解決方案[24]。抗炎藥、抗高血壓藥以及補充維生素D都被認為是治療策略[25]。最近越來越多的研究注目于天然藥物及其單體化合物,如丹參酮ⅡA、柴胡皂苷A 以及淫羊藿苷等均被報道改善內皮功能[26-27]。Lyc 是一種四萜類胡蘿卜素,廣泛存在紅色水果中,Lyc 特殊的化學結構(11 個共軛雙鍵)決定了其具有猝滅單線態氧、清除自由基、抑制脂質過氧化等多種生理功能活性[28],因而被認為有光明的應用前景。在既往研究中已經報道過Lyc 對高糖誘導的EPCs損傷具有保護作用[29],在此我們則首次描述了Lyc 對ox-LDL 誘導的EPCs 損傷保護作用,具體表現為ox-LDL 誘導的EPCs 的增殖、遷移和成管能力的改善,并觀察到Lyc 對ox-LDL 誘導EPCs自噬流的強化。
為了探究Lyc 如何在EPCs 中發揮其保護作用,我們測試了Lyc 在ox-LDL 刺激下對EPCs 中自噬信號蛋白表達的影響。自噬與心血管疾病密切相關,目前觀察自噬主要通過透射電鏡直接觀察自噬小體形成來判斷自噬,或者通過檢測標記自噬過程中的標記蛋白。在我們的結果中顯示100 mg/L ox-LDL可以誘導EPCs自噬,伴有自噬過程中關鍵信號蛋白p62、LC3-Ⅱ、Beclin-1 的表達差異。但自噬作為“雙刃劍”在ox-LDL 的作用下伴隨著EPCs 分化功能受損,在不利的條件下表現為負性的調控作用,而在Lyc 作用下自噬信號顯著增強反而伴隨著EPCs功能改善,這可能是因為控制自噬小體成熟的機制是動態調節的,以允許自噬通量適應細胞的需要,并使自噬降解與外部輸入整合,也可能存在與其他程序性死亡信號串擾可能。自噬是細胞程序性死亡方式[2],對程序性死亡方式的調控是恢復EPCs 功能穩態對抗AS進程的重要方式,既往研究已經報道過調控 EPCs 凋亡[2],自噬[30]改善其功能,而本實驗首次報道采用Lyc 干預ox-LDL 誘導的EPCs 呈現自噬活性的增強,且提高了細胞增殖活力伴細胞功能的改善,因此,Lyc 的這種保護作用可能也是通過經典信號調節通路調控程序性死亡方式來實現的,同時,Lyc 調控ox-LDL 誘導的EPCs 自噬以維持內皮穩態是防治AS的一種可行方法。既往研究表明,自噬過程受 mTOR 和 AMPK[31]兩個傳感器嚴格調節,AMPK-mTOR-自噬信號軸的反饋回路保證了適當的反應機制。在本次實驗中,ox-LDL 誘導的EPCs 自噬伴隨AMPK 磷酸化活性增加并抑制mTOR 磷酸化,而予以Lyc干預后則表現p-AMPK表達進一步增高,p-mTOR 表達水平進一步降低,值得注意的是EPCs僅在Lyc的作用下同樣伴隨AMPK磷酸化活性增加,加入CC 后逆轉自噬強化且伴有EPCs 功能損傷,我們的研究結果和前人的研究均確認Lyc 為AMPK的激活劑[17,32],可以直接激活或強化自噬信號。
總之,Lyc可以有效保護EPCs的增殖、遷移和成管功能,上調細胞的自噬水平,作用機制可能是通過AMPK 磷酸化激活有關,此為Lyc 抗AS 的機制提供了新的思路。

