新型鴨呼腸孤病毒的分離鑒定及板藍根合劑的預防效果評價
朱明恩,王光鋒,提金鳳,李 舫,李汝春,孫秋艷
(山東畜牧獸醫職業學院/山東省畜禽抗菌藥使用減量化工程技術研究中心/山東省現代農業產業技術體系創新團隊,山東 濰坊 261061)
新型鴨呼腸孤病毒(Novel duck reovirus,NDRV)主要引起雛鴨肝臟和脾臟的出血性壞死,臨床上也稱之為“鴨新肝病” “鴨白點病” “鴨脾壞死病”等[1],后統稱“新型鴨呼腸孤病毒病”,其在血清學、基因型、抗原性、致病性等方面均不同于經典番鴨呼腸孤病毒(Muscovy duck reovirus,MDRV)。新型鴨呼腸孤病毒病一般分為鴨出血性壞死性肝炎和鴨脾壞死病兩類,鴨出血性壞死性肝炎與感染 MDRV的患鴨臨床癥狀相似,但 MDRV對北京鴨無感染性;而鴨脾壞死病的主要病變在脾臟,與感染 MDRV的患鴨發病時期不同,脾臟病變亦存在著一定差異[2]。該病最初在 2005年的福建、廣東和浙江等地區陸續開始出現,進而快速的傳遍了中國主要的鴨生產地,現在已經成為一種鴨的常見病和多發病[3]。該病在一年四季均有發生,且櫻桃谷鴨、麻鴨、番鴨、半番鴨等多種品種的鴨都可發病,發病日齡一般為 5~25 d,其發病率為 5 %~35 %,死亡率為 2 %~20 %。一般來說,鴨的日齡越小,其發病率和死亡率越高。此外,隨著天氣越加寒冷,該病的發病率和死亡率也隨之增加[3-6]。該病毒可引起鴨脾臟壞死等病理性損傷,從而導致機體免疫抑制,進而更容易引起細菌的繼發性感染[3,7,8]。近年來,NDRV在全國各地大面積流行,其作為鴨養殖地區流行的一種危害嚴重的傳染病,給養鴨業造成了不可估量的經濟損失。
NDRV的基因組分為L、M和S三類基因片段。其中,L由 L1、L2、L3三條大片段組成,M 由 M1、M2、M3三條中片段組成,S則由S1、S2、S3、S4四條小片段組成。基因組可編碼至少14個蛋白(10個結構蛋白和4個非結構蛋白),其中 S1片段中的 σC蛋白是構成病毒外衣殼的重要組成成分,其主要功能是吸附細胞和產生新型特異性中和抗體,是NDRV重要的免疫原性蛋白[9-11]。此外,σC蛋白不僅是禽呼腸孤病毒編碼蛋白中最容易變異的蛋白,也是鴨呼腸孤病毒同源性及遺傳進化分析的重要參考依據[12-14]。本研究從山東多個地區的疑似呼腸孤病毒感染的鴨病料中分離鑒定出 5株 NDRV,并針對其 σC基因進行測序分析,進一步進行同源性及遺傳進化分析,以探究不同地區分離株的生物學特性差異。板藍根是常用的清熱解毒中藥,在防治各種病毒感染性疾病中發揮著重要作用。本研究利用5株分離株對板藍根合劑藥物對新型鴨呼腸孤病毒病的防治效果進行的評價,以探究板藍根等藥物對新型鴨呼腸孤病毒病的防治效果,為該病的治療和防控提供新的參考依據。
1 材料和方法
1.1 材料
1.1.1 病料樣品和實驗動物 疑似感染鴨呼腸孤病毒病料分別采自山東高唐、商河、新泰、濰坊、莘縣 5個地區的鴨場,10日齡 SPF鴨胚購自山東濰坊地區某孵化場,7日齡雛鴨購自山東臨沂某孵化場。
1.1.2 主要儀器和試劑 PCR儀購自美國 Bio-Rad公司,凝膠成像設備購自美國 Bio-Rad公司,均由學院動物疫病檢測中心提供;HiScript II One Step RT-PCR Kit購自南京諾唯贊生物科技有限公司。
1.2 方法
1.2.1 樣品處理 取適量疑似病鴨的壞死脾臟,用無菌剪刀剪碎后按照 1:5比例加入 PBS,用無菌的研磨器進行研磨處理,將研磨好的組織勻漿轉移至無菌5 ml離心管中,置于-20 ℃ 反復凍融3次,6 000 rpm離心5 min,取上清液備用。
1.2.2 病毒分離培養 將 1.2.1中獲取的上清液用 0.22 μm 濾器進行過濾除菌,然后按照每個鴨胚0.2 ml的劑量,將其接種于10日齡SPF鴨胚中,每個樣品分別接種 5個鴨胚。此外,用無菌PBS溶液接種5個鴨胚作為陰性對照。將所有鴨胚置于 37 ℃ 恒溫箱中孵育培養,時刻觀察鴨胚的狀態,將24 h內死亡的鴨胚棄掉,無菌操作收集72 h內死亡的鴨胚及其尿囊液。將尿囊液按照上述方法接種于新的 SPF鴨胚中,連續傳代 3次,無菌收集第3代鴨胚的尿囊液備用。
1.2.3 RNA提取及 PCR鑒定 采用 Trizol法對1.2.2中第3代鴨胚的尿囊液樣品進行RNA的提取,利用HiScript II One Step RT-PCR Kit試劑盒按照說明書對鴨呼腸孤病毒 σC基因序列進行PCR擴增。上游引物為P1: 5'-ATGATGGATCGC AACGAGGCG-3',下游引物為 P2: 5'-GGCGAAT AGCTCTTCTCATTAC-3'[15]。RT-PCR 反應條件:50 ℃ 30 min,94 ℃ 3 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35 個循環;72 ℃5 min,PCR產物進行 1 % 瓊脂糖凝膠電泳檢測。將PCR陽性產物送至北京擎科生物科技有限公司進行測序,測序引物為本研究使用的 P1和P2引物。
1.2.4 測序結果分析 首先使用 Chromas軟件對雙向測序結果進行拼接和校對,并在線與GenBank數據庫進行 Blast分析,根據同源性來初步鑒定毒株;利用DNAStar軟件對病毒分離株σC蛋白的核苷酸和氨基酸序列分別進行同源性分析;利用 MEGA7軟件對病毒分離株 σC蛋白的核苷酸序列進行進化樹分析。同源性分析和進化樹分析參考序列如下:NDRV-SY(MK 955827.1)、NDRV-SDLY18(MN 064706.1)、NDRV-SDHZYC(MK789277.1)、MDRV-ZJ99(DQ 643970.1)、MDRV-C4(DQ 066924.1)、MDRV-S12(DQ643970.1)、ARV-DVB03(KX 901897.1)、ARV-XY01(KX 451229.1)、ARVS1133(KF741762.1)。
1.2.5 病毒感染雛鴨的致病性試驗 將 5株病毒分離株感染的第 3代的鴨胚尿囊液通過肌肉注射方式分別攻毒 10只 7日齡健康雛鴨(1.0 ml/只),另外取 10只健康雛鴨注射等體積無菌PBS,作為對照組。攻毒后每日觀察記錄雛鴨的發病和死亡情況。在第 7天處死所有雛鴨,觀察記錄肝臟病變情況。
1.2.6 板藍根合劑對新型鴨呼腸孤病毒防治效果評價 自制板藍根合劑配方:黃芪 30 g,板藍根、大青葉、貫眾、黃柏、茜草各 15 g,蒼術12 g,丹皮、澤瀉各 10 g,甘草 3 g。選取 40只7日齡健康雛鴨,隨機分為4個組(10只/組),1組和 2組飲用水中添加自制板藍根合劑(板藍根合劑 50 ml + 水 1 000 ml),30 ml/只,1 劑/d。3組和 4組飲用水中不添加藥物。連續喂藥 7 d后,按照 1.2.4中的方法對 2組和 3組進行攻毒,試驗動物具體分組情況見表 1。每日觀察記錄雛鴨的發病和死亡情況,第 7天處死所有雛鴨,觀察記錄肝臟病變情況。

表1 試驗動物分組信息
2 結果與分析
2.1 病毒分離培養
SPF鴨胚接種樣本上清液后,自第 3代開始,鴨胚的死亡時間和剖檢病變趨于穩定。鴨胚的死亡時間主要集中在 48~72 h之間,且第3代的鴨胚死亡率達到了 100 %。不同時間點死亡的鴨胚均出現全身性的出血以及水腫。48 h死亡鴨胚和72 h死亡鴨胚的病變情況如圖1所示。

圖1 攻毒鴨胚的病變情況
2.2 病毒的分子生物學鑒定分析
對接種第 3代的鴨胚尿囊液進行 RNA的提取,并以此為模板進行 RT-PCR的檢測,5個待測樣品分別命名為 GT-1,SH-2,XT-3,WF-4,SX-5,RT-PCR檢測的凝膠電泳結果如圖 2所示,5個樣品均擴增出 1000 bp左右的特異性條帶,條帶大小與預期的σC基因大小相一致。
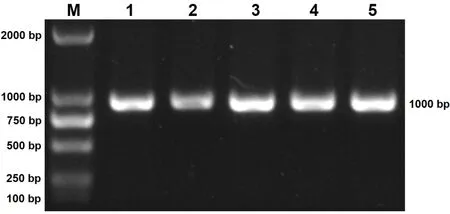
圖2 5個分離株σC基因的RT-PCR擴增結果
2.3 分離株σC序列的同源性分析
使用DNAStar軟件,根據5個分離株的PCR陽性產物測序結果,將其與 GenBank中發布的NDRV-SY(MK955827.1)、NDRV-SDLY18(MN 064706.1)和NDRV-SDHZYC(MK789277.1)的σC核苷酸序列以及氨基酸序列分別進行同源性分析,結果如表 2所示。5個分離株 σC基因的核苷酸和氨基酸同源性分別為 95.2 % ~ 99.6 %和 94.4 % ~ 99.7 %;而 5個分離株與其它 3個NDRV分離株的 σC基因的核苷酸和氨基酸同源性分別為96.9 % ~ 98.6 %和94.1 % ~ 99.4 %。

表2 分離株與NDRV的σC蛋白核苷酸和氨基酸同源性分析
2.4 分離株σC序列的系統進化樹分析
根據 σC基因核苷酸序列的遺傳進化樹(圖3)發現,5個分離株與 NDRV毒株構成一個獨立的進化分支,其中GT-1和SH-2以及XT-3和SX-5的遺傳距離較近,分別位于一個小分支,而WF-4則與其它 4株的遺傳距離相對較遠;番鴨呼腸孤病毒(Muscovy duck reovirus, MDRV)代表株(MDRV-ZJ99、MDRV-S12和 MDRV-C4)和禽呼腸孤病毒(Avian reovirus, ARV)代表株(ARV-S1133、ARV-DVB03、ARV-XY01)也分別形成一個進化分支。而 NDRV分支與MDRV、ARV分支親緣關系都相對較遠。

圖3 NDRV分離株σC基因序列進化樹分析
2.5 病毒致病性分析
將5個病毒分離株各攻毒5只健康7日齡雛鴨,攻毒后觀察雛鴨的發病情況。攻毒雛鴨在24 h后開始發病,表現為精神沉郁,食欲不振。攻毒 7 d后,頸靜脈放血處死所有雛鴨,剖檢并觀察肝臟病理變化,如圖 4所示,與對照組相比,5株分離株感染雛鴨的肝臟均出現不同程度的腫大和出血。如圖 5所示,與對照組相比,5株分離株感染雛鴨的脾臟出現不同程度的出血和壞死。

圖4 NDRV分離株感染雛鴨的肝臟病變

圖5 NDRV分離株感染雛鴨的脾臟病變
2.6 板藍根合劑對新型鴨呼腸孤病毒防治效果評價
板藍根防治效果評價試驗共分為 4組:1組(板藍根組),2組(板藍根-攻毒組),3組(攻毒組),4組(空白對照組),每組10只雛鴨。攻毒后每日觀察記錄雛鴨狀態,在攻毒 7 d后,將所有雛鴨處死,剖檢并觀察肝臟病理變化,統計各組的發病雛鴨的數目。各組肝臟病變及發病情況統計結果如表 3所示,各組肝臟病理變化如圖6所示。結果顯示,板藍根-攻毒組的發病率只有10 %,而攻毒組的發病率為 100 %,且肝臟病理結果表明在攻毒 7 d后,攻毒組雛鴨肝臟均有明顯的出血現象,而板藍根的使用明顯減弱了攻毒帶來的肝臟病變情況(圖6)。
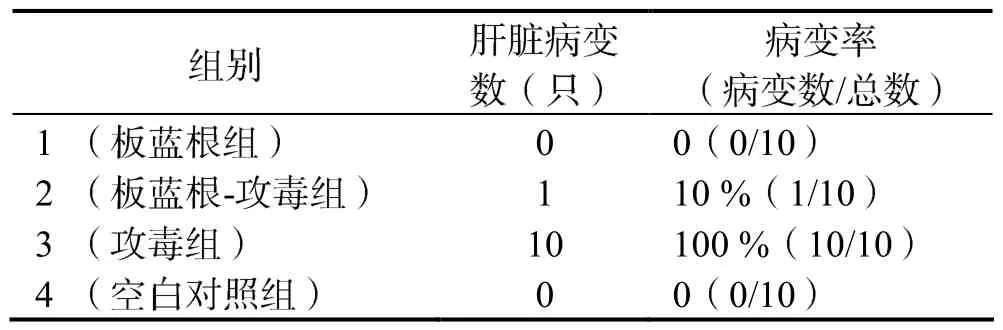
表3 各組雛鴨肝臟病變及發病情況統計結果
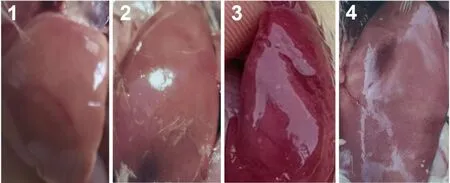
圖6 板藍根合劑使用后NDRV分離株感染雛鴨的肝臟病變
3 討論
目前,新型鴨呼腸孤病毒病已經成為鴨的一種常見病,該病主要導致雛鴨的肝臟和脾臟出血以及壞死,其死亡率并不高,但是其可引起脾臟壞死和免疫抑制,進而可造成嚴重的繼發性感染和生長遲緩等。此外,NDRV可以進行垂直傳播,當種鴨感染NDRV時,其很容易引起后代的大面積快速傳播[16]。因此,NDRV感染在實際生產中的防控非常困難。近年來,NDRV由于其高致病性和廣泛的宿主范圍,對養鴨產業造成了嚴重的危害,現在急需開發更有效的藥物和疫苗來防控NDRV感染[17]。
2011年該病在山東地區開始流行傳播,近年來NDRV的報道逐漸增多,其作為鴨養殖地區流行的一種危害嚴重的傳染病,給山東地區養鴨業造成了不可估量的經濟損失[14]。為了進一步明確山東地區NDRV的分布特征、致病性以及變異情況。筆者分別從高唐、商河、新泰、濰坊、莘縣地區收集并成功獲取 5個分離株,并對其進行了同源性以及遺傳進化分析。結果顯示,本研究分離得到的5株毒株來均自不同地區,且與NDRV參考株的 σC基因的核苷酸和氨基酸同源性很高,這不僅支持了5個毒株屬于NDRV的觀點,也證實了NDRV在山東地區的廣泛流行。此外,5株分離株的系統進化樹分析結果顯示 5個分離株與 NDRV共同構成同一遺傳分支,而與MDRV和 ARV的遺傳關系都相對較遠。這也再次說明了本研究鑒定的 5個分離株均屬于NDRV。分離株接種鴨胚試驗結果顯示,5株NDRV連續接種3代之后,鴨胚的死亡時間和剖檢病變趨于穩定。這些毒株均能致死鴨胚,且鴨胚的死亡時間主要集中于在 48~72 h之間,第 3代的鴨胚死亡率達到了100 %。48 h和72 h時間點死亡的鴨胚均出現全身性的出血以及水腫。此外,病毒感染雛鴨后24 h均引起雛鴨的精神沉郁、食欲不振等癥狀,病毒感染 7 d后發病率 100 %,且感染雛鴨的肝臟均出現不同程度的腫大和出血現象。上述結果顯示這些毒株與已報道的其他NDRV感染鴨胚時的致病特征基本相一致[14-15]。
板藍根是常用的清熱解毒中藥,多糖作為板藍根的主要成分,抗病毒效果顯著且應用范圍廣泛,板藍根多糖既可以直接作用于病毒及其感染過程,在病毒感染細胞初期起到阻斷及抑制作用,又可在感染病毒后,以多種途徑參與機體免疫調節,間接地起到抗病毒作用。板藍根多糖對多種病毒具有較好的阻斷及抑制作用,在我國已有悠久的應用歷史[18-19],在獸醫臨床上也被廣泛應用[20-21]。本研究利用NDRV構建了雛鴨的動物感染模型,對板藍根合劑的預防效果進行了分析評價。研究發現,NDRV攻毒雛鴨 7 d后,雛鴨的發病率為 100 %,且雛鴨肝臟均有出血等明顯的病理變化。板藍根合劑使用后再進行攻毒,攻毒7 d后雛鴨的發病率僅為10 %,顯著低于攻毒組。與對照組相比,肝臟也沒有明顯的出血現象。上述結果揭示了本研究制備的板藍根合劑對新型鴨呼腸孤病毒病具有良好的預防效果,能夠有效抵抗NDRV的感染。
綜上所述,本研究從山東不同地區分離鑒定出 5株 NDRV,其 σC蛋白基因序列與其他NDRV具有很高的同源性,其致病性并未發生明顯的變化。進一步研究發現自制板藍根合劑在對抗NDRV時具有良好的預防效果,這不僅為鴨呼腸孤病毒病藥物研發上提供了新的思路,也為未來新型鴨呼腸孤病毒病的防控提供了重要的理論基礎。

