長梗秦艽酮、微小RNA-495-3p質粒對腎癌細胞增殖、侵襲、凋亡及順鉑敏感性的影響及協同作用
勞萬生, 范麗霞, 李翠君
(佛山市第五人民醫院,廣東佛山 528211)
腎細胞癌(renal cell carcinoma,簡稱腎癌),是泌尿系統常見的惡性腫瘤,好發于腎實質腎小管上皮[1]。目前,臨床治療早期腎癌以手術切除為主,晚期以內科治療為主,雖然均對腎癌有一定的療效,但復發和轉移的風險極高,且一部分腎癌患者對化療不敏感[2-3]。因此,尋找臨床綜合有效的治療方法具有重要的研究意義。中藥因副作用小、不易耐藥等優勢越來越受到腫瘤醫學界的關注[4]。長梗秦艽(Gentiana wahoniiBurkill.)為龍膽科龍膽屬植物,其根可作為秦艽的代用品,主要用于治療風濕性關節炎及肝膽疾病等[5]。長梗秦艽酮(waltonitone)是從長梗秦艽中分離得到的一個新的烏蘇烷型五環三萜化合物[6],具有顯著的體外抗腫瘤活性,對肝癌、宮頸癌、原位胰腺癌、人胰腺導管上皮癌等癌細胞增殖均有抑制作用,可有效調控腫瘤細胞的增殖、細胞周期阻滯、細胞凋亡等過程[7-8],但對腎癌的治療作用及機制尚不清楚。有研究發現,微小RNA(miR)是一種內源性非編碼RNA,在個體發育,細胞的分化、增殖、凋亡等生理活動中以及在腫瘤的發生、發展等病理過程中起重要的調控作用,與腫瘤耐藥性關系密切[9-10]。miR-495-3p是一種多功能mRNA,研究表明,透明腎細胞癌組織中miR-495-3p表達顯著低于正常腎組織[11]。本研究旨在探究長梗秦艽酮能否通過協同miR-495-3p,進而調控腎癌細胞的生物學活性及順鉑敏感性,以期為腎癌臨床治療提供新的治療策略,現將研究結果報道如下。
1 材料與方法
1.1細胞
人腎癌caki-1細胞株,購自于中科院上海細胞庫。細胞貼壁生長,2~3 d傳代1次,取處于對數生長期的細胞用于實驗。本實驗取3~5代細胞。
1.2動物
4周齡雄性高度免疫缺陷NOD-SCID-IL-2Rγnull(NSG)小鼠40只,體質量18~21 g,購自北京維通利華實驗動物有限公司,動物生產許可證號:SCXK(京)2012-0001。全部小鼠均飼養在無特殊病原(SPF)環境中。動物實驗經佛山市第五人民醫院實驗動物福利倫理委員會批準。
1.3藥物及制備
長梗秦艽酮(分子式:C30H48O2;分子量:440.7),其化學結構式如圖1所示,由上海中醫藥大學中藥研究所提供,純度95%以上。將長梗秦艽酮溶解于二甲基亞砜(DMSO)中,配制成濃度為400 mmol/L的溶液備用,進行后續實驗時再稀釋成所需的濃度。

圖1 長梗秦艽酮的化學結構式Figure 1 Chemical structural formula of waltonitone
1.4試劑與儀器
miR-495-3p質粒(mimics)及其陰性對照質粒(miR-negative control mimics,miR-NC)(中國百奧邁科生物技術有限公司);轉染試劑、Transwell小室(中國賽默飛世爾科技公司);膜聯蛋白V-異硫氰酸熒光素(Annexin V-FITC)標記液、碘化丙 啶(PI)、LipofectamineTM2000轉 染 試 劑、LipofectamineTM3000轉染試劑盒(中國上海雅吉生物科技有限公司);細胞計數試劑盒8(CCK-8)(中國東仁化學科技有限公司)。CO2培養箱(美國Thermo公司);高速冷凍離心機(美國Tomy kogyo有限公司);PCR儀(中國上海賽默生物科技發展有限公司)。
1.5體外研究
1.5.1 細胞轉染
轉染前1 d換液,取處于對數生長期的細胞接種于6孔板,3×105個/孔,待細胞長滿約80%時進行miR-495-3p質粒或miR-NC質粒轉染,具體步驟按LipofectamineTM2000試劑說明書進行。熒光顯微鏡下觀察轉染情況,應用實時定量聚合酶鏈反應(qRT-PCR)法檢測是否轉染成功。
1.5.2 細胞分組
將培養后的細胞分為空白組,長梗秦艽酮低、中、高劑量組,miR-NC組,miR-495-3p組。空白組:將腎癌caki-1細胞培養于含10%胎牛血清的RPMI 1640培養基中;長梗秦艽酮低、中、高劑量組:將腎癌caki-1細胞培養于含10%胎牛血清的RPMI 1640培養基中,分別對應加入10、50、250 μmol/L長梗秦艽酮共同培養;miRNC組:腎癌caki-1細胞轉染miR-NC質粒;miR-495-3p組:作為轉染組,腎癌caki-1細胞轉染miR-495-3p質粒。
1.5.3 CCK-8法檢測順鉑誘導caki-1細胞活力和半數抑制濃度(50%inhibition concentration,IC50)
將各組caki-1細胞以1×106個/孔的密度接種于96孔培養板中,每孔200 μL。分別向培養基中加入7個不同濃度梯度(0、1、2、4、8、16、32 μmol/L)的順鉑。在24、48、72 h時分別加入CCK-8溶液,37℃、5%CO2培養箱中孵育2 h,用酶標儀于450 nm波長處測定各孔吸光度(OD)值,并計算細胞的IC50值。取3次實驗的平均值。
1.5.4 Annexin V-FITC/PI法檢測caki-1細胞凋亡
將caki-1細胞用2.5 g/L胰酶消化,制備成密度為1×106個/mL的細胞懸液,用PBS洗滌2次,換用DMEM培養基培養24 h,觀察細胞的生長狀態,生長狀態良好后將細胞收集到離心管中,加入400 μL Binding Buffer緩沖液,細胞重懸,再加入5 μL Annexin V-FITC標記液和5 μL PI,在避光的室溫中孵育15 min,然后冰浴5 min,最后應用流式細胞儀進行檢測。
1.5.5 Transwell實驗測定caki-1細胞侵襲能力
在Transwell上下室之間鋪墊聚碳酸酯的微孔濾膜,濾膜上包被人工基底膜膠。用不含胎牛血清的RPMI 1640培養基調整細胞濃度為5×104個/mL,制成細胞懸液。Transwell上室加入100 μL細胞懸液,下室加入含10%胎牛血清的RPMI 1640培養基500 μL,置于37℃、5%CO2的濕化培養箱中培養24 h。取出細胞并刮除濾膜上室面的細胞,用PBS小心沖洗小室上下面,以40 g/L多聚甲醛溶液固定侵襲或粘附到下室面的細胞30 min,結晶紫染色10 min,PBS沖洗小室,干燥后于200倍光學顯微鏡下隨機選取5個視野計數小室下室面的細胞。
1.5.6 qRT-PCR法檢測caki-1細胞中miR-495-3p和XIAP mRNA表達
取各組caki-1細胞,裂解細胞后提取總RNA,逆轉錄成cDNA,在PCR儀上檢測miR-495-3p(內參為U6)和XIAP(內參為GAPDH)的表達情況。反應條件:95℃預變性30 s;95℃變性5 s,64℃退火34 s,共40個循環。最后用2-△△Ct法計算目的基因的表達結果。miR-495-3p上游引物序列為5’-GGGGAAACAAACATGGTGCAC-3’,下游引物序列為5’-CAGTGCGTGTCGTGGAGT-3’,擴增片段為200 bp;U6上游引物序列為5’-CTCG CTTCGGCAGCACA-3’,下游引物序列為5’-AAC GCTTCACGAATTTGCGT-3’,擴增片段為94 bp;XIAP上游引物序列為5’-CATCCATGGCAGATTAT GAAGCA-3’,下游引物序列為5’-CTTCACTGGG CTTCCAATCAGTTAG-3’,擴增片段為202 bp;GAPDH上游引物序列為5’-GCACCGTCAAGGCTG AGAAC-3’,下游引物序列為5’-TGGTGAAGACG CCAGTGGA-3’,擴增片段為132 bp。
1.5.7 雙熒光素酶報告基因靶基因熒光檢測
利用生物信息學軟件(Target Scan 7.1),預測miR-495-3p調控XIAP基因結合序列,設計合成XIAP 3’-UTR序列及突變后XIAP 3’-UTR序列。將合成的2種目的基因片段分別克隆到pmir GLO熒光素酶報告基因載體,構建XIAP 3’-UTR雙熒光素酶報告基因載體(pmir-GLO-wt-XIAP)及其突變型載體(pmir GLO-mut-XIAP)。
使用LipofectamineTM3000分別將這2種重組載體質粒與miR-495-3p質粒或miR-NC質粒(miR-495-3p陰性對照)共同轉染至caki-1細胞。轉染48 h后,檢測熒光素酶活性。實驗重復5次。轉染分組如表1。
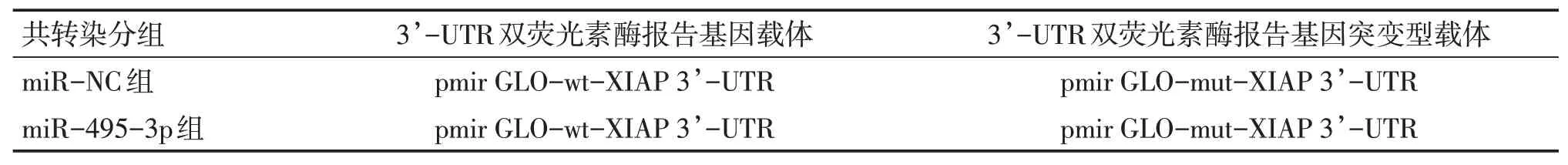
表1 共轉染分組Table 1 Co-transfection groupings
1.6體內研究
1.6.1 分組、造模與給藥
構建NSG小鼠腎癌移植瘤模型方法:取處于對數生長期的人腎癌caki-1細胞,調整細胞密度為1×106個/mL,無菌條件下接種于NSG小鼠前肢腋部皮下。在接種前1 d,對NSG小鼠進行250 cGy輻射。接種前通過細胞計數板對細胞懸液進行計數,接種時確保細胞懸液物無外滲,以確保每只小鼠成瘤。接種后隔天觀察小鼠,用游標卡尺測量小鼠腫瘤體積,40只小鼠約10 d均成瘤,待腫瘤增長到1 000~2 000 mm3時進行后續實驗。將40只NSG小鼠按照隨機數字表分為4組,即陰性組、轉染組、藥物組、聯合組,每組10只。藥物組:小鼠前肢腋部皮下注射腎癌caki-1細胞1×106個/mL,灌胃30 mg/kg長梗秦艽酮[12];陰性組:小鼠前肢腋部皮下注射轉染miR-NC質粒的腎癌caki-1細胞1×106個/mL,灌胃等體積生理鹽水;轉染組:小鼠前肢腋部皮下轉染miR-495-3p質粒的腎癌caki-1細胞1×106個/mL,灌胃等體積生理鹽水;聯合組:小鼠前肢腋部皮下注射轉染miR-495-3p質粒的腎癌caki-1細胞1×106個/mL,灌胃30 mg/kg長梗秦艽酮。共干預7 d。
1.6.2 腫瘤質量和體積的測量
治療結束后,取出瘤體,稱質量。用游標卡尺測量瘤體的最大長徑和短徑,計算腫瘤體積。
1.7統計方法
采用SPSS 19.0統計軟件進行數據分析,計量資料以均數±標準差(±s)表示,多組比較采用單因素方差分析,兩組比較采用t檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1各組caki-1細胞順鉑敏感性比較
圖2-A結果顯示:各組0、1、2、4、8、16、32 μmol/L順鉑處理的caki-1細胞活力呈逐漸遞減趨勢。順鉑為32 μmol/L濃度時,長梗秦艽酮低、中、高劑量組的細胞活力均低于空白組,差異均有統計學意義(P<0.05);與miR-NC組比較,miR-495-3p組的細胞活力顯著降低(P<0.05);長梗秦艽酮高劑量組與miR-495-3p組的細胞活力比較,差異無統計學意義(P>0.05)。表明長梗秦艽酮、miR-495-3p質粒均可抑制順鉑處理的腎癌細胞增殖,且高濃度長梗秦艽酮的抑制效果與miR-495-3p質粒相當。
圖2-B結果顯示:長梗秦艽酮低、中、高劑量組caki-1細胞對順鉑的IC50值均低于空白組,且呈逐漸遞減趨勢,高劑量組對順鉑的IC50值最低(P<0.05);與miR-NC組比較,miR-495-3p組caki-1細胞對順鉑的IC50值明顯降低(P<0.05);miR-NC組與空白組,及長梗秦艽酮高劑量組與miR-495-3p組caki-1細胞對順鉑的IC50值比較,差異均無統計學意義(P>0.05)。表明長梗秦艽酮和過表達miR-495-3p均能增強腎癌細胞對順鉑的敏感性。

圖2 各組不同濃度順鉑處理的caki-1細胞活力及IC50值比較Figure 2 Comparison of the viability of caki-1 cells treated with different concentrations of cisplatin and IC50 value among various groups
2.2各組caki-1細胞凋亡能力比較
圖3、圖4結果顯示:與空白組比較,長梗秦艽酮低、中、高劑量組細胞凋亡率均顯著增加(P<0.05),呈逐漸遞增趨勢;miR-495-3p組細胞凋亡率較miR-NC組明顯增加(P<0.05);miR-NC組細胞凋亡率與空白組比較,差異無統計學意義(P>0.05);長梗秦艽酮高劑量組細胞凋亡率與miR-495-3p組比較,差異無統計學意義(P>0.05)。表明長梗秦艽酮和過表達miR-495-3p均能促進腎癌細胞凋亡。

圖3 流式細胞術檢測caki-1細胞凋亡結果Figure 3 Flow cytometry results for caki-1 cell apoptosis
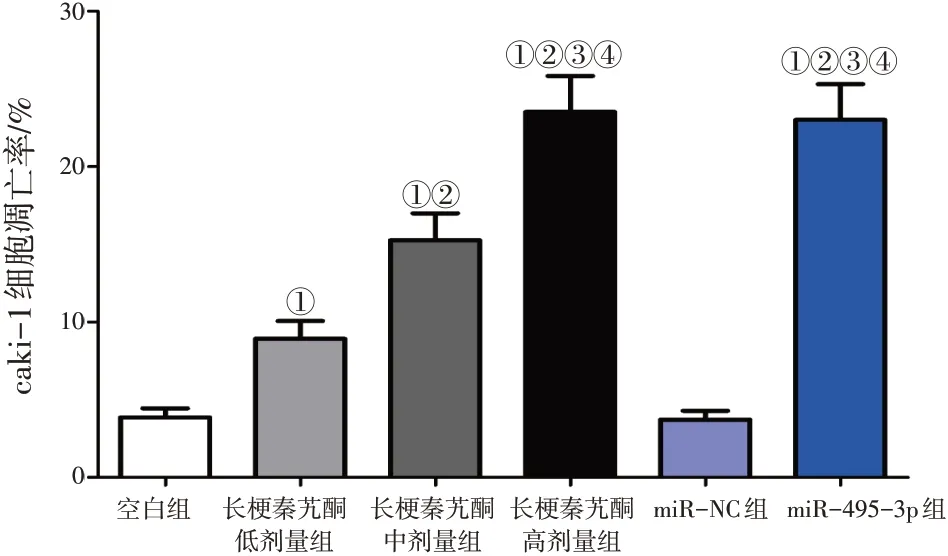
圖4 各組caki-1細胞凋亡率比較Figure 4 Comparison of apoptosis rates of caki-1 cells among various groups
2.3各組caki-1細胞侵襲能力比較
空白組、長梗秦艽酮低劑量組、長梗秦艽酮中劑量組、長梗秦艽酮高劑量組、miR-NC組及miR-495-3p組的細胞侵襲數量分別為(125.30±9.52)、(85.11±6.21)、(74.20±4.30)、(50.24±3.66)、(120.41±10.20)及(49.66±4.03)個。與空白組比較,長梗秦艽酮低、中、高劑量組caki-1細胞侵襲能力均顯著降低,呈逐漸遞減趨勢(P<0.05);與miR-NC組比較,miR-495-3p組caki-1細胞侵襲能力明顯降低(P<0.05);miR-NC組caki-1細胞侵襲能力與空白組比較,差異無統計學意義(P>0.05);長梗秦艽酮高劑量組caki-1細胞侵襲能力與miR-495-3p組比較,差異無統計學意義(P>0.05)。表明長梗秦艽酮和過表達miR-495-3p能抑制腎癌細胞侵襲。Transwell小室細胞侵襲實驗結果見圖5。
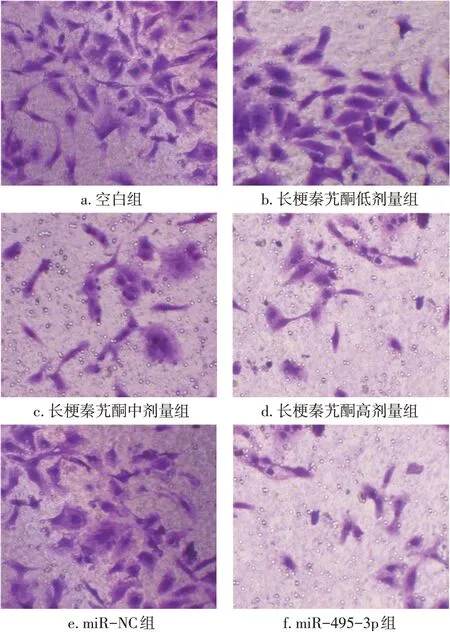
圖5 各組Transwell小室細胞侵襲實驗結果比較Figure 5 Comparison of the results of transwell chamber invasion assay among various groups(×400)
2.4各組caki-1細胞中miR-495-3p、XIAP mRNA表達比較
圖6-A結果顯示:空白組與miR-NC組caki-1細胞miR-495-3p呈低表達,差異無統計學意義(P>0.05);miR-495-3p組caki-1細胞中miR-495-3p呈過表達,與空白組和miR-NC組比較,差異有統計學意義(P<0.05);與空白組比較,長梗秦艽酮低、中、高劑量組細胞中miR-495-3p表達水平均明顯升高,呈遞增趨勢(P<0.05);長梗秦艽酮高劑量組細胞中miR-495-3p表達水平與miR-495-3p組比較,差異無統計學意義(P>0.05)。表明長梗秦艽酮能增強caki-1細胞miR-495-3p表達。
圖6 各組caki-1細胞中miR-495-3p、XIAP mRNA表達比較Figure 6 Comparison of expressions of miR-495-3p and XIAP mRNA among various groups of caki-1 cells
圖6-B結果顯示:與空白組比較,長梗秦艽酮低、中、高劑量組caki-1細胞中XIAP mRNA表達水平顯著降低,呈逐漸遞減趨勢(P<0.05);與miR-NC組 比 較,miR-495-3p組caki-1細 胞 中XIAP mRNA表達水平明顯降低(P<0.05);miRNC組與空白組,及長梗秦艽酮高劑量組與miR-495-3p組caki-1細胞中XIAP mRNA表達比較,差異均無統計學意義(P>0.05)。表明長梗秦艽酮和過表達miR-495-3p均能抑制腎癌細胞中XIAP mRNA表達。
2.5雙熒光素酶檢測報告
表2結果顯示,XIAP的活性可通過過表達miR-495-3p來降低(P<0.05),進一步證實了XIAP是miR-495-3p的靶基因。
表2 雙熒光素酶報告Table 2 Dual-luciferase report (±s)

表2 雙熒光素酶報告Table 2 Dual-luciferase report (±s)
注:①P<0.05,與miR-NC組比較
?
2.6各組小鼠腫瘤質量和體積比較
圖7結果顯示:與陰性組比較,轉染組、藥物組和聯合組的腫瘤質量和腫瘤體積均顯著減小(P<0.05);聯合組的腫瘤質量和腫瘤體積均小于轉染組和藥物組(P<0.05);藥物組腫瘤質量和腫瘤體積與轉染組比較,差異無統計學意義(P>0.05)。表明長梗秦艽酮、過表達miR-495-3p均可抑制小鼠腎癌,且聯合抑制效果優于單獨使用長梗秦艽酮或過表達miR-495-3p。
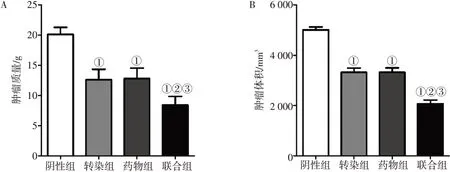
圖7 各組腎癌小鼠腫瘤質量和腫瘤體積比較Figure 7 Comparison of tumour mass and tumour volume among various groups of kidney cancer mice
3 討論
腎細胞癌(RCC)是腎臟中常見的一種腫瘤,以對放療、化療不敏感為臨床主要特點[13]。順鉑(DDP)作為一線化療藥物被廣泛應用于治療各種實體腫瘤,但順鉑破壞DNA交聯,誘導核苷酸切除、修復和同源重組,進而導致腫瘤細胞對化療藥物產生耐藥性[14]。本研究結果顯示,長梗秦艽酮組和miR-495-3p組caki-1細胞的活性和對順鉑的IC50值較空白組明顯降低,表明長梗秦艽酮、過表達miR-495-3p均能抑制腎癌細胞活性,增加腎癌細胞對順鉑的敏感性,進而降低腎癌細胞對順鉑的耐藥。
本研究通過對腎癌caki-1細胞進行長梗秦艽酮干預及轉染miR-495-3p后發現,miR-495-3p在腎癌caki-1細胞中呈低表達,在長梗秦艽酮高劑量組caki-1細胞中的表達與在miR-495-3p組中的表達沒有明顯差異,且miR-495-3p表達隨著長梗秦艽酮劑量的增加而升高,表明長梗秦艽酮能增強腎癌細胞中miR-495-3p的表達。
細胞的侵襲能力是決定腫瘤細胞轉移能力的潛在指標[15]。細胞凋亡是腫瘤研究的熱點,臨床上常見的化療藥物包括中藥的抗腫瘤機制多可誘導細胞凋亡,從而達到控制腫瘤惡性生長的目的[16]。本研究結果顯示,長梗秦艽酮高劑量組和miR-495-3p組caki-1細胞的侵襲能力較空白組明顯降低,凋亡能力較空白組明顯升高,表明長梗秦艽酮和過表達miR-495-3p均可抑制腎癌細胞侵襲,促進腎癌細胞凋亡,進一步證實了長梗秦艽酮和miR-495-3p的抗腫瘤作用。
X染色體連鎖凋亡抑制蛋白(XIAP)是凋亡抑制蛋白家族中的一員,是迄今發現的最強的凋亡抑制因子之一,在多數腫瘤中過度表達,介導腫瘤的發生、發展、分期、預后等[17-18]。本研究通過雙熒光素酶實驗結果顯示,過表達miR-495-3p能降低XIAP野生型質粒熒光素酶的活性,表明XIAP是miR-495-3p的靶基因,提示miR-495-3p對腎癌細胞生物活性的調控是通過抑制XIAP來實現的。
本研究通過體內實驗,觀察長梗秦艽酮、miR-495-3p質粒轉染對荷caki-1細胞NSG小鼠腎癌移植瘤模型腫瘤質量和體積的影響,結果顯示,轉染組、藥物組和聯合組腫瘤質量和腫瘤體積均較陰性組顯著減小,聯合組腫瘤質量和腫瘤體積均小于轉染組和藥物組,表明miR-495-3p質粒可減小腎癌小鼠體內腫瘤的質量和體積,對腫瘤生長具有一定的抑制作用,長梗秦艽酮聯合miR-495-3p質粒的治療效果更為顯著。
綜上所述,過表達miR-495-3p對腎癌細胞的增殖具有明顯的抑制作用,同時可有效促進腎癌細胞的凋亡。長梗秦艽酮、miR-495-3p可靶向抑制XIAP降低腎癌細胞生物活性,促進腎癌細胞凋亡,抑制腎癌細胞侵襲,增加腎癌細胞的順鉑敏感性,且有一定的協同作用。也進一步提示miR-495-3p可能作為潛在的生物靶點用于腎癌患者的臨床治療,長梗秦艽酮可作為腎癌患者化療輔助藥物。

