基于數據挖掘及網絡藥理學研究新安固本培元高頻藥對及其治療慢性阻塞性肺疾病的作用機制
吳 凡,李澤庚,朱 潔, 王小樂,高雅婷2,,楊勤軍,吳 迪,丁煥章
1安徽中醫藥大學中醫學院,合肥 230012;2安徽中醫藥大學第一附屬醫院;3安徽省中醫藥科學院中醫呼吸病防治研究所; 4安徽省教育廳中醫藥防治肺系重大疾病重點實驗室,合肥 230038
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一種以氣流受限,氣體交換異常,黏液高分泌及肺動脈高壓等為特征的異質性疾病[1]。COPD在中醫上多以肺脹、咳嗽及喘證命名,發病以虛、痰、瘀為主要病機,氣虛為本,多始于肺臟、傳于脾臟、終及腎臟,肺脾腎三臟功能失調,津液代謝失常則成痰飲,血瘀、痰濁、水飲交錯為患。補氣為治療COPD的重要治則之一。中醫藥治療效果明確,具有改善咳喘癥狀、提高生活質量的作用。
新安固本培元派作為新安醫學中最具代表性的醫學流派分支,以“培補脾腎、顧護元氣”為學術主張,通過固護人體后天之本而達到扶正祛邪、治病愈疾的目的。固本關鍵在固肺、脾、腎三臟之氣,培元核心在補益氣血陰陽之偏。清代休寧醫家汪文綺云“脾為倉廩之官……若久咳而滋補無功,須培養脾元,補母以及其子”。歙縣名醫程文囿:“肺金之虛,多由腎水之涸……若陰損于下,陽孤于上……是咳雖在肺,而實在腎”。新安固本培元理論以調氣血、固脾胃、補腎氣為治療特色,對于COPD的防治特色突出,療效明確[2]。
本文通過關聯規則挖掘出新安固本培元醫案中治療COPD常用藥對為人參(Ginseng Radix et Rhizoma,GRR)與黃芪(Astragali Radix,AR)配伍。人參-黃芪成分眾多,治療COPD機制尚不明確。對人參-黃芪藥對開展網絡藥理學研究,進一步明確人參-黃芪活性成分及作用靶點,并分析其治療COPD的作用機制,可以為人參-黃芪治療COPD提供理論依據,對于闡釋新安固本培元理論也有積極意義。
1 資料與方法
1.1 COPD相關醫案收集
選取《石山醫案》《孫文垣醫案》《杏軒醫案》《程茂先醫案》《素圃醫案》《程敬通醫案》《吳氏醫驗錄》及《馮塘醫案》等新安醫籍中涉及“肺脹”“咳嗽”“喘證”的醫案,臨床表現及病史符合《內科學》COPD特征,初步檢索獲取醫案205篇,去重后嚴格按照納入標準和排除標準去除53篇醫案,最后納入分析醫案152篇。
納入標準:(1)癥狀符合慢性阻塞性肺疾病表現;(2)醫案記錄比較完整,包括主癥和方藥等記錄;(3)醫案記載,有確切療效,能夠改善相關臨床癥狀。
排除標準:(1)只有癥狀及發病過程論述,或只有方藥;(2)單純針灸治療;(3)失治誤治醫案(醫案記錄中明確指出有誤的醫案)。
1.2 運用Apriori關聯規則算法挖掘藥對
將中藥名稱標準化后錄入Excel表格,例如將“法半夏”“清半夏”統一命名為“半夏”,將“炙甘草”“生甘草”統一命名為“甘草”,建立中藥數據庫。運用SPSS Modeler軟件處理數據庫內中藥,運用Apriori關聯規則算法建立數據挖掘模型,得出使用頻率最高的藥對[3]。
1.3 藥對中所含化學成分的收集與篩選
在中藥系統藥理學分析平臺(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)中收集藥對的主要化學成分。結合口服生物利用度(oral bioavailability,OB≥30%)和類藥性(drug likeness,DL≥0.18)篩選所收集到的化學成分,建立藥對的化學成分數據[4]。將上面收集到的靶蛋白在數據庫UniProt(https://www.uniprot.org)中進行校正,選擇物種為人(Homo sapiens),校正靶點蛋白信息并轉化為gene symbol,建立藥物的靶基因數據庫。
1.4 COPD與藥對相關靶點收集
通過TTD數據庫(http://db.idrblab.net/ttd/)、OMIM數據庫(https://omim.org/)、GeneCards數據庫(https://www.genecards.org/),檢索關鍵詞“chronic obstructive pulmonary disease”收集COPD相關基因,其中GeneCards數據庫relevance score≥30,三個數據庫整合并去重得到COPD相關基因,并與中藥活性成分靶基因進行映射篩選共同靶點,即為藥對活性成分治療COPD的靶點。
1.5 “化合物-靶點”的網絡構建及可視化分析
利用Cytoscape 3.7.2軟件構建藥物活性成分-關鍵靶點基因網絡圖。網絡中各節點(node)分別代表活性成分和靶點基因;網絡中邊(edge)用來連接活性成分與關鍵靶點基因;連接到網絡的節點以度值(degree)為單位進行表示,某節點與其他節點連接的邊數越多,則說明該節點在網絡中扮演的角色越重要,度值也越大。
1.6 蛋白網絡互作構建及拓撲分析
采用STRING數據庫對人參黃芪與COPD的交集靶點進行蛋白質相互作用分析。物種限定為人,通過設定最小相互作用得分(interaction score)>0.4,獲得交集靶點的PPI(protein-protein interaction)網絡數據,保存“TSV”格式文件,利用Cytoscape 3.7.2軟件分析所獲得的蛋白相互作用并建立網絡圖。
1.7 GO生物學功能及KEGG通路富集分析
應用metascape數據平臺(https://metascape.org/)對篩選出的共同靶點進行GO功能注釋和KEGG通路富集分析,選擇種族人類(Homo sapiens),設定P≤0.01,其余保持默認,分析人參-黃芪治療COPD潛在的生物過程和信號通路。利用微生信在線平臺(http://www.bioinformatics.com.cn/)繪制GO分析條狀圖以及KEGG富集氣泡圖。
1.8 成分-靶點分子對接
登錄TCMSP數據庫下載山奈酚(kaempferol)、人參皂苷Rh2(ginsenoside Rh2)及常春藤皂苷元(hederagenin)三種活性成分的主要成分結構,對3D結構進行能量最小化后保存,利用Autodock Tools 1.5.6軟件生成pdbqt格式。然后登錄PDB數據庫(http://www.rcsb.org)下載AKT1(PDBID:1H10)、IL6(PDBID:7NXZ)、CXCL8(PDBID:6N2U)、MAPK1(PDBID:7NR9)及TNF-α(PDBID:7ATB)等5個靶點蛋白3D晶體結構,對其去水、配體,加氫,重新計算電荷;然后將活性成分文件導入,檢測總電荷,分配電荷,查看柔性可旋轉鍵。最后使用Autodock程序進行分子對接,計算結合能大小。Pymol軟件將結果可視化。結合能絕對值>4.25代表分子與靶點初步具有結合能力,結合能絕對值>5.0代表較強結合能力,結合能絕對值>7.0代表很強結合能力[5]。
2 結果
2.1 運用關聯規則獲取藥對
納入醫案處方152例,涉及中藥217味,總頻次1 962次,中藥類別包括補虛藥、化痰止咳平喘藥、解表藥、清熱藥等18大類。基于醫案處方中藥,運用SPSS Modeler中的Apriori進行建模,選取支持度≥0.11,置信度≥0.75,進行關聯分析,得到二項關聯(見表1),其關聯關系網絡圖見圖1。其中,置信度最高且關聯性強的藥對是人參-黃芪,置信度為90.91%,支持度為25.00%。
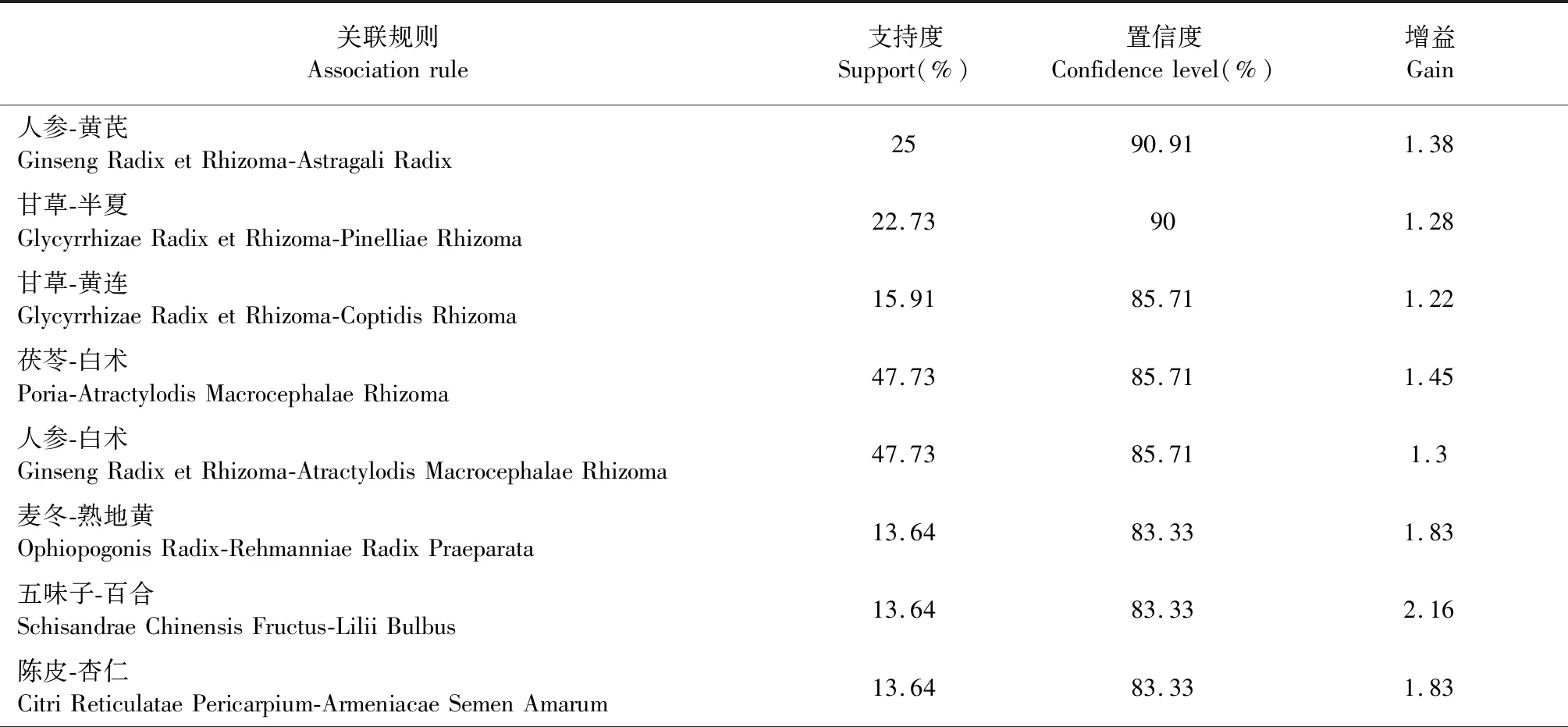
表1 治療COPD處方中藥物的關聯規則(置信度≥0.75)Table 1 Association rules for drugs in the treatment of COPD (confidence≥0.75)
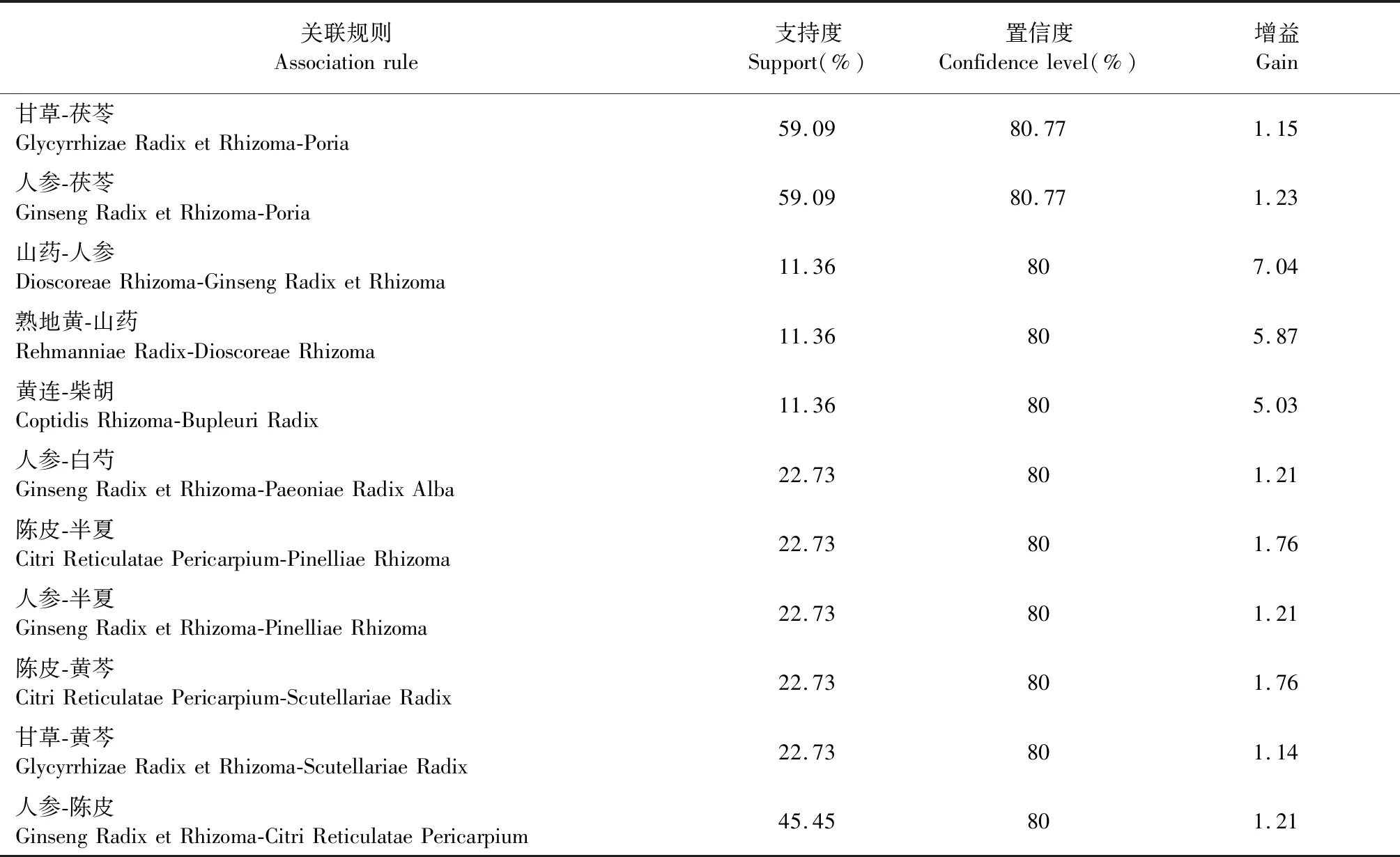
續表1(Continued Tab.1)
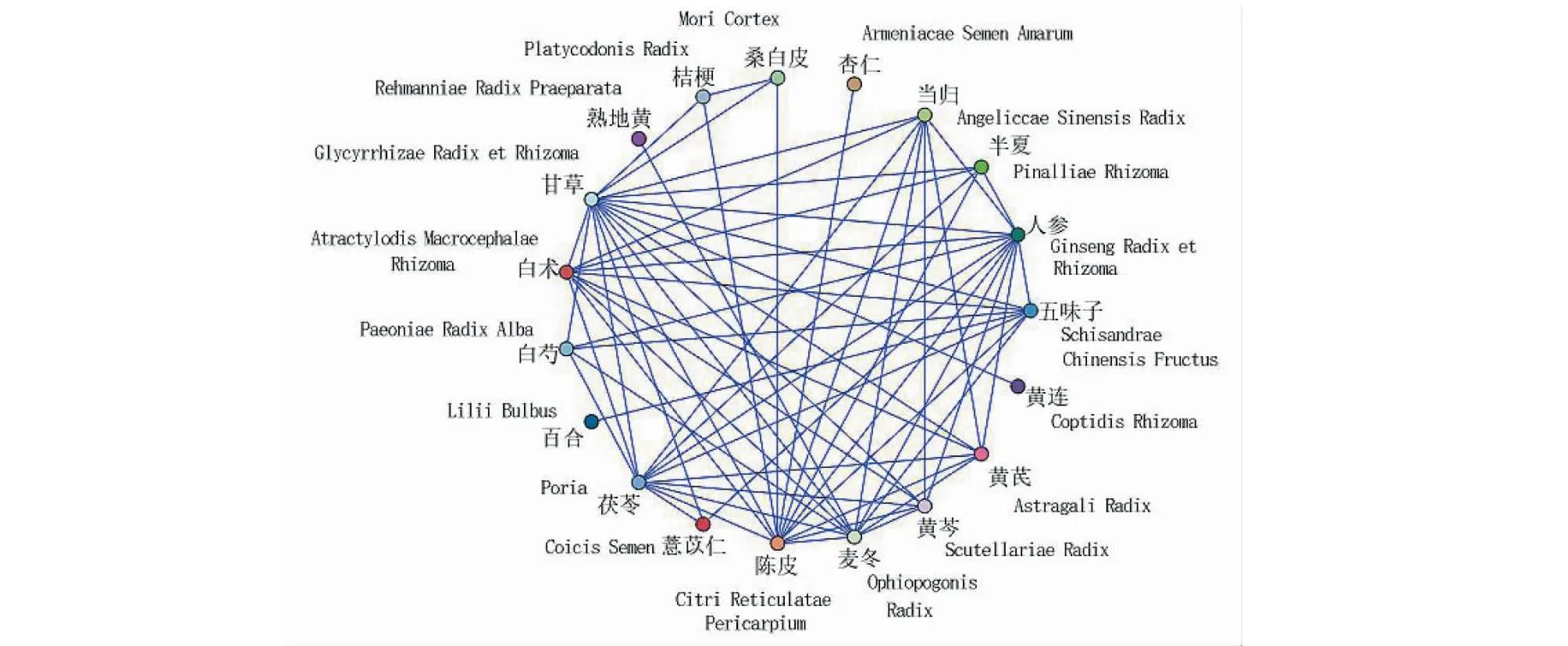
圖1 藥物關聯網絡圖Fig.1 Drug association network diagram
2.2 所含化學成分收集與篩選
在TCMSP數據庫,設置篩選條件為OB≥30%、DL≥0.18后得到人參化學成分22個,黃芪化學成分20個,剔除沒有靶點的化學成分,人參化學成分17個,黃芪化學成分17個,山奈酚為二藥共同成
分,其中共計篩選到化學成分33個,詳見表2。通過Cytoscape 3.7.2軟件構建化學成分與治療靶點網絡圖(見圖2)。圖2共有216個節點、587條邊,三角形代表活性成分,圓形為靶點基因。
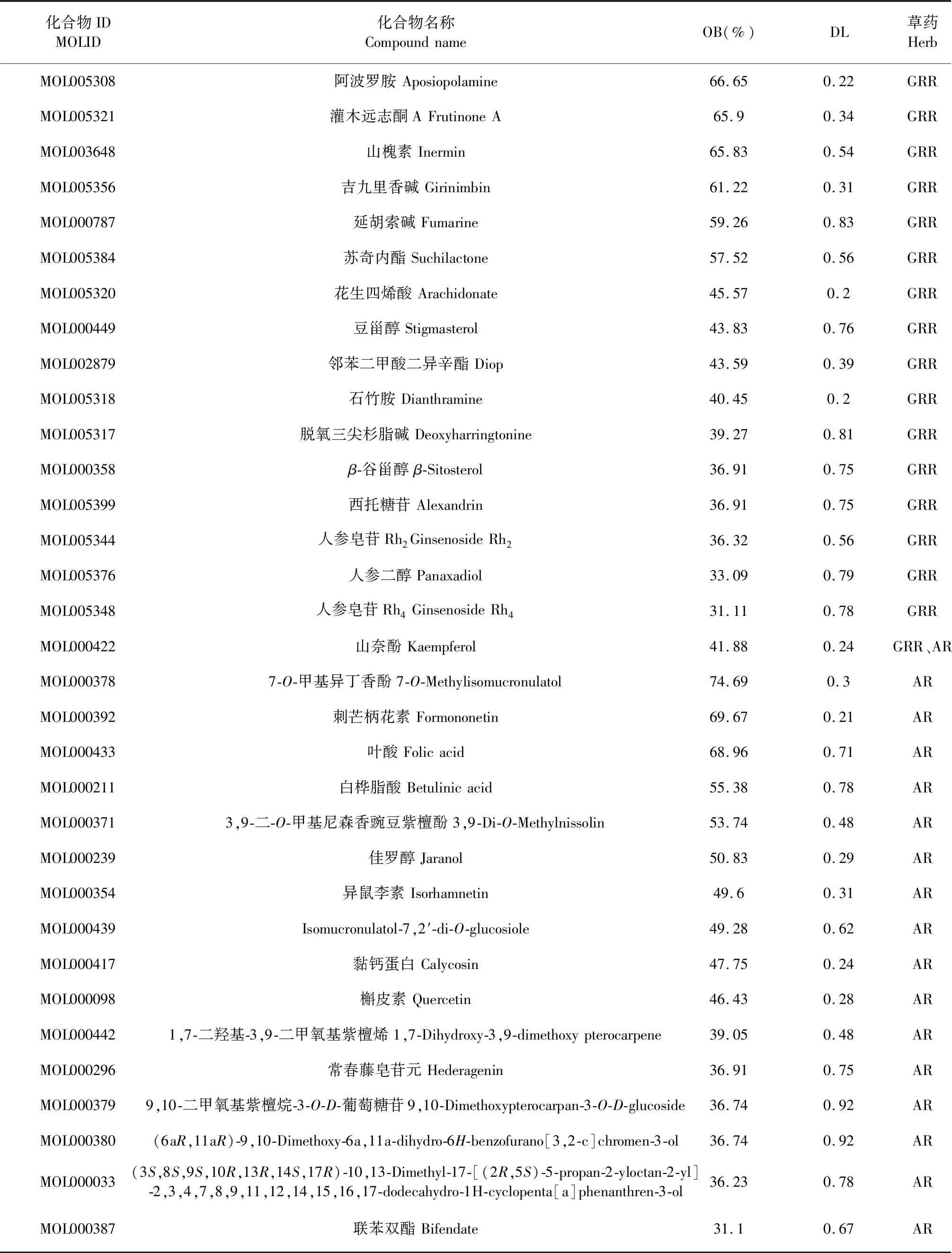
表2 人參-黃芪活性成分Table 2 Active ingredient of Ginseng Radix et Rhizoma-Astragali Radix
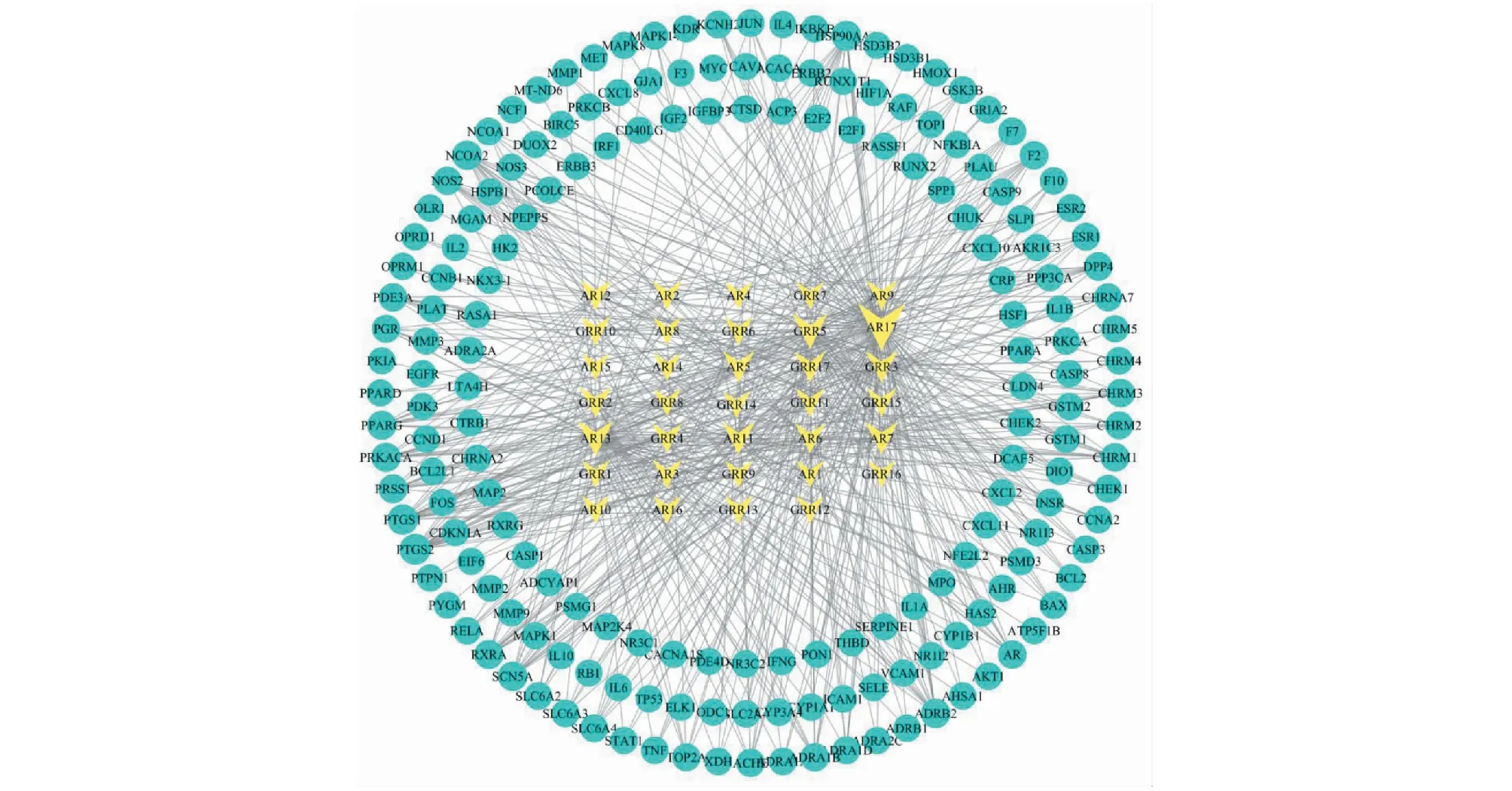
圖2 人參-黃芪主要活性成分-靶點網絡圖Fig.2 Main active ingredient-target network of Ginseng Radix et Rhizoma-Astragali Radix
2.3 疾病和藥物相關靶點的篩選
在GeneCards、OMIM及TTD中以“chronic obstructive pulmonary disease”為關鍵詞,檢索COPD相關靶基因,去重后得到靶基因946個,并與人參-黃芪活性成分治療的靶基因取交集并繪制維恩圖(見圖3)。圖中共同靶點64個,說明這些基因可能在人參-黃芪治療COPD過程中,發揮一定作用,為進一步闡釋人參-黃芪治療COPD的作用機制,將這64個靶點作為目標關鍵靶點進行分析。
2.4 關鍵靶點蛋白-蛋白相互作用分析
在STRING數據庫中分析64個關鍵靶點之間的相互作用關系并導出結果。將結果導入Cytoscape 3.7.2獲取PPI網絡,圖中顏色越深、圓圈越大則得分越高(見圖4)。可以看出,這64個靶點間有相互作用,表明這些靶點相互聯系,并通過多途徑、多方面的協調來起到治療COPD。經拓撲分析,度值(degree值)排名前10的靶點依次為IL6、TNF、AKT1、TP53、MMP9、MAPK1、CXCL8、PTGS2、EIL1B、FOS,表明這些基因在人參-黃芪治療COPD過程中具有重要意義。
2.5 GO生物學功能和KEGG通路富集分析
用Metascape數據庫,從生物過程、分子功能和細胞組成3個模塊對64個關鍵靶點進行GO功能富集分析,生物過程(biological process,BP)條目1 629條,主要涉及細胞分化、炎癥反應、細胞凋亡、上皮細胞增殖及氧化應激等;分子功能(molecular function,MF)條目48條,主要涉及轉錄因子結合,受體調節,信號受體激活、受體配體活動及生長因子活動等;細胞組分(cellular component,CC)條目91條,主要涉及胞質核周區域、細胞外基質、線粒體外膜、細胞器外膜及膜微結構域等,具體GO功能分析結果可見圖5。KEGG分析結果顯示,P≤0.01的通路共計133條。結合表3和圖6,每條通路的P值從小至大進行排序,與人參-黃芪治療COPD相關的通路有PI3K-Akt信號通路、HIF-1信號通路、Toll樣受體信號通路、Th17細胞分化及MAPK信號通路等。

圖3 疾病靶點基因與人參-黃芪靶點基因Veen圖Fig.3 Veen diagram of disease target genes and Ginseng Radix-Astragali Radix target genes

圖4 關鍵靶點PPI網絡圖Fig.4 PPI network diagram of key targets

圖5 GO富集分析柱狀圖Fig.5 GO enrichment analysis histogram

表3 KEGG通路富集分析(前14條)Table 3 KEGG pathway enrichment analysis (Top 14)

續表3(Continued Tab.3)
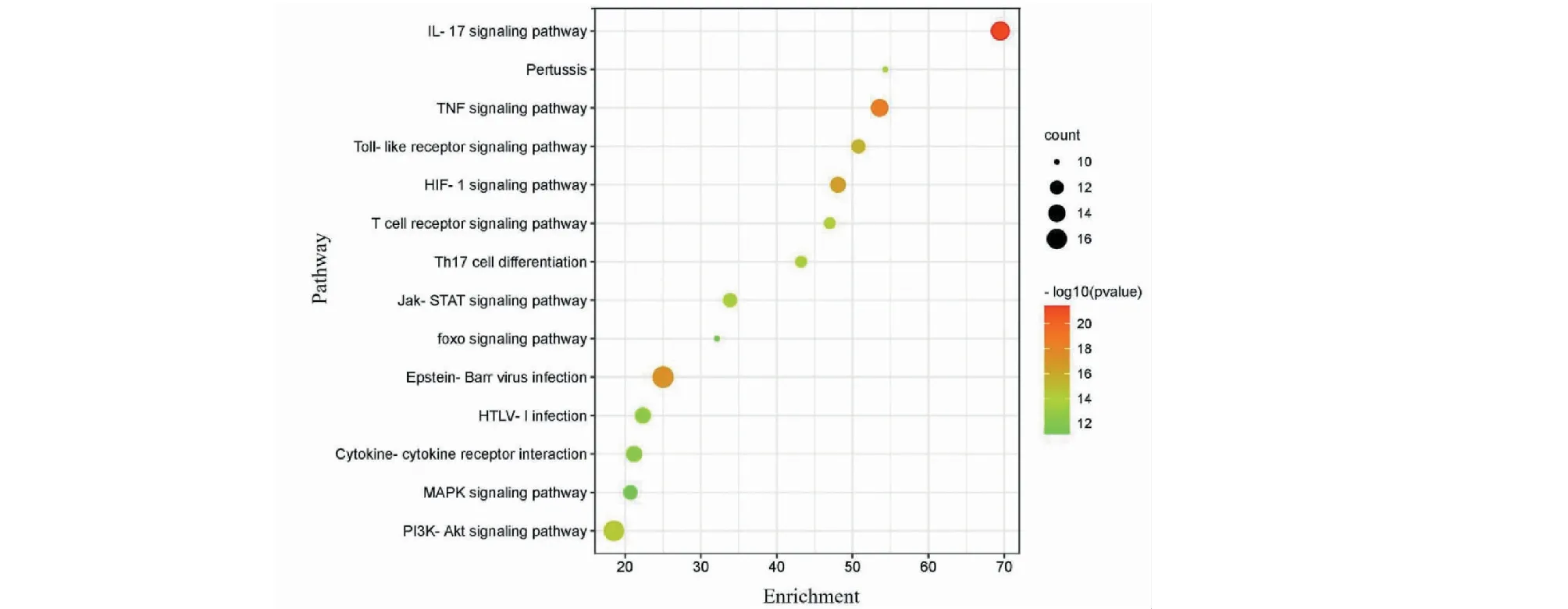
圖6 KEGG通路富集分析氣泡圖Fig.6 Bubble diagram of KEGG pathway enrichment analysis
2.6 分子對接結果
使用Cytoscape 3.7.2中的插件cytoNCA、cytoHubba篩選出degree值排名前十的主要作用靶點,選擇出人參、黃芪degree值得出評分較高的活性成分。結合文獻報道[6],人參皂苷Rh2及常春藤皂苷元均有增強免疫作用,對于慢性支氣管炎具有一定的治療作用,人參、黃芪共同化學成分山奈酚具有抗炎、抗腫瘤、同時對肺損傷具有防治作用[7];選擇上述三種化合物,根據KEGG分析得到得通路,運用PyMOL、AutoDock Vina等軟件對人參-黃芪的關鍵成分及主要靶點進行分子對接,對上述三種化合物作用于AKT1、IL6、CXCL8、MAPK1及TNF-α的結合能進行對接并打分。根據文獻[8-10]結合TCMSP數據庫查詢結果,以白藜蘆醇(PubChem Cid:445154)作為AKT1陽性對照藥、槲皮苷(PubChem Cid:5280343)作為CXCL8陽性對照藥、木犀草素(PubChem Cid:5280445)作為IL6陽性對照藥、異槲皮苷(PubChem Cid:5280804)作為MAPK1陽性對照藥及苯甲酸(PubChem Cid:243)作為TNF-α陽性對照藥。表4可得出,人參皂苷Rh2、常春藤皂苷元及山奈酚與AKT1、IL6、CXCL8、MAPK1及TNF-α均有較強的親和力。同時運用PyMOL、LigPlot+軟件制作了AKT1與人參皂苷Rh2、山奈酚,MAPK1與山奈酚,IL6與人參皂苷Rh2的3D對接示意圖見圖7。
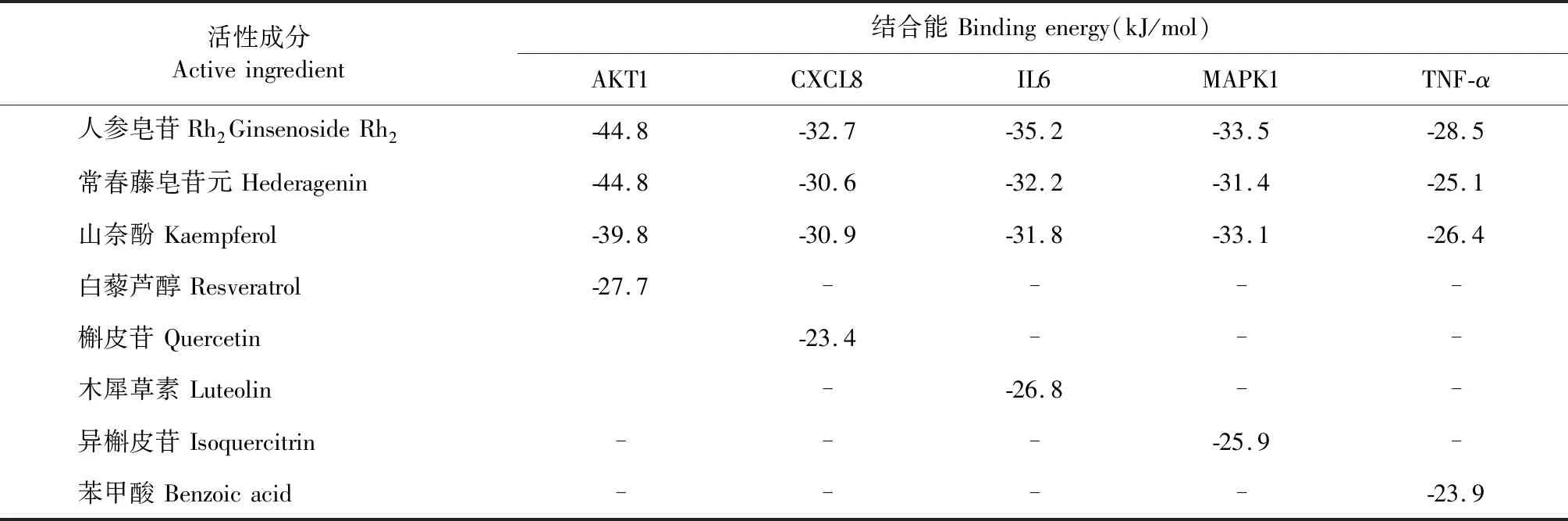
表4 活性成分與靶點受體蛋白間的最低結合能Table 4 Minimum binding energy between active ingredients and target proteins
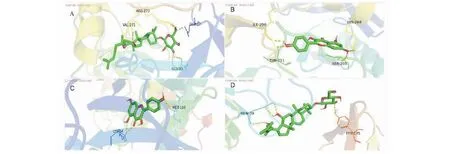
圖7 靶點受體蛋白與活性成分的對接模式和相互關系模擬Fig.7 Simulation of docking mode and interaction between target receptor protein and active component注:A:AKT1-人參皂苷Rh2;B:AKT1-山奈酚;C:MAPK1-山奈酚;D:IL6-人參皂苷Rh2。Note:A:AKT1-ginsenoside Rh2;B:AKT1-kaempferol;C:MAPK1-kaempferol;D:IL6-ginsenoside Rh2.
3 討論與結論
咳嗽、喘息、氣短,動則加重及畏風等作為肺氣虛證常見癥狀,最早見于COPD病理過程,肺氣虛漸進性發展,影響及脾,發展為肺脾氣虛,兼見納呆或食少,胃脘脹滿或腹脹或便溏等;病情進一步發展,可出現呼多吸少,呼吸表淺甚至氣少不足以吸等腎氣不足證候的癥狀,可見肺脾腎氣虛[11]。COPD穩定期治療以補肺健脾補腎為主,兼顧行氣、化痰、活血,穩定期有效防治對于減少急性發作次數、改善患者感受、延緩病理改變和病情進展有積極意義。
在固本培元理論指導下,新安醫家通過補益肺、脾、腎之氣,恢復臟腑氣血功能,以祛痰瘀、水飲等病理產物,與COPD穩定期治療高度契合。通過Apriori關聯規則分析目標數據庫里的用藥規律得到人參與黃芪同時配伍治療COPD置信度最高。以汪機為代表的新安醫學固本培元醫家,認為“參芪不惟補陽,而亦補陰”,臨床擅用人參、黃芪,重固脾胃,補益氣血,平調陰陽。明代祁門醫家陳嘉謨《本草蒙筌》云:“人參可定喘嗽,通暢血脈,瀉陰火……肺寒受邪,短氣少氣,虛喘宜用”。歙縣名醫汪昂《本草備要》:“黃芪炙用補中,益元氣,溫三焦,壯脾胃……脾胃緩和,則肺氣旺而肌表固實,補中即所以固表也。二藥備受新安醫家喜愛,合用而固本培元、健脾補肺、培土生金,符合COPD穩定期肺脾氣虛證的基本病機。近代臨床研究表明,以人參-黃芪為君藥的方藥對于COPD穩定具有良好的治療作用,Dou等[12]研究發現自擬補肺益腎湯(黨參、生黃芪、五味子等)可以降低慢阻肺肺腎氣虛型患者的中醫證候積分,升高PaO2,減少CO2潴留。
通過Cytoscape 3.7.2中的插件cytoNCA挖掘人參-黃芪中33個活性成分,參考degree排名,結合研究文獻,發現山奈酚、人參皂苷Rh2及常春藤皂苷元等成分發揮著重要的作用。山奈酚具一種有二苯基丙烷結構的低分子量的黃色化合物,由4-香豆酰輔酶A與三個丙二酰輔酶A縮合而成,能夠通過抑制NF-κB與髓系分化因子88(MYD88)的結合活性,抑制炎癥反應的發生[13]。人參皂苷Rh2是人參中主要的生物活性皂苷之一,從結構上看,Rh2可分為S型和R型兩種構型,其中20(S)-Rh2單體是從中草藥中分離得到的主要構型,研究顯示人參皂苷Rh2通過調節TGF-β1/Smad通路有效地抑制小膠質細胞活化和促炎細胞因子的產生[14]。常春藤皂苷元是一種天然存在的三萜類化合物,在A環的C-4位帶有羥甲基,高度不溶于水,能夠可抑制NF-κB和p-IκBα的核轉位,從而抑制NF-κB的活化,抑制內毒素誘導的細胞NF-κB水平和NF-κB的核轉位發揮抗炎作用[15]。
通過對交集靶點進行GO功能分析,發現人參-黃芪可能在胞質核周、細胞外基質、線粒體外膜區域,調控轉錄因子結合、受體調節、信號受體激活、配體活動等分子功能,發揮抗氧化應激、延緩炎癥及抑制細胞凋亡和上皮細胞增殖等生物過程。KEGG通路富集分析顯示,這些靶點參與了PI3K-Akt信號通路、IL-17信號通路、TNF信號通路、HIF-1信號通路、細胞因子受體相互作用信號通路、Toll樣受體信號通路、Jak-STAT信號通路、MAPK信號通路、T細胞受體信號通路、Th17細胞分化及Foxo信號通路等。應用Cytoscape中的cytoHubba插件篩選出degree值排名前十的核心基因,依據文獻[16]及KEGG富集分析的結果,選擇Toll樣受體(toll-like receptors,TLRs)和Th17細胞分化信號通路進行深入分析,得出兩條通路富集的核心基因有AKT1、IL6、CXCL8、MAPK1及TNF-α等。TLRs是固有免疫中關鍵的模式識別受體,在吸煙、有害氣體及微生物等因素的影響下,TLRs成跨膜信號轉導,再通過依賴于MYD88的NF-κB通路調控炎癥基因的轉錄、翻譯和表達,產生并釋放IL-6、IL-8、COX-2、PGE2等炎性因子,在損傷細胞同時,又作為內源性配體與中性粒細胞、NK細胞等表面受體結合,合成并釋放大量炎癥介質和募集炎癥細胞,導致肺部炎癥反應級聯被放大并持續存在,TLR2、TLR4、TLR9都參與了COPD的發病過程,其中TLR4被認為是維持COPD炎癥反應的主要TLRs[17]。輔助性T細胞17(T helper cell 17,Th17)是輔助性T淋巴細胞中的一個特殊亞群主要分泌白細胞介素17(interleukin 17,IL-17)和其他炎癥細胞因子,在慢性氣道炎癥性疾病中與成纖維細胞、上皮細胞及平滑肌細胞表面的受體結合而發生免疫反應,誘導中性粒細胞的增殖和聚集,造成氣道上皮損傷,介導纖維化[18];與Th17細胞相比,Treg細胞具有免疫調節功能,并分泌抗炎細胞因子來增強免疫耐受性和抑制炎癥反應,Th17/Treg失衡被認為是COPD發生的重要誘因[19]。AKT是進化上高度保守的一種絲氨酸/蘇氨酸蛋白激酶,AKT的活化能抑制FOXO3a的轉錄活性,誘導p53/p21途徑參與香煙誘導支氣管上皮細胞的衰老[20]。IL-6作為細胞因子之一能夠促進Th17(輔助性T細胞17)分化通路,并誘導促炎細胞因子如IL-17(白介素17)和CXCL8(趨化因子8)的產生,促進COPD發展[21]。CXCL8是中性粒細胞炎癥介質,CXCL8和其他由肺巨噬細胞分泌的趨化因子在外界刺激(香煙煙霧、空氣污染物)下協調中性粒細胞(PMN)向肺部的運輸,中性粒細胞和其他炎性細胞堆積產生的蛋白酶分泌會導致持續的廣泛的組織損傷,還刺激氣道上皮,使其收縮,增加其對炎癥細胞的通透性,參與COPD的發病[22]。TNF-α為一種重要的炎癥介質,能與香煙煙霧、LPS等協同活化炎癥細胞的NF-κB系統,刺激IL-8等細胞因子的釋放,使中性粒細胞數量增加,還能誘導基質金屬蛋白酶(MMP-9、MMP-12等)釋放,破壞肺泡壁而加重COPD進展[23]。MAPK1(絲裂原活化蛋白激酶1)是細胞內絲氨酸/蘇氨酸蛋白激酶,在進化過程中高度保守,在活化進入細胞核之前位于細胞質中,可以通過磷酸化轉錄因子來改變基因表達,促進炎癥因子TNF-α、IL-1、IL-6等的產生[24],誘導一系列炎癥和免疫反應,從而在COPD的發病機制中發揮作用[25]。AKT1、IL6、CXCL8、TNF-α、MAPK1為富集于Toll樣受體信號通路和Th17細胞分化信號通路的關鍵靶點,各基因之間也存在交互調控作用,可能通過炎癥免疫影響COPD的發病和進程。
為了進一步驗證網絡藥理學結果的可靠性,利用分子對接技術將核心成分和關鍵靶點進行分子對接,結果發現,核心成分山奈酚、人參皂苷Rh2及常春藤皂苷元與AKT1、IL6、CXCL8、MAPK1及TNF-α的結合能均小于-21.4 kJ/mol,其中AKT1與人參皂苷Rh2、常春藤皂苷元的結合能為-44.8 kJ/mol,表明他們之間有強烈的結合活性。上述結果表明AKT1、IL6、CXCL8、MAPK1及TNF-α可能是人參-黃芪發揮作用的重要靶點。
綜上所述,通過數據挖掘證實新安醫學固本培元派醫家善用人參-黃芪藥對治療COPD,采用網絡藥理學方法構建“化合物-靶點”網絡,從整體上分析人參-黃芪成分、靶點、信號通路之間的相互作用關系,推測人參-黃芪通過山奈酚、人參皂苷Rh2及常春藤皂苷元等潛在藥效成分協同作用于AKT1、IL6、CXCL8、MAPK1及TNF-α等多個靶點,通過Toll樣受體信號通路和Th17細胞分化信號通路等發揮抗炎及調節免疫等作用治療COPD。初步揭示了人參-黃芪藥對通過多成分、多靶點、多通路治療COPD的機制,后續可對人參-黃芪藥對進行實驗研究,篩選該藥對主要成分作用于香煙煙霧誘導的氣道上皮細胞模型,檢測核心靶蛋白的表達,深入探討關鍵作用機制,為COPD治療藥物的研發提供新的方向及依據。

