雌二醇降低細胞外組蛋白誘導內皮細胞損傷的作用及機制研究*
楊 帆,舒林飛,袁志舟,李 濤,龍永其,諶 磊△
(1.湖南省株洲市中心醫院泌尿外一科 412007;2.海南醫學院第二附屬醫院器官移植科,海口 570216)
膿毒癥是臨床常見的危重癥,其救治難度大、病死率高。膿毒癥的主要病理生理特征是全身炎癥反應激活,涉及炎癥細胞因子的大量釋放、氧化應激及細胞凋亡的異常激活等生物學環節,嚴重者可進展為多器官功能障礙綜合征[1-2]。血管內皮細胞損傷在膿毒癥病情發展、多臟器功能損傷中起到重要作用,造成內皮損傷的因素復雜,其中從細胞核小體釋放進入細胞外的組蛋白具有細胞毒性。多項臨床研究[3-4]和基礎研究[5]證實,膿毒癥患兒及動物模型的血清細胞外組蛋白水平升高且與預后相關。采用大劑量組蛋白短時間沖擊處理的方式通過激活核因子-κB(nuclear factor-κB,NF-κB)及p38通路可建立內皮細胞損傷模型[6]。
雌激素是目前已知具有心腦血管保護作用的激素,有臨床研究顯示血清雌二醇(estradiol,E2)水平不足是膿毒癥患者預后不良的危險因素之一[7],另有動物實驗證實補充E2可減輕膿毒癥動物的臟器損傷[8]。但E2在膿毒癥發病過程中的內皮保護作用及機制尚不十分清楚。有研究報道,E2在神經元損傷及心肌肥大模型中的細胞保護作用與抑制p38通路及NF-κB通路有關[9-10]。基于此,本研究在大劑量組蛋白短時間沖擊誘導的內皮細胞損傷模型中探索了E2的保護作用,以及NF-κB、p38通路相關的分子機制。
1 材料與方法
1.1 材料
1.1.1細胞株
人臍靜脈內皮細胞株(human umbilical vein endothelial cell,HUVEC)購自美國ATCC公司。
1.1.2試劑
小牛胸腺組蛋白(calf thymus histone,CTH)、四唑氮化合物(MTS)細胞增殖試劑盒購自武漢艾美捷科技公司,E2、p38激動劑P79350(儲存液濃度0.5 mol/L)購自美國Sigma公司,白細胞介素(interleukin,IL)-1β、IL-6、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)的ELISA檢測試劑盒購自南京建成生物工程研究所,裂解液及TUNEL凋亡檢測試劑盒購自上海碧云天公司,活化型caspase-3(cleaved caspase-3)、p38、磷酸化p38(p-p38)、NF-κB、磷酸化NF-κB(p-NF-κB)特異性一抗購自美國CST公司。
1.1.3儀器
細胞培養箱購自美國Thermo公司,多功能酶標儀購自美國Bio-tek公司,熒光顯微鏡購自日本Nikon公司,凝膠成像儀購自美國Bio-rad公司。
1.2 方法
1.2.1HUVECs培養及分組
HUVECs在含有10%胎牛血清的完全培養基中貼壁培養,密度生長至90%時用0.25%胰蛋白酶進行消化傳代。傳代的HUVECs接種在不同規格的培養板,分為對照組、CTH組、E2組、二甲基亞砜(DMSO)組、DMSO+CTH組、DMSO+E2組、P79350+E2組,處理方法如下:對照組用不含藥物的培養基處理60 min;CTH組用含有200 μg/mL CTH的培養基處理60 min;E2組先給予含有0.1 mmol/L E2的培養基預處理60 min,而后用含有200 μg/mL CTH的培養基處理60 min;DMSO組用含有0.1% DMSO的培養基連續處理2 h;DMSO+CTH組用含有0.1% DMSO的培養基預處理60 min,而后用含有200 μg/mL CTH的培養基處理60 min;DMSO+E2組用含有0.1% DMSO和0.1 mmol/L E2的培養基預處理60 min,而后用含有200 μg/mL CTH的培養基處理60 min;P79350+E2組用含有50 μmol/L P79350和0.1 mmol/L E2的培養基預處理60 min,而后用含有200 μg/mL CTH的培養基處理60 min。所有分組均重復5次。
1.2.2細胞活力的檢測
HUVECs接種在96孔培養板中,CTH處理后15、30、45、60 min時,采用MTS法進行細胞活力檢測,在每個培養孔內加入20 μL檢測液并繼續培養4 h,而后在酶標儀上檢測490 nm波長的吸光度(A490)值。
1.2.3培養基中炎癥反應和氧化應激反應指標的檢測
HUVECs接種在12孔培養板中,CTH處理后60 min分別收集培養基和細胞,采用南京建成生物工程研究所的ELISA試劑盒檢測培養基中IL-1β、IL-6、TNF-α、MDA、SOD水平,采用BCA法檢測細胞中的蛋白水平,計算每毫克細胞蛋白中IL-1β、IL-6、TNF-α、MDA、SOD水平。
1.2.4細胞凋亡率的檢測
HUVECs接種在24孔培養板中,CTH處理后60 min收集細胞并用4%多聚甲醛固定,采用TUNEL法檢測細胞凋亡,按照試劑盒說明書進行TUNEL染色和4’,6-二脒基-2-苯基吲哚(DAPI)染色,在顯微鏡下觀察TUNEL陽性細胞及DAPI陽性細胞并計數,計算細胞凋亡率=TUNEL陽性細胞數/DAPI陽性細胞數×100%。
1.2.5細胞中蛋白表達水平的檢測
HUVECs接種在12孔培養板中,CTH處理后60 min收集細胞并加入上海碧云天公司的裂解液提取細胞蛋白,與上樣緩沖液混合、煮沸變性后進行Western blot檢測,將樣品加入聚丙烯酰胺凝膠中進行電泳、電轉移至硝酸纖維素膜,5%脫脂牛奶封閉1 h后4 ℃孵育cleaved caspase-3、p38、p-p38、NF-κB、p-NF-κB及β-actin特異性一抗過夜,次日孵育辣根過氧化物酶二抗1 h并在凝膠成像儀中采用電化學發光(ECL)法顯影得到蛋白條帶,按照蛋白條帶的灰度值計算cleaved caspase-3/β-actin、p-p38/p38、p-NF-κB/NF-κB水平。
1.3 統計學處理
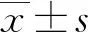
2 結 果
2.1 E2對CTH誘導HUVECs活力降低的影響
CTH處理后15、30、45、60 min,CTH組的A490值均明顯低于對照組(P<0.05),E2組的A490值均明顯高于CTH組(P<0.05),見表1。

表1 3組HUVECs活力A490值比較
2.2 E2對CTH誘導HUVECs中炎癥反應和氧化應激反應激活的影響
CTH處理后60 min,CTH組細胞培養基中IL-1β、IL-6、TNF-α、MDA水平均明顯高于對照組,SOD水平明顯低于對照組(P<0.05);E2組細胞培養基中IL-1β、IL-6、TNF-α、MDA水平均明顯低于CTH組,SOD水平明顯高于CTH組(P<0.05),見表2。

表2 3組HUVECs培養基中IL-1β、IL-6、TNF-α、MDA及SOD水平比較
2.3 E2對CTH誘導HUVECs中細胞凋亡激活的影響
CTH處理后60 min,CTH組的細胞凋亡率及細胞中cleaved caspase-3表達水平均明顯高于對照組(P<0.05);E2組的細胞凋亡率及細胞中cleaved caspase-3表達水平均明顯低于CTH組(P<0.05),見圖1。

A:細胞凋亡的TUNEL染色;B:細胞凋亡率柱狀圖;C:cleaved caspase-3蛋白條帶;D:cleaved caspase-3表達水平柱狀圖。a:P<0.05,與對照組比較;b:P<0.05,與CTH組比較。
2.4 E2對CTH誘導HUVECs中p38/NF-κB通路激活的影響
CTH處理后60 min,CTH組細胞中p-p38、p-NF-κB表達水平均明顯高于對照組(P<0.05);E2組細胞中p-p38、p-NF-κB表達水平均明顯低于CTH組(P<0.05),見圖2。

A:p38/NF-κB通路相關蛋白的蛋白條帶;B:p-NF-κB表達水平柱狀圖;C:p-p38表達水平柱狀圖;a:P<0.05,與對照組比較;b:P<0.05,與CTH組比較。
2.5 p38激動劑對E2改善CTH誘導HUVECs中p38/NF-κB通路激活的影響
CTH處理后60 min,DMSO+CTH組細胞中p-p38、p-NF-κB表達水平均高于DMSO組(P<0.05);DMSO+E2組細胞中p-p38、p-NF-κB表達水平均明顯低于DMSO+CTH組(P<0.05);P79350+E2組細胞中p-p38、p-NF-κB表達水平均明顯高于DMSO+E2組(P<0.05),見圖3。

A:p38/NF-κB通路相關蛋白的蛋白條帶;B:p-p38表達水平柱狀圖;C:p-NF-κB表達水平柱狀圖;a:P<0.05,與DMSO組比較;b:P<0.05,與DMSO+CTH組比較;c:P<0.05,與DMSO+E2組比較。
2.6 p38激動劑對E2改善CTH誘導HUVECs活力降低的影響
CTH處理后15、30、45、60 min,DMSO+CTH組的A490值均明顯低于DMSO組(P<0.05),DMSO+E2組的A490值均明顯高于DMSO+CTH組(P<0.05),P79350+E2組的A490值均明顯低于DMSO+E2組(P<0.05),見表3。

表3 4組HUVECs活力A490值比較
2.7 p38激動劑對E2改善CTH誘導HUVECs中炎癥反應和氧化應激反應激活的影響
CTH處理后60 min,DMSO+CTH組細胞培養基中IL-1β、IL-6、TNF-α、MDA水平均明顯高于DMSO組,SOD水平明顯低于DMSO組(P<0.05);DMSO+E2組細胞培養基中IL-1β、IL-6、TNF-α、MDA水平均明顯低于DMSO+CTH組,SOD水平明顯高于DMSO+CTH組(P<0.05);P79350+E2組細胞培養基中IL-1β、IL-6、TNF-α、MDA水平均明顯高于DMSO+E2組,SOD水平明顯低于DMSO+E2組(P<0.05),見表4。

表4 4組HUVECs培養基中IL-1β、IL-6、TNF-α、MDA及SOD水平比較
2.8 p38激動劑對E2改善CTH誘導HUVECs中細胞凋亡激活的影響
CTH處理后60 min,DMSO+CTH組的細胞凋亡率及細胞中cleaved caspase-3表達水平均明顯高于DMSO組(P<0.05);DMSO+E2組的細胞凋亡率及細胞中cleaved caspase-3表達水平均明顯低于DMSO+CTH組(P<0.05);P79350+E2組的細胞凋亡率及細胞中cleaved caspase-3表達水平均明顯高于DMSO+E2組(P<0.05),見圖4。

A:細胞凋亡的TUNEL染色;B:細胞凋亡率柱狀圖;C:ceaved caspase-3的蛋白條帶;D:cleaved caspase-3表達水平柱狀圖;a:P<0.05,與DMSO組比較;b:P<0.05,與DMSO+CTH組比較;c:P<0.05,與DMSO+E2組比較。
3 討 論
組蛋白是一種在細胞核內與DNA互相結合形成核小體的核蛋白,在不同病理因素刺激下組蛋白異常釋放進入細胞外并產生細胞毒性。近些年,多項膿毒癥相關的研究證實細胞外組蛋白的產生與疾病病情及預后相關[3-4],但相關的分子機制及防治手段尚不清楚。在膿毒癥發生、發展的過程中,血管內皮細胞損傷與病情加重及全身多個臟器功能損傷有關,細胞外組蛋白的細胞毒性作用可能是膿毒癥病程中引起內皮損傷的關鍵因素[11]。有多項細胞研究通過大劑量組蛋白短時間沖擊處理,即200 μg/mL CTH處理1 h的方式誘導血管內皮細胞發生損傷[6,12]。
本研究采用0.1 mmol/L E2預處理HUVECs,200 μg/mL CTH處理15、30、45、60 min后細胞的A490值明顯降低,與既往研究中CTH誘導內皮細胞損傷的實驗結果吻合[6,12]。膿毒癥發病過程中炎癥反應、氧化應激反應及細胞凋亡的過度激活是與多器官功能障礙、內皮細胞損傷直接相關的因素[13-14]。本研究在CTH誘導HUVECs損傷模型中檢測到培養基中炎癥因子IL-1β、IL-6、TNF-α及氧化應激產物MDA水平均升高,抗氧化酶SOD水平降低,同時細胞凋亡率及細胞中凋亡基因cleaved caspase-3表達水平升高,與膿毒癥發病過程中炎癥反應、氧化應激反應及細胞凋亡激活的特點吻合[13-14]。以此為基礎,本研究將繼續在CTH誘導HUVECs損傷模型中以炎癥反應、氧化應激反應及細胞凋亡為切入點研究相關的分子機制及防治手段。
E2是具有心血管保護作用的性激素,在多種病理因素引起內皮細胞損傷的模型中發揮保護作用,對內皮細胞在病理狀態下的炎癥反應、氧化應激反應及細胞凋亡均具有抑制作用[15-16]。本研究在CTH誘導HUVECs損傷前進行E2預處理,E2預處理后給予CTH 15、30、45、60 min時細胞的A490值均明顯增加,表明E2對CTH誘導HUVECs損傷具有改善作用。進一步分析炎癥反應、氧化應激反應及細胞凋亡可知:E2預處理后CTH誘導HUVECs損傷模型中IL-1β、IL-6、TNF-α、MDA的生成,凋亡率及cleaved caspase-3表達水平均降低,SOD水平升高,表明E2在改善CTH誘導HUVECs損傷時發揮了抗炎、抗氧化、抗凋亡的作用,與既往研究中有關E2生物學特性的報道一致[15-16],也與本研究已經觀察到E2減輕CTH誘導HUVECs損傷的作用吻合。
根據國內曹清等[6]研究中細胞實驗結果,CTH誘導HUVECs損傷與激活NF-κB和p38通路有關。p38屬于絲裂原活化蛋白激酶(MAPK)家族,發生磷酸化后生成有活性的p-p38,后者能夠引起下游NF-κB發生磷酸化并參與炎癥反應、氧化應激反應及細胞凋亡的調控[17]。已有多項研究證實,E2的心腦血管保護作用與抑制p38及NF-κB的磷酸化有關[9-10,18],本研究在CTH誘導HUVECs損傷的模型中檢測到p-p38及p-NF-κB的表達水平增加,符合NF-κB和p38激活的特點;E2預處理后,p-p38及p-NF-κB的表達水平降低,表明E2在CTH誘導HUVECs損傷模型中抑制NF-κB和p38的激活。進一步通過使用p38激動劑P79350與E2聯合預處理的方式驗證p38/NF-κB通路在E2減輕CTH誘導HUVECs損傷中的作用,加用p38激動劑后,E2預處理減輕細胞損傷、炎癥反應、氧化應激反應及細胞凋亡的作用被削弱,表明E2改善CTH誘導HUVECs損傷的作用部分與抑制p38/NF-κB通路有關。
綜上所述,本研究通過一系列細胞實驗證實E2具有改善CTH誘導內皮細胞損傷的作用,這一改善作用與抑制p38/NF-κB通路介導的炎癥反應、氧化應激及細胞凋亡有關。以上結果為今后深入認識細胞外組蛋白誘導內皮細胞損傷的分子機制及防治手段提供了依據,E2可能作為細胞外組蛋白誘導內皮細胞損傷的防治藥物,p38/NF-κB通路則有望成為研究細胞外組蛋白誘導內皮細胞損傷分子機制的靶點。

