2 型糖尿病患者血清IL-1β、MCP-1 的表達及其與胰島素抵抗發生的關系
張燕 徐清芳 胡冬梅 王青梅
(駐馬店市第一人民醫院檢驗科,河南 駐馬店 463000)
2 型糖尿病(Diabetes mellitus type 2,T2DM)是由于胰島素分泌不足或胰島素抵抗(Insulin resistance,IR)導致的血糖升高的慢性疾病。胰島β 細胞功能異常與IR 是T2DM 發病與進展的基本環節。在T2DM 初期,胰島β 細胞通過增加分泌量來適應機體升高的血糖,而長期的高血糖會對胰島β 細胞產生較強的負擔,且葡萄糖毒性作用可通過慢性氧化應激反應作用于胰島β 細胞,損傷胰島β 細胞正常功能,從而造成胰島素分泌量減少,繼而加重機體高血糖狀況,促進疾病進展。可造成冠心病、腦血管疾病等并發癥的發生,危及患者生命安全。因此,早期尋找相關指標評估T2DM 患者IR 程度,并采取有效的治療方案對控制病情發展、改善患者的預后尤為重要。
研究顯示,糖尿病發病的過程與炎癥反應密切相關。白細胞介素-1β(Interleukin-1β,IL-1β)是典型的促炎因子,介導炎癥反應的產生[1]。單核細胞趨化蛋白1(Monocyte chemotactic protein 1,MCP-1)是一種重要的趨化因子,可趨化單核細胞、T 淋巴細胞,促使各種炎性細胞向病變部位聚集,對炎癥因子的刺激作出應答[2]。
因此血清IL-1β、MCP-1 與T2DM 患者IR 可能存在一定聯系。本研究通過對不同IR 程度T2DM 患者進行血清IL-1β、MCP-1 水平檢測,旨在探討血清IL-1β、MCP-1 水平與T2DM 患者IR程度的相關性。現報告如下。
1 資料與方法
1.1 臨床資料
選取2019 年1 月-2020 年8 月期間本院收治的T2DM 患者作為研究對象。其中男48 例,女44 例;年齡40-67,平均(53.94±3.82)歲,病程4-13 y,平均(8.57±1.45) y;其中吸煙史33 例,飲酒史31 例,糖尿病家族史26 例。本研究符合醫院醫學倫理委員會審核要求。
納入標準:符合T2DM 中相關診斷標準[3],且經口服葡萄糖耐量試驗確診;無T2DM 急性與慢性并發癥,如糖尿病視網膜病變、糖尿病腎病等;近期無急慢性感染;患者或家屬均知情并簽訂同意書;精神正常,可配合完成調查;排除標準:患有精神疾病者;合并自身免疫系統疾病者;合并肝腎等重要器官功能障礙者;有糖皮質激素、免疫抑制劑等特殊用藥史者;伴有嚴重全身性疾病者;合并高血壓、冠心病、高脂血癥等基礎疾病者。
1.2 方法
1.2.1 胰島素抵抗評估方法
治療過程中,根據患者每日需要補充的胰島素總劑量(TDID)進行分組[3],分為:IR[TDID 在1-2 U(kg·d)-1]、嚴重IR[TDID 在2-3 U(kg·d)-1]、極度IR[>3 U(kg·d)-1]。
1.2.2 基線資料采集方法
設計基線資料調查表,調查表克倫巴赫系數為0.831。調查內容主要有患者性別(男、女)、年齡、病程、吸煙史(有、無)、飲酒史(有、無)、糖尿病家族史(有、無)、體質量指數(Body Mass Index,BMI)。其中吸煙史判定標準:每日吸煙至少1 支,連續吸煙6 m 及以上,或一生中吸煙數量≥100 支,且仍在吸煙;飲酒史判定標準:每周至少飲酒1 次,持續1 y 以上,或每周飲用酒精量超過30 g 且持續1 y 以上。
1.2.3 血清IL-1β、MCP-1 水平及空腹血糖檢測方法
采集患者入院當天空腹外周肘靜脈血6 mL分裝2 管,每管各3 mL,其中1 管以3500 r·min-1 速率離心5 min,離心半徑10 cm,取血清,應用化學發光免疫分析法檢測血清IL-1β 水平,試劑盒由湖南華曦醫藥有限公司提供,采用酶標免疫分析法檢測血清MCP-1 水平,試劑盒由上海圻明生物科技有限公司提供。另一管采用半自動生化分析儀(深圳市盛信康科技有限公司,粵食藥監械(準)字2013 第2400525 號,型號:SK3002B)測定空腹血糖水平。
根據試劑盒及儀器說明進行所有操作。
1.3 統計學方法
數據采用SPSS23.0 統計學軟件,計數資料以百分數和例數(%、n)表示,用χ2檢驗;經Shapiro-Wilk 正態性檢驗檢驗計量資料正態性,以(±SD)表示符合正態分布計量資料,采用單因素方差檢驗分析多組間比較,采用SNK-q檢驗組間兩兩比較,應用雙變量Kendall’s tau-b 直線相關檢驗血清IL-1β、MCP-1 水平與T2DM 患者IR 的相關性,以P<0.05 為差異有統計學意義。
2 結果
2.1 T2DM 患者IR 情況
92 例T2DM 患者中,IR 組40 例,占43.48%(40/92),嚴重IR34 例,占36.96%(34/92),極度IR18 例,占19.57%(18/92)。
2.2 一般資料及血清IL-1β、MCP-1 水平對比
極度IR 組血清IL-1β、MCP-1 水平最高,嚴重IR 組其次,IR 組最低,三組組間比較,差異有統計學意義(P<0.05);三組性別、年齡、病程、吸煙史、飲酒史、糖尿病家族史、BMI、空腹血糖比較,差異無統計學意義(P>0.05)。見表1。
2.3 血清IL-1β、MCP-1 水平與T2DM 患者IR 的相關性
經雙變量Kendall’s tau-b 相關檢驗,結果顯示,T2DM 患者IR 與血清IL-1β、MCP-1 呈正相關(r>0,P<0.05)。見表2。
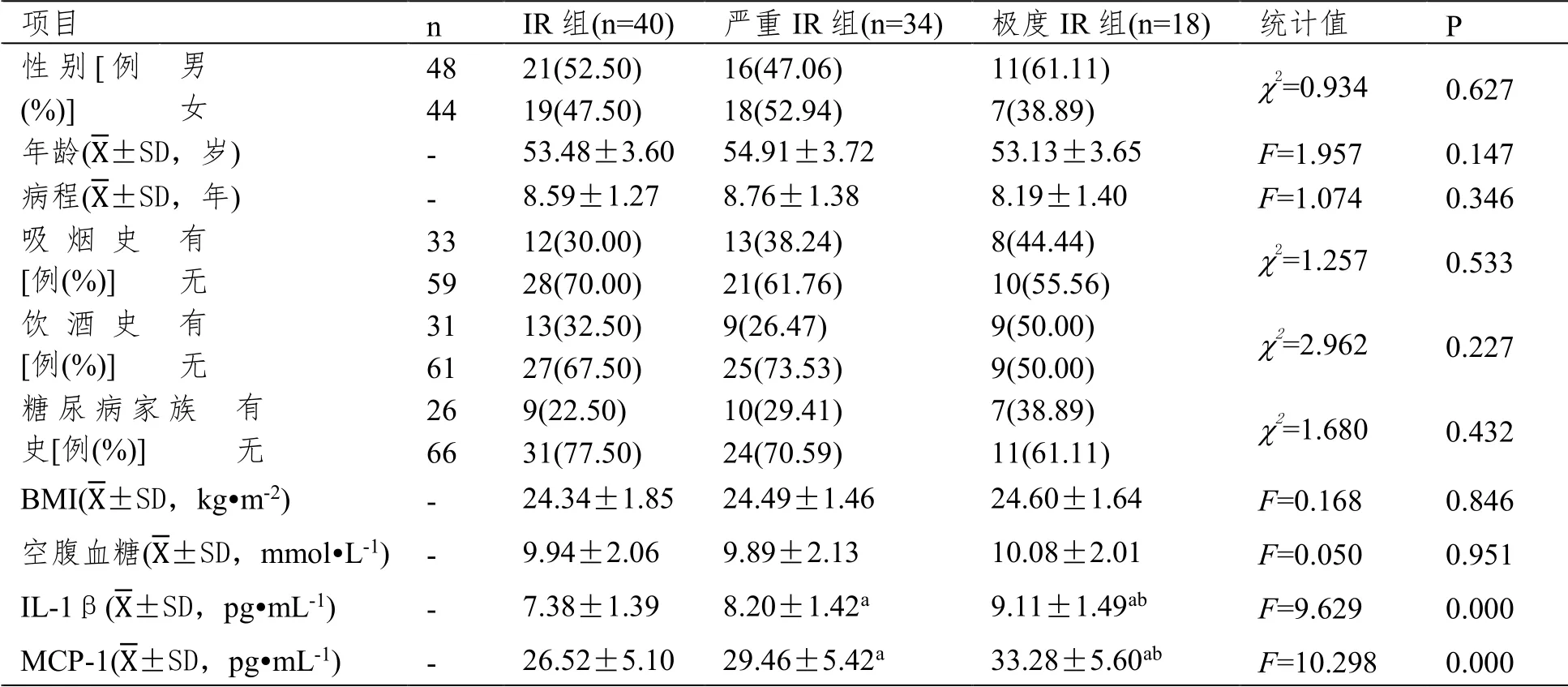
表1 三組一般資料及血清IL-1β、MCP-1 水平比較

表2 血清IL-1β、MCP-1 水平與T2DM 患者IR 的相關性分析
3 討論
T2DM 患者常處于一種慢性低度炎癥狀態,機體在糖、脂毒性等代謝應激反應狀態下可促使脂肪組織產生大量細胞因子,這些因子與炎癥產物廣泛參與胰島β 細胞的功能紊亂,導致T2DM患者多伴有不同程度的IR。本研究92 例T2DM患者中,IR40例(43.48%),嚴重IR34例(36.96%),極度IR18 例(19.57%),可見多數患者IR 較為嚴重,臨床需加以重視。
IL-1β 是巨噬細胞產生的IL-1 的β 亞型,是最重要的促細胞凋亡及促炎細胞因子,可刺激參與炎性反應與免疫反應過程[4]。MCP-1 是CC 亞家族的成員之一,可趨化單核巨噬細胞、T 淋巴細胞,促進炎性介質、細胞因子的合成與分泌,在慢性炎癥中發揮重要作用[5]。而慢性炎癥被認為是導致T2DM 患者IR 的重要原因之一。因此推測IL-1β、MCP-1 可能與T2DM 患者IR 存在一定關系。
本研究中極度IR 組血清IL-1β、MCP-1 水平最高,嚴重IR 組其次,IR 組最低,可見T2DM患者IR 越嚴重,血清IL-1β、MCP-1 水平越高。且經雙變量Kendall’s tau-b 相關檢驗,結果顯示,T2DM 患者IR 與血清IL-1β、MCP-1 呈正相關。究其原因在于,T2DM 患者胰島β 細胞長期在高糖環境下,會刺激IL-1β 的高表達;IL-1β 水平的升高可進一步誘導胰島β 細胞釋放一氧化氮合酶,促進一氧化氮生成。大量的一氧化氮會直接導致胰島β 細胞損傷。同時一氧化氮還可抑制三羧酸循環,降低三磷酸腺苷生成,損傷胰島β 細胞,造成IR。且β 細胞損傷越嚴重,胰島功能越差,導致IR 水平越嚴重[6]。MCP-1 水平的升高可使單核細胞、NF-κB、JNK 等途徑被激活,增加炎性因子IL-1、IL-6、干擾素γ 等的釋放,提高巨噬細胞黏附因子水平,刺激嗜堿性粒細胞對組織胺的釋放,從而產生靶細胞效應。同時能限制抑制胰島素介導的葡萄糖攝取,抑制脂肪細胞中脂質的聚集與過氧化物酶體的受體y、葡萄糖轉運蛋白4 的表達,促進IR 的發生與加重[7]。此外,MCP-1 的升高還可下調脂肪組織中的脂蛋白酯酶,促進脂肪分解、游離脂肪酸升高,促使脂肪細胞退變,加重IR[8]。而IR 的加重又會促使胰島素與胰島素受體相結合,誘導脂肪細胞表達MCP-1,進一步促進血清MCP-1 水平異常升高,從而形成惡性循環,加重機體IR 程度。
綜上所述,血清IL-1β、MCP-1 與T2DM 患者IR密切相關,臨床可早期檢測血清IL-1β、MCP-1 水平,以及時評估T2DM 患者IR 情況,為后續治療方案的制定提供指導。

