刺參腐皮綜合征病原菌的分離鑒定及特性分析
李曉宇,馮麗娟,徐 樂,王麗麗,張美霞,李淑英,李紀彬,徐永平
( 1.大連理工大學 生物工程學院,遼寧 大連 116024;2.動物性食品安全保障技術教育部工程研究中心,遼寧 大連116600;3.遼寧省噬菌體應用專業技術創新中心,遼寧 大連 116600;4.大連賽姆生物工程技術有限公司,遼寧 大連 116600 )
仿刺參(Apostichopusjaponicus),因其富含膠原、黏多糖、生物活性肽等生物活性物質,具有增強機體免疫能力、抗氧化、抗腫瘤、降血壓、抗炎癥、抗凝血等生理功效,在開發新食品和生物醫藥等領域顯示出巨大潛力,已經成為全球范圍內備受青睞的減少疾病發生和促進人體健康的食物之一[1]。目前,我國仿刺參年產量約20萬t,直接經濟效益高達300億元,全產業鏈超過1000億元,形成了以“遼參”、“膠東刺參”、“南方刺參”為特色的遼寧、山東、福建三大仿刺參產區[2]。
但仿刺參養殖的快速擴張和集約化導致了各種病害頻繁發生,造成了巨大經濟損失,已成為該行業可持續發展的限制因素之一。其中,刺參腐皮綜合征自2003年于山東榮成市首次被報道以來,因其急性發病、高傳染性及死亡率的特點,被認為是最常見和最嚴重的仿刺參疾病,引起了國內外學者的高度關注[3]。大量研究表明,該病發病機理較復雜,是由多種因素的綜合作用所致,主要包括細菌、真菌和寄生蟲,其中細菌是最主要的病原體,寄生蟲和真菌次之[4]。發病初期一般以細菌感染為主,繼發產生霉菌、寄生蟲感染從而加劇仿刺參的死亡。此外,導致發病的致病菌存在多樣性和地域性特點[5]。在遼寧地區,可能的細菌病原有燦爛弧菌(Vibriosplendidus)、黃海希瓦氏菌(Shewanellamarisflavi)、溶藻弧菌(V.alginolyticus)、哈維氏弧菌(V.harveyi)、副溶血弧菌(V.parahaemolyticus)、假交替單胞菌(Pseudoalteromonasnigrifaciens)以及蠟樣芽孢桿菌(Bacilluscereus)等;在山東地區,燦爛弧菌、溶藻弧菌、中間氣單胞菌(Aeromonasmedia)以及假交替單胞菌等均已被證實是致病菌;南方地區主要集中在燦爛弧菌、假交替單胞菌以及塔式弧菌(V.tubiashii)等[6-7]。2019年3月,大連地區某刺參養殖場仿刺參出現搖頭、排臟、體壁大面積潰瘍等病害癥狀。為明確該病癥出現的原因,筆者自患病仿刺參病灶處分離病原菌并鑒定,對其致病性、毒力基因及藥物敏感性進行分析,以期為大連地區仿刺參細菌性疾病的研究及防控提供一定的病原學依據。
1 材料與方法
1.1 試驗材料
患病仿刺參及回接感染試驗所用健康仿刺參均由遼寧大連普蘭店某刺參養殖場提供,健康仿刺參在實驗室環境下砂濾海水中暫養14 d。溶解氧≥5 mg/L,溫度(16±1) ℃,鹽度30~32,pH 8.0±0.3,每日按體質量的3%投喂餌料1次,次日吸底排污。
2216E瓊脂培養基、硫代硫酸鹽—檸檬酸鹽—膽鹽—蔗糖(TCBS)瓊脂培養基購于青島高科技工業園海博生物技術有限公司;藥敏紙片購于杭州微生物試劑有限公司;細菌基因組DNA提取試劑盒購于北京索萊寶科技有限公司;PCR擴增所用引物由生工生物工程(上海)股份有限公司合成,PCR擴增所用其他試劑均購于該公司。
1.2 方法
1.2.1 病原菌的分離純化及形態學觀察
將有明顯潰瘍癥狀的仿刺參體壁、沙嘴等部位于無菌條件下通過棉棒蘸取或勻漿處理,磷酸緩沖鹽溶液(PBS)梯度稀釋后劃線或涂布接種至TCBS瓊脂培養基和2216E瓊脂培養基上,28 ℃連續培養12~24 h。經多次分離純化獲得單一菌株(編號為AP-1),觀察其在不同培養基上的菌落特征。同時,采用透射電子顯微鏡(JEM-2000EX)于加速電壓120 kV條件下觀察負染色后的細菌形態特征。
1.2.2 人工回接感染試驗
選取體質量(12±1) g的健康仿刺參隨機分組,每組20頭。整個試驗期間除不投餌料外,其他條件均不變。將病原菌經活化、擴大培養及離心后的菌泥用磷酸緩沖鹽溶液進行重懸,通過平板涂布法計算菌懸液中菌落數目,之后將菌懸液梯度稀釋至105~109數量級(cfu/mL),于4 ℃備用。人工回接感染試驗采用以下3種攻毒方式進行:
腹腔注射攻毒:試驗組腹腔注射密度分別為109、108、107、106數量級和105數量級的菌懸液(cfu/mL),每頭100 μL;對照組注射等體積的無菌磷酸緩沖鹽溶液。
體壁創傷浸浴攻毒:用鋒利的無菌刀片在每頭仿刺參體壁上分別劃1~2個長0.2~0.3 cm、深0.1 cm的傷口。試驗組將水箱中海水菌液終密度(cfu/mL)分別調至109、108、107、106和105數量級,共5組;對照組為等體積海水。
浸浴攻毒:不對仿刺參造成任何損傷,其他條件同上,不做任何改動。
攻毒結束后,記錄10 d內各組仿刺參生存狀態及發病率,通過Prism Graphpad 5.0軟件分析繪制仿刺參的生存曲線并通過改良寇氏法計算半數致死劑量(LD50)及半數致死密度(LC50)。同時,再次進行細菌的分離以驗證是否為同株致病菌,并取患病仿刺參潰瘍體壁組織制備石蠟切片,通過蘇木精—伊紅染色,觀察仿刺參體壁組織的病理學變化。
1.2.3 16S rDNA及生理生化鑒定
根據細菌基因組DNA提取試劑盒說明書提取菌株AP-1基因組DNA即PCR擴增模板。PCR反應體系(25 μL):上、下游引物(27F:5′-AGAG TTTGATCCTGGCTCAG-3′;1492R:5′-TACGG CTACCTTGTTACGACTT-3′)各1 μL,DNA模板1 μL,預混液12.5 μL,雙蒸水9.5 μL。擴增程序:94 ℃預變性5 min;94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸1.5 min,35個循環;72 ℃終延伸10 min。擴增產物通過1%瓊脂糖凝膠電泳檢測后送至生工生物工程(上海)股份有限公司進行DNA測序。將測序結果在美國國家生物技術信息數據庫中進行BLAST比對,選擇與分離株同源性較高的DNA序列,通過MEGA 10.0軟件采用鄰位歸并法構建系統發育樹。
通過VITEK 2 Compact 全自動細菌鑒定分析系統(法國生物梅里埃公司)對菌株AP-1進行生理生化指標的檢測。
1.2.4 致病菌毒力相關基因檢測
對分離菌株的毒素表達調控蛋白(toxR)基因、鞭毛蛋白(FlaA)基因、膠原蛋白酶(Collagenase)基因、外膜蛋白(ompW)基因、鐵攝取調節(fur)基因、堿性絲氨酸蛋白酶(AspA)基因、溶血素(tlh)基因等7種毒力相關基因進行PCR擴增,引物設計參考魏霜等[8-9]相關研究(表1)。PCR反應體系同上。擴增程序:94 ℃預變性5 min;94 ℃變性30 s,59 ℃退火1 min,72 ℃延伸30 s,30個循環;72 ℃終延伸10 min。對PCR擴增結果進行1%瓊脂糖凝膠電泳檢測。

表1 PCR擴增所用引物序列及擴增產物長度Tab.1 Primer sequence and length of PCR products
1.2.5 藥敏分析
選用不同類型的27種抗生素藥敏片對分離株進行藥物敏感性檢測,具體操作及判定參考美國臨床實驗室標準化協會(CLSI)的執行標準[10-11]。
2 結果與分析
2.1 病原菌的分離及形態觀察
取樣患病仿刺參的癥狀表現為攝食量明顯減少,附壁能力減弱,排臟,且有明顯的潰爛(圖1)。經分離純化后,優勢菌株AP-1在TCBS瓊脂培養基上呈現亮黃色,大小中等,圓形隆起、表面光滑、邊緣整齊,略黏稠且不易被挑起,周邊呈淡黃色環形光暈(圖2a)。此外,改變培養基的瓊脂密度,菌落形態會發生一定變化。在瓊脂密度為1.5%的2216E固體培養基上不易形成單菌落,黏稠,邊緣不清晰,呈彌散狀態(圖2b);當瓊脂比例增至5%后,與在TCBS瓊脂培養基上形態一致,但菌落四周有明顯的透明樣暈圈(圖2c)。

圖2 優勢菌株AP-1在不同培養基上的菌落形態Fig.2 Colony morphology of dominant strain AP-1 on different mediaa.TCBS培養基;b.瓊脂密度為1.5%的2216E培養基;c.瓊脂密度為5%的2216E培養基.a.TCBS medium;b.2216E medium with 1.5% agar density;c.2216E medium with 5% agar density.
經負染色后,透射電子顯微鏡下觀察到菌株AP-1呈棒狀,大小約為1.4 μm,具有極生單鞭毛,兩端鈍圓(圖3)。
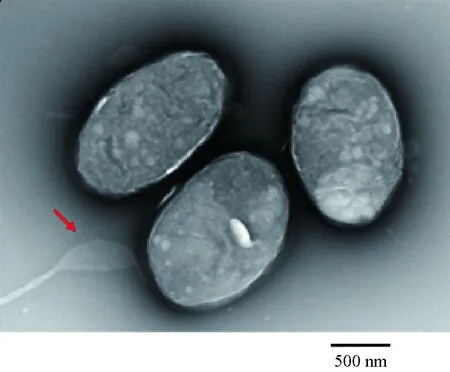
圖3 優勢菌株AP-1透射電鏡圖(負染色)Fig.3 Transmission electron micrograph of dominant strain AP-1 (negative staining)
2.2 人工回接感染試驗
人工回接感染試驗結果表明:浸浴攻毒仿刺參全部存活且未出現病變癥狀;腹腔注射和體壁創傷浸浴感染2種攻毒方式的仿刺參出現致死現象,且呈現劑量依賴性死亡特征,即密度越高死亡率越高(圖4)。在腹腔注射攻毒試驗中,中高劑量組(>9.75×105cfu/g)仿刺參全部死亡,應用改良寇氏法,通過數據計算得出半致死劑量為3.08×104cfu/g;在體壁創傷浸浴攻毒試驗中,第2天便有仿刺參死亡,菌液密度為1.17×108~1.17×109cfu/mL時死亡率達100%,且半致死密度為5.23×106cfu/mL。
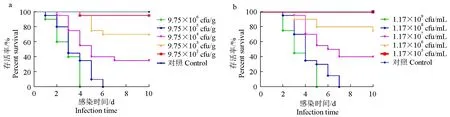
圖4 菌株AP-1攻毒后的仿刺參累積死亡率Fig.4 Cumulative mortality of sea cucumber A. japonicus exposed to challenged with strain AP-1a.腹腔注射攻毒;b.體壁創傷浸浴攻毒.a.intraperitoneal injection infection;b.body wall wound immersion infection.
攻毒期間,仿刺參患病初期時有明顯的搖頭行為,排臟吐腸,附著力下降,體壁出現針尖狀白點;中期癥狀為仿刺參均沉于底部,不能貼壁,出現大量的潰瘍斑點;末期仿刺參死亡,自溶為鼻涕狀膠體,其癥狀與自然發病相同(圖5)。觀察仿刺參體壁的石蠟切片可以看到,與正常體壁相比,患病組織存在明顯的組織病理學變化,其表皮的角質層明顯缺失且不連續,結締組織不再緊密有序,出現大量空洞和纖維樣病變(圖6)。
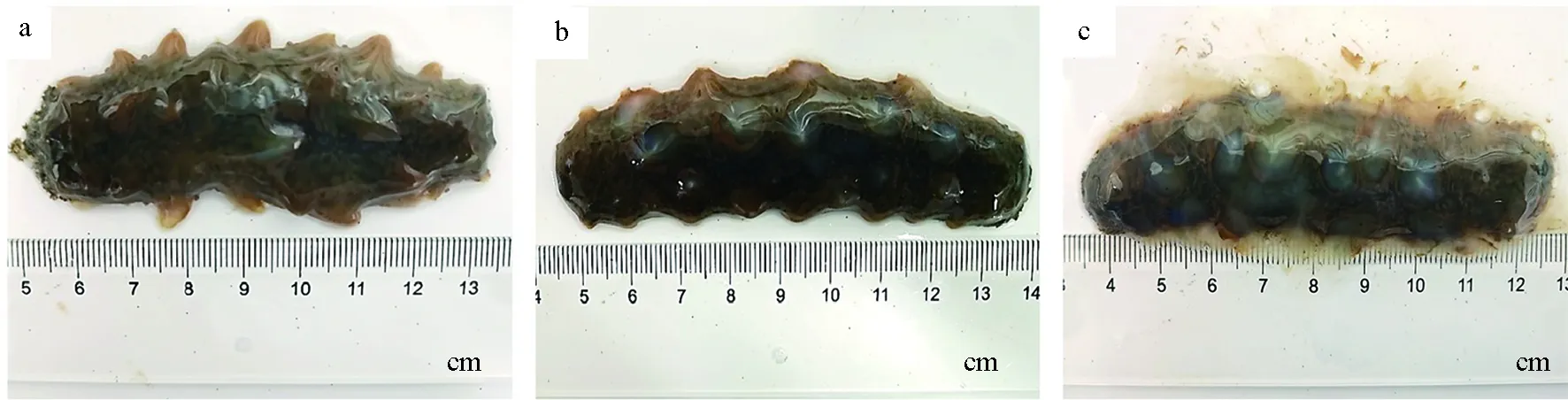
圖5 人工回接感染后患有腐皮綜合征的仿刺參癥狀Fig.5 Symptom of sea cucumber A. japonicus with skin ulceration syndrome exposed to challengeda.初期;b.中期;c.末期.a.initial stage;b.intermediate stage;c.final stage.

圖6 人工回接感染患刺參腐皮綜合征的體壁病理變化Fig.6 Pathological changes in the body wall of sea cucumber A. japonicas with skin ulceration syndrome caused by artificial reinfectiona.正常;b.患病;C.角質層;EP.上皮細胞;CT.結締組織;箭頭為組織病變.a.normal;b.diseased;C.cuticle;EP.epithelial cell;CT.connective tissue;arrow shows tissue lesions.
2.3 16S rDNA及生理生化鑒定
2.3.1 分離株16S rDNA鑒定及系統發育樹的構建
經測序,菌株AP-1擴增得到的16S rDNA片段長度為1470 bp,并與美國國家生物技術信息中心數據庫中的相關序列進行BLAST比對,菌株AP-1系弧菌屬,與溶藻弧菌同源性高達99%。選擇與其同源性較高的序列進行系統發育樹構建,結果顯示,菌株AP-1與溶藻弧菌ATCC 17749(GenBank登錄號:NR_117895.1)和NBRC 15630(GenBank登錄號:NR_113781.1)聚為一支(圖7)。

圖7 基于16S rDNA構建的系統發育樹Fig.7 Phylogenetic tree based on 16S rDNA
2.3.2 致病菌的生理生化鑒定
通過GN鑒定卡分析比對可知,該菌株被鑒定為溶藻弧菌的可信度為97%(表2)。結合16S rDNA鑒定結果,進一步確定菌株AP-1為溶藻弧菌。同時,對回接感染后分離菌株再次驗證,結果表明為同一株菌。

表2 菌株AP-1的生理生化鑒定結果Tab.2 Physiological and biochemical identification results of strain AP-1
2.4 致病菌毒力相關基因檢測
通過對目的片段的PCR擴增產物進行電泳檢測得出,菌株AP-1攜帶有toxR、FlaA、Collagenase、fur、AspA、ompW和tlh共7種毒力相關基因(圖8)。

圖8 菌株AP-1毒力相關基因的PCR檢測Fig.8 PCR detection of virulence related genes of strain AP-1M.Marker;1.toxR;2.FlaA;3.Collagenase;4.fur;5.AspA;6.ompW;7.tlh.
2.5 藥敏試驗結果
對臨床和水產常用的27種抗生素敏感性的檢測結果(表3)表明:溶藻弧菌AP-1對氨芐西林、哌拉西林、奧格門汀、頭孢唑林、頭孢噻肟及阿米卡星6種抗生素耐藥;對頭孢呋辛、頭孢西丁、氯霉素、氨曲南和新霉素5種抗生素表現為中介;對其他16種受試抗生素均敏感。
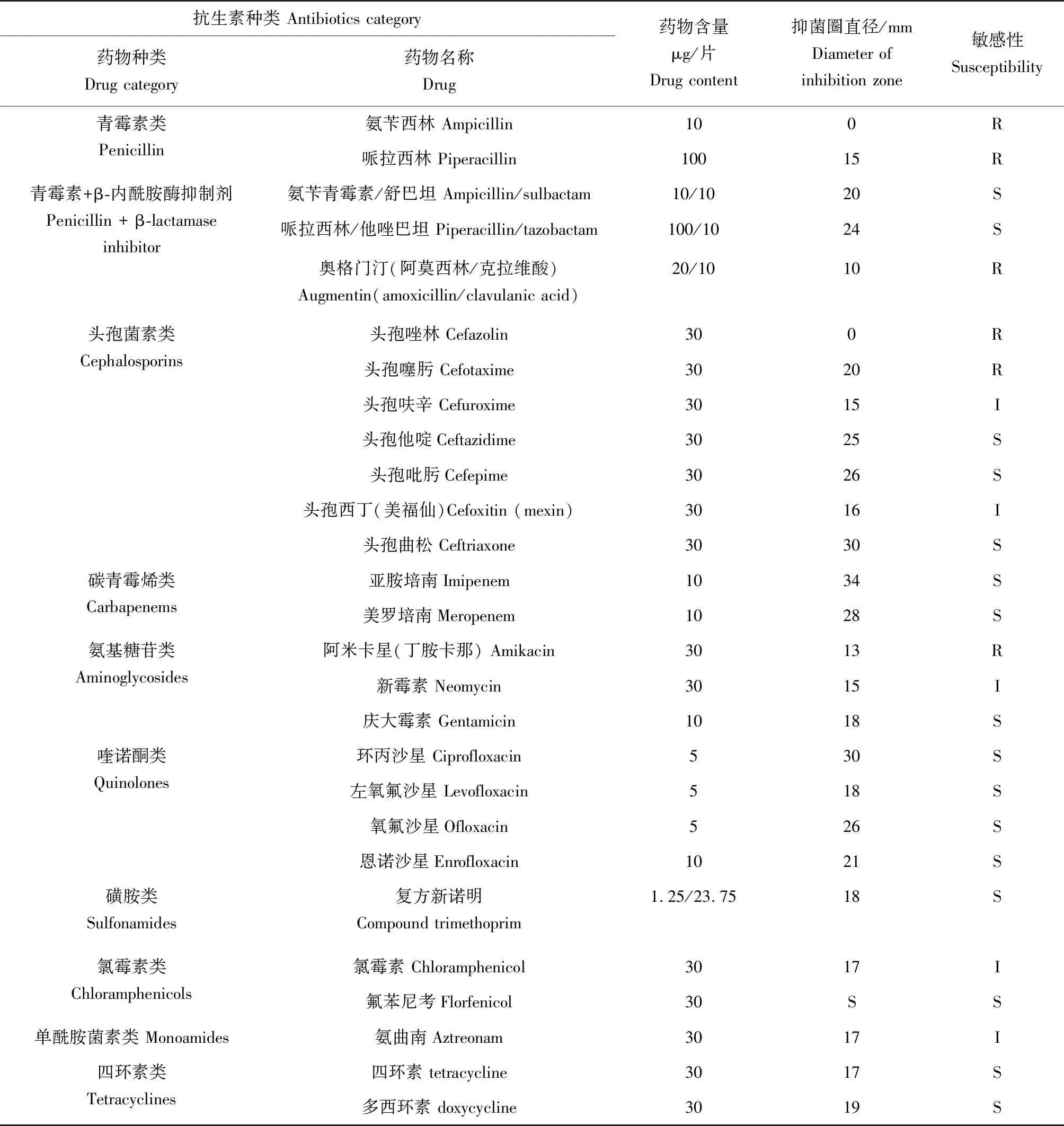
表3 AP-1菌株藥物敏感性試驗結果Tab.3 Antibiotic susceptibility of the strain AP-1
3 討 論
3.1 病原菌的分離鑒定及致病性
目前,細菌性疾病是報道最多的仿刺參疾病,也是實際養殖生產過程中危害最嚴重的疾病[12]。筆者從患病仿刺參病灶處分離獲得1株優勢菌株AP-1,人工回接感染后與自然發病癥狀一致,再次對病灶處進行致病菌的分離鑒定,結果顯示為同一株溶藻弧菌,證實其為刺參腐皮綜合征的致病菌,符合科赫法則的驗證方法。
溶藻弧菌是世界范圍內河口及沿海海洋生態系統中普遍存在的條件致病菌,可感染海洋環境中的多種宿主,包括魚類、甲殼類和貝類等動物,限制了水產養殖業的發展[13]。此外,也可能導致人患中耳炎、敗血癥及其他腸外感染等多種疾病,是沿海地區突發食物中毒及腹瀉感染的主要致病菌之一,且具有較高的水產品致病菌檢出率,對食品及公共衛生安全構成較大威脅[14]。筆者通過平板劃線觀察細菌形態特征發現,在瓊脂密度為1.5%的2216E瓊脂培養基上不易形成單菌落,而將瓊脂密度提高至5%,可形成單菌落,且菌落四周有明顯暈圈,取細菌外周的物質平板劃線,也可以得到相似的結果(文中未顯示)。導致這種現象的原因可能是溶藻弧菌生長速度快,在固體培養基中可形成周生鞭毛,具有涌動能力[15],使其菌落極易成片,而提高瓊脂密度可以使培養基硬度增加,會限制其在固體表面的涌動現象,使其不易獲取營養成分,從而形成單菌落。
人工回接感染試驗結果顯示,在攻毒方式上仿刺參浸浴感染不能出現病變癥狀且全部存活,而腹腔注射和體壁創傷浸浴感染2種攻毒方式出現明顯的死亡跡象且呈現劑量依賴性。浸浴感染未能造成異常的原因:一方面可能是仿刺參處于健康狀態時不易發病,其體腔細胞和體壁組織中存在免疫功能細胞,為抵御外來病原體的侵襲提供了機體免疫的屏障;另一方面說明溶藻弧菌對仿刺參的致病機理可能是需要在仿刺參損傷部位吸附并大量增殖,通過外、內毒素等致病因子對仿刺參體壁造成損傷,由表及里,觸發仿刺參自溶機制致其死亡,與已有文獻[6,16-18]的觀點一致。本試驗結果與楊嘉龍等[19]分離的溶藻弧菌(體壁肌肉攻毒半數致死量LD50為5.68×106cfu/頭)結果相比有所不同,其腹腔注射攻毒并無仿刺參死亡,可能與其致病力低有關。目前,遼寧地區90%的仿刺參養殖均采用池塘養殖[20],在養殖過程中經常需要“倒池”來保證適宜的密度和良好的生長環境,但這具有很高的破壞性,通常會對仿刺參體壁組織造成嚴重的機械損傷[21],而且1—3月水溫低,仿刺參處于休眠或半休眠狀態,群體抵抗力下降,加之底質惡化等問題會導致溶藻弧菌等病原菌激增,勢必會造成仿刺參細菌性疾病的大規模暴發。因此在仿刺參養殖過程中要注意水質及養殖密度,防止因操作不當導致仿刺參機體損傷,使得病原菌侵入致病害發生。
3.2 分離株的毒力基因分析
據報道,溶藻弧菌的毒力因子主要包括黏附因子(外膜蛋白、鞭毛)、胞外產物(溶血素、堿性絲氨酸蛋白酶和膠原蛋白酶等)和鐵攝取系統等[22]。張晶等[23]發現,不同來源溶藻弧菌所攜帶毒力因子的種類不同,其致病因子存在復雜性及獨特性。本試驗結果顯示,toxR、FlaA、Collagenase、fur、AspA、ompW和tlh 7種毒力相關基因均有明顯條帶,表明溶藻弧菌AP-1攜帶多種毒力因子,這可能是其致病力較強的主要原因。已有報道指出,外膜蛋白(ompW)在細菌黏附及攝鐵過程中發揮重要作用[24],FlaA是鞭毛蛋白合成所必需,在溶藻弧菌黏附宿主過程中起重要作用[25],可能為溶藻弧菌黏附于仿刺參體壁或其他部位進而侵襲提供了條件。有研究表明,膠原蛋白酶(AspA)及堿性絲氨酸蛋白酶(Collagenase)的表達量與毒力大小具有相關性[8],而仿刺參體壁主要由膠原等蛋白質組成,這2種蛋白酶的存在可能與仿刺參組織發生降解從而潰瘍相關。鐵攝取調控(fur)是病原菌自身獲得鐵元素、發揮毒性的必要條件,toxR是一種重要的毒力調控基因,影響胞外蛋白酶的分泌及生物膜的形成[26]。溶血素是與靶細胞膜上的受體結合的成孔毒素,在蛋白質水解激活后,誘導孔或通道形成,從而破壞膜通透性、滲透裂解,最終導致細胞死亡[27-28]。在該毒素存在的情況下,可能會導致仿刺參體壁組織的細胞死亡。在本試驗中,溶藻弧菌AP-1導致仿刺參致病可能是多種毒力因子綜合作用的結果,但不同毒力基因對毒力的貢獻以及基因間的內在聯系尚不明確,了解其攜帶毒力的情況,能更好地理解其致病性及傳播性。
3.3 藥敏試驗結果分析
關于弧菌抗生素耐藥性的研究發現,不同源、不同株的溶藻弧菌間的耐藥性也不盡相同。在遼寧地區食品中分離的39株溶藻弧菌主要對β-內酰胺類和大環內酯類抗生素耐藥和中介,其中對頭孢唑啉耐藥率高達57.5%、對氨芐西林為20.0%,對紅霉素為12.5%,三重耐藥菌比率達12.5%[29]。值得注意的是,溶藻弧菌是一種人和海洋動物共感染的病原菌[30],通過對溶藻弧菌AP-1藥敏檢測結果分析可知,該菌已對青霉素類、頭孢菌素類、氨基糖苷類以及氯霉素類中多種抗生素處于耐藥或中介狀態,所以在臨床和水產病害防治過程中都要避免使用此類抗生素。根據《水產養殖用藥明白紙2020年1、2號》中已批準的水產養殖用獸藥,建議優先考慮恩諾沙星、氟苯尼考、多西環素以及復方新諾明等抗生素用于防治仿刺參弧菌感染。雖然抗生素能夠高效治療疾病,但也導致了諸多問題,如海產品中藥物殘留、細菌耐藥性增加、水產養殖環境中微生物種群的破壞以及水生動物免疫系統的抑制等,且農業農村部第194號公告發布,自2020年起飼料中全面禁止添加抗生素。因此,開發高效、綠色及安全的抗生素替代品,如中草藥制劑、微生態制劑、卵黃抗體及噬菌體等,有望為由弧菌引起的刺參腐皮綜合征的防控及治療提供新思路。
4 結 論
研究表明,此次大連地區發生的刺參腐皮綜合征的病原菌為溶藻弧菌,該菌具有較強的致病性。為避免此類病害再次發生:一方面,在養殖過程中應注重水質凈化及養殖密度,避免因操作不當造成仿刺參生物體損傷;另一方面,必須加強對刺參腐皮綜合征的病原學和流行病學的研究,開發新型抗生素替代品。這樣才能更好地減少不必要的經濟損失,推動仿刺參產業的發展。

