CIC基因突變縱隔尤文樣肉瘤伴多發骨轉移1例報道并文獻復習
代賀陽,張麗霞,徐曉飛,3,陳凌云,3,薛姣姣,3,李慶霞,4△
(1.華北理工大學研究生院,河北唐山 063210;2.河北省人民醫院腫瘤四科,石家莊 050051;3.河北醫科大學研究生院,石家莊 050051;4.河北醫科大學,石家莊 050051)
尤文樣肉瘤在形態和分子上代表了一組不同類型的病變,在形態上與經典尤文肉瘤(Ewing’s sarcoma,ES)相似,免疫表型與ES有部分重疊,但缺乏ES典型的分子特征,即EWSR1-ETS融合[1]。筆者總結了1例晚期Capicua轉錄抑制因子(Capicua transcriptional repressor,CIC)基因突變縱隔尤文樣肉瘤伴多發骨轉移患者資料,現報道如下。
1 臨床資料
患者,男,58歲,因“發現左側胸壁腫物伴喘憋1周”于2020年11月25日入院。入院前1周患者偶然發現左側胸壁一核桃大小包塊,無壓痛,無皮溫改變,伴喘憋,活動后加重,影響睡眠,左側臥位可緩解。既往甲狀腺癌手術史4次,術后病理:甲狀腺乳頭狀癌。查體:左側胸壁可見約6 cm×5 cm腫物,質硬,光滑,邊界欠清,活動度差。輔助檢查:胸部CT(2020年11月23日)示:前中上縱隔軟組織團塊影(圖1B),較前增大(2020年3月16日,圖1A),考慮惡性占位。雙肺多發轉移。縱隔內多發腫大淋巴結,考慮轉移。胸骨、雙側肋骨、胸腰椎椎體及附件多發類圓形稍高密度影。骨掃描(2020年11月23日,圖1C):多發骨轉移。胸部定位CT(2020年11月30日,圖1D)示:雙肺多發轉移,前中上縱隔軟組織團塊影,較前增大。患者病情進展迅速,行1次放療后因不能平臥停止。穿刺組織(胸壁腫物)病理(圖2A、B)示:惡性腫瘤。免疫組織化學染色(圖2C、D):CK Pan(+),Vimentin(+),TTF-1(—),Tg(—),Oct3/4,CD30(—),CK7(散在少量細胞+),Ki-67(活躍區40%+),LCA(—),CD117(—),S100(個別+),HMB45(—),CgA(—),Syn(—),CD56(+),CR(—),CD34(血管+),Desmin(—),Actin(—),CD99(灶狀+),FLI-1(+),WT-1(+),CCNB3(—),CEA(—)。小圓細胞惡性腫瘤,結合免疫組織化學染色考慮尤文樣肉瘤。多次送胸腔積液病理,查見異型細胞,未見癌細胞。為控制胸腔積液,于2020年12月9日和14日行左側胸腔注入重組人血管內皮抑制素注射液90 mg聯合順鉑40 mg治療。結合指南推薦及患者情況,于12月10日和17日行長春新堿1 mg(第1、8天)聯合多柔比星脂質體40 mg的全身化療。胸壁腫物基因檢測結果(臻和科技):BRAFp.v600E突變,CIC p.E57K突變。免疫治療預測評估相關監測結果匯總:程序性死亡配體-1(PD-L1)蛋白表達檢測(圖2E):石蠟切片TPS95%CPS:95.微衛星穩定型。腫瘤突變負荷檢測結果(TMB):石蠟切片6.85個突變/Mb。人類白細胞抗原(HLA)-Ⅰ類分子基因型結果:HLA-Ⅰ(A、B、C)雜合。2020年12月27日復查胸部CT提示病情進展且胸腔積液難以控制。結合基因檢測報告于2021年1月2日給予卡瑞利珠單抗200 mg免疫治療。患者后期出現低蛋白血癥、電解質紊亂。2021年1月10日患者突發心搏驟停,搶救無效死亡。
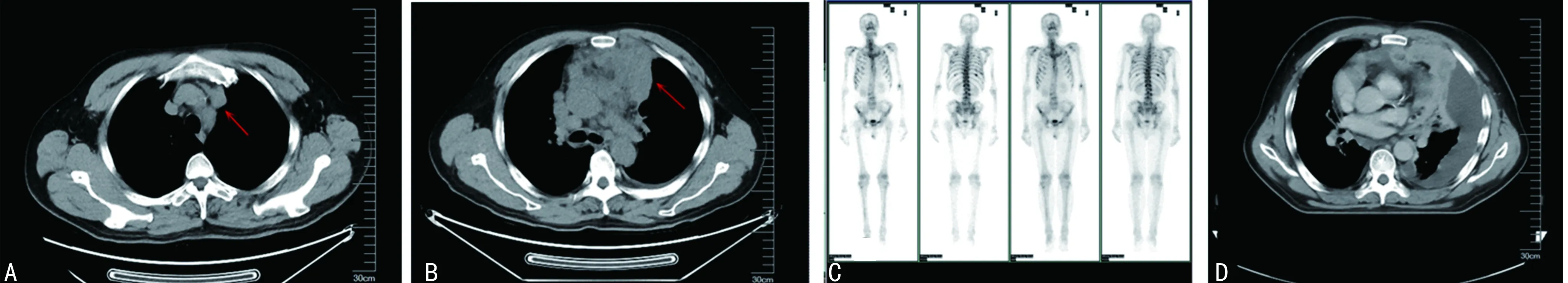
A:前中上縱隔軟組織團塊影(2020年3月16日);B:前中上縱隔軟組織團塊影增大(2020年11月23日);C:骨掃描顯示多發骨轉移(2020年11月23日);D:雙肺多發轉移,前中上縱隔軟組織團塊影,較前增大(2020年11月30日)。
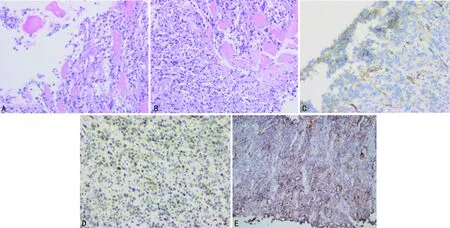
A、B:胸壁腫物活檢(HE,100×);C:CD99(灶狀+)免疫組織化學染色(100×);D:FLI-1(+)免疫組織化學染色(100×);E:PD-L1石蠟切片(200×)。
2 討 論
ES是第1個被發現具有特征性染色體異位的肉瘤。分子學檢測大部分存在EWSR1與ETS家族基因的融合,少部分存在FUS與ETS家族基因的融合[2]。尤文樣肉瘤包括4種主要病理分型:CIC重排肉瘤(CIC-rearranged round cell sarcomas,CRS)、BCOR重排肉瘤、EWSR1與非ETS家族基因重排的肉瘤和未分化小圓細胞肉瘤。BCOR重排肉瘤比CRS預后好[3]。CRS以反復出現的CIC基因重排為特征[2]。CRS比經典ES更具侵襲性,系統治療的效果更差[1]。BRI等[4]證實CRS通常出現在骨外部位,隨著轉移(主要是肺和腦)的發生,預后不良。BCOR重排肉瘤的患病率為所有未分化/未分類肉瘤的4%~14%[5]。BCOR-CCNB3融合陽性肉瘤是尤文氏肉瘤家族(Ewing’s sarcoma family of tumors,ESFT)中最常見的成員[3]。BCOR-CCNB3肉瘤更常累及骨盆、下肢和椎旁區,內臟位置極其罕見[6]。
ES診斷是基于免疫組織化學和分子遺傳分析。免疫組織化學染色有助于把ES/原始神經外胚層腫瘤(primitive neuroectodermal tumor,PNET)從其他類型的小圓腫瘤細胞中鑒別出來[7]。ESFT具有特殊的染色體易位,EWS基因和編碼ETS轉錄因子家族成員的基因融合。ES的染色體分析顯示t(11;22)(q24;q12)易位在85%的病例中產生EWS-FLI1融合蛋白,在15%的病例中通過t(21;22)(q22;q12)易位形成EWS-ERG融合蛋白[8]。GUPTA等[9]認為CD99和FLI-1標記物對ES的診斷具有較高靈敏度,但缺乏特異度。CRS和ES在免疫組織化學上均為CD99陽性。CRS通常顯示CD99為彌漫性染色,而不是強染色。此外,CRS通常表達ETV4和WT-1、ERG和FLI,而ES表達NKX2-2.6[10]。該患者免疫組織化學染色提示小圓細胞肉瘤,符合尤文樣肉瘤且存在CIC基因突變。
ES主要發生于青少年和兒童,在所有軟組織肉瘤患者中占比<1%,主要累及(約80%病例)長骨干骺端[11],骨轉移可反映原發腫瘤的進展狀態,出現骨轉移、惡性胸腔積液常提示疾病已進入晚期。JIANG等[12]研究指出骨外ES相對于骨ES具有更強的侵襲能力,發生轉移的骨外ES患者的5年生存率和整體生存率分別為24.70%和26.18%,而轉移性骨ES患者的5年生存率和整體生存率分別為31.40%和32.47%。最近的研究表明,結合手術切除、大劑量化療藥物應用和高劑量放射治療,骨外ES長期存活率已經增加至30%~40%[13-14]。局部手術聯合放化療(長春新堿、阿霉素、環磷酰胺、異環磷酰胺、依托泊苷)被認為是治療任何部位ES的最佳方案。該患者治療效果不佳的原因可能為:(1)患者就診時已是腫瘤晚期,失去手術及放療機會,且腫瘤惡性程度高,病情進展迅速,沒有足夠的時間接受治療,治療療程不夠;(2)經典的ES化療、胸腔注藥及根據基因檢測報告給予免疫治療,這種治療方案不適合該患者;(3)電解質紊亂引起心搏驟停。
綜上所述,本病例為CIC基因突變的縱隔尤文樣肉瘤且PD-L1高表達。目前還沒有基于分子的靶向治療或癌癥免疫治療用于治療CIC基因突變肉瘤的報道,細胞毒性藥物的化療仍然普遍使用[15],最佳治療方案尚不明確。該病在成人患者中罕見,但應該被考慮為縱隔占位的鑒別診斷。了解這種罕見的骨外ES/PNET實體瘤、特征性的影像學表現和免疫組織化學特征,可以幫助臨床醫生對這種高度惡性的腫瘤進行正確的診斷和更好的治療。目前,尤文樣肉瘤治療參照ESFT臨床循證診療指南,并未對其進行更詳細的分類說明,治療效果不理想。因此,在今后臨床工作中,需要為患者制訂更為個體化的治療方案,以達到延長患者的生存期的目的。

