不同放療技術用于乳腺癌根治術后的療效及對患者預后的影響
荀 雷 陳 紅 史 珂
據流行病學統計,每年全球約有120萬婦女患乳腺癌,平均發病年齡為40歲,由于缺乏相關健康常識,大多數女性就診時已屬于中晚期,因此,手術已成為乳腺癌最主要的治療方法[1-2]。臨床上常用乳腺癌根治術作為首選方案,但術后依然存在諸多高危因素,所以,放療是乳腺癌根治術后必不可少的輔助手段。3D-CRT可以根據腫瘤形狀給予腫瘤靶區極高的劑量,以達到精確放療的目的,但是此方法并不能保證腫瘤體內劑量的均勻性,而且容易對正常器官造成傷害[3-4]。Hy-IMRT在適形的基礎上,通過調整照射野內的強度分布,使得靶區內的劑量分布更均勻[5]。所以,本文主要探討不同放療技術用于乳腺癌根治術后的療效及對其預后的影響,為乳腺癌根治術患者的術后治療提供臨床資料。
1 資料與方法
1.1 一般資料
回顧性分析我院2018年3月至2020年2月收治的126例已行乳腺癌根治術且需要術后放療患者的臨床資料,根據不同的放療技術進行分組,其中64例患者采用Hy-IMRT,為觀察組;62例患者采用3D-CRT,為對照組。納入標準:①所有患者年齡≥18歲,均為女性;②均符合《中國抗癌協會乳腺癌診治指南與規范(2019年版)》[6]對乳腺癌的診斷標準,已行病理學確診;③所有患者均已實行乳腺癌根治術,預計生存期≥6個月;④具備放療適應證并耐受者,放療周期≥4個月;⑤無精神障礙及心理疾病。排除標準:①具有其他惡性腫瘤者;②乳腺曾接受過放療;③伴有自身免疫缺陷及血液病等;④卡氏評分(karnofsky performance status,KPS)[7]<60分。觀察組年齡25~62歲,平均(38.22±1.31)歲;絕經29例,未絕經35例;TNM分期:ⅢA期21例,ⅢB期25例,ⅢC期18例;腫瘤大小(4.7±1.2)cm,腫瘤位置:左側42例,右側22例;腋窩淋巴結轉移55例。對照組年齡26~65歲,平均(39.54±1.42)歲;絕經25例,未絕經37例;TNM分期:ⅢA期20例,ⅢB期23例,ⅢC期19例;腫瘤大小(5.1±0.8)cm,腫瘤位置:左側39例,右側23例;腋窩淋巴結轉移49例。2組一般資料相比差異無統計學意義(P>0.05)。
1.2 方法
所有患者均采取仰臥位,上臂高舉,使用乳腺托架固定雙手,囑患者深呼吸,在平靜狀態下進行CT掃描,將圖像傳輸至三維治療計劃系統,根據圖像勾畫臨床靶區(CTV),范圍包括患側胸壁、鎖骨上下淋巴引流區,臨床靶區均勻三維外放5 mm為計劃靶區(PTV),處方劑量均為計劃靶區劑量50.0 Gy,2.0 Gy/次,1次/天,5次/周,共照射25次,在患側胸壁處墊0.5 cm等效膜增強皮膚表面劑量。觀察組采用混合調強放療計劃,由3~4個逆向調強照射野貢獻鎖骨上、下淋巴引流區100%劑量和胸壁20%劑量,由2個對穿的胸壁切線野貢獻胸壁80%劑量。對照組采用三維適形放療計劃,胸壁以傳統對穿切線野照射,鎖骨上下區使用單前野或前后對穿野照射,在鎖骨上下區與胸壁之間分野,總計以3~4個適形照射野照射靶區。
1.3 觀察指標
觀察2組放療后靶區劑量學指標、器官劑量學及不良反應,放療前、后免疫細胞因子及T細胞亞群水平,2組預后。
(1)2組放療后靶區劑量學指標比較:根據國際輻射單位與測量委員會[8]評定,放療后根據CTV劑量學指標評估2組患者靶體積所得劑量(D95%)以及大于105%和110%處方劑量靶體積(V105%、V110%),適形指數(conformal index,CI)、均勻性指數(uniformity index,HI),其中CI和HI數字越接近1說明效果越好。
(2)2組放療后器官劑量學比較:對比2組患側肺、心臟、對側乳腺及肝臟接受照射劑量。
(3)2組放療后不良反應比較:不良反應包括骨髓抑制、放射性皮炎、消化障礙、白細胞下降、放射性肺損傷、放射性食管炎,其中放射性損作采用急性放射損傷分級標準(Radiation Therapy Oncology Group,RTOG)[9]進行評定。
(4)2組放療前、后免疫細胞因子及T細胞亞群比較:晨起采集患者空腹靜脈血4 ml離心分離血清,使用酶聯免疫吸附法檢測白細胞介素6(interleukin-6,IL-6)和腫瘤壞死因子α(tumor necrosis factor-α,TNF-α),采用流式細胞儀( 貝克曼庫爾特CytoFLEX 流式細胞儀,貝克曼庫爾特商貿(中國)有限公司,美國)測定CD4+、CD8+比例,計算CD4+/CD8+。
(5)2組預后比較:通過門診隨訪,統計2組患者放療后6個月局部復發率、遠處轉移率及死亡率。
1.4 統計學方法
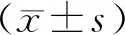
2 結果
2.1 2組放療后靶區劑量學指標比較
放療后觀察組D95%大于對照組(P<0.05),V105%和V110%明顯低于對照組(P<0.05);而觀察組CI更接近1,適形度更好(P<0.05);觀察組HI低于對照組,其靶區內劑量更均勻(P<0.05),見表1。
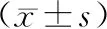
表1 2組放療后靶區劑量學指標比較
2.2 2組放療后器官劑量學比較
觀察組放療后器官劑量低于對照組(P<0.05),見表2。

表2 2組放療后器官劑量學比較
2.3 2組放療后不良反應比較
觀察組放療后骨髓抑制、放射性皮炎、消化障礙、白細胞下降、放射性肺損傷、放射性食管炎等不良反應發生率均低于對照組(P<0.05),見表3。

表3 2組放療后不良反應比較(例,%)
2.4 2組放療前、后細胞因子及T細胞亞群比較
放療前2組比較差異無統計學意義(P>0.05);放療后,2組IL-6、TNF-α、CD8+高于放療前(P<0.05),CD4+、CD4+/CD8+低于放療前(P<0.05),但觀察組IL-6、TNF-α、CD8+低于對照組(P<0.05),CD4+、CD4+/CD8+高于對照組(P<0.05),見表4。
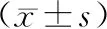
表4 2組放療前、后細胞因子及T細胞亞群比較
2.5 2組預后比較
2組放療后6個月局部復發率、遠處轉移率及死亡率比較,差異無統計學意義(P>0.05),見表5。

表5 2組患者放射治療后6個月預后比較(例,%)
3 討論
據調查,我國范圍內乳房切除術占到原發性乳腺癌手術的88.8%,但當腫瘤周圍有大血管、重要器官時,手術也很難切除干凈[10-11]。而乳腺癌根治術后通常需要進行放療來提高患者生存率,隨著現代醫學不斷進步,現在的放療技術和設備也在不斷升級,在提高了靶區劑量的同時,也減少了周圍射線照射,在臨床上應用已越來越廣泛[12-13]。
本文研究結果顯示,放療后觀察組D95%大于對照組,V105%和V110%明顯低于對照組,而觀察組CI更接近1,適形度更好,觀察組HI低于對照組,其靶區內劑量更均勻。提示Hy-IMRT在放療中具有更強的劑量學優勢。與丁小崇[14]研究報道結論相符。3D-CRT采用多種個體化的體位固定技術,能夠對腫瘤進行精確的定位,保證分次治療體位的精確重復,從而將絕大部分的射線都集中在腫瘤靶區,避免射線對腫瘤靶區周圍正常組織的損傷,但對于照射野內的劑量分布還有待提高[15]。Hy-IMRT作為3D-CRT和IMRT的結合技術,具有更好的適形度,對劑量分布更加均勻,可有效控制胸壁在進行適形照射野時的呼吸強度或體位差異而引起的劑量上的誤差,并且成功解決了胸壁野與鎖骨野之間的劑量銜接問題[16]。本文結果還發現,觀察組放療后器官劑量低于對照組,Hy-IMRT較3D-CRT更利于保護患者的肺、心臟及肝臟等重要器官,說明Hy-IMRT對靶區覆蓋率的提升,可降低靶區外的相關區域,增強了靶區劑量分布的均勻性,對周圍器官有更好的保護。與王向前等[17]研究報道認為的Hy-IMRT能夠保證減少患者器官受損風險結論一致。本研究結果當中,觀察組放療后骨髓抑制、放射性皮炎、消化障礙、白細胞下降、放射性肺損傷、放射性食管炎等不良反應發生率均低于對照組,提示Hy-IMRT在安全性方面優于3D-CRT。曾媛媛等[18]認為放射性皮膚損傷與放療技術、劑量分割及方案有關。分析3D-CRT無法在計劃靶區內均勻分布照射劑量,易造成皮膚損傷等情況,Hy-IMRT在不影響處方劑量的情況下保護了骨髓造血功能,減輕了對造血組織損害。本研究結果中,放療后,2組IL-6、TNF-α、CD8+高于放療前,CD4+、CD4+/CD8+低于放療前,提示放療會降低患者機體免疫功能。CD8+反映免疫細胞損傷程度,CD4+細胞減少、CD4+/CD8+降低、CD8+增多說明機體已發生免疫失衡[19]。觀察組IL-6、TNF-α、CD8+低于對照組,CD4+、CD4+/CD8+高于對照組,說明Hy-IMRT可以最大程度地降低對機體免疫功能的影響。與李潤華等[20]研究結果一致。本研究還證實2組放療后6個月局部復發率、遠處轉移率及死亡率比較,差異無統計學意義。由于樣本量較小,對患者隨訪時間較短,且為單一研究[21],所以,臨床上還需要擴大樣本量對乳腺癌根治術患者的預后治療做進一步研究。
綜上所述,Hy-IMRT作為乳腺癌根治術后的輔助放療技術優于3D-CRT,Hy-IMRT對正常組織及器官損害較小,可減少不良反應發生及降低對免疫功能的影響,值得臨床推廣應用。

