基于醫院藥物警戒系統的丹紅注射液安全性再評價*
葛莉莉,沈 穎,劉瑕瑜,薛莉麗,何小燕,袁秀研,戴 婷
江蘇省宜興市人民醫院 藥學部,宜興 214200
中藥注射劑由于提取過程、制備工藝等存在一定的難點,因此導致其在臨床使用后出現較多副作用。目前,中藥制劑臨床安全性再評價的方法較多,但這些方法各有優缺點[1],因此,尋找一種更加有效、簡單、費用低的手段迫在眉睫。
中國醫院藥物警戒系統(CHPS)可全方位、多角度地采集醫院藥品不良反應(ADR)信息并及時給予預警。巢式病例對照研究(NCCS)是將病例對照研究與隊列研究相結合的一種研究方法,其效果顯著[2]。丹紅注射液主要成分為丹參、紅花,具有活血化瘀、通脈舒絡的功效[3],用于瘀血閉阻所致的心腦血管疾病。本研究利用CHPS 結合NCCS 進行研討,對丹紅注射劑安全性進行再評價,并為中藥注射劑安全性評價提供思路和借鑒。
1 材料與方法
1.1 一般資料
選取2018 年4 月1 日~2019 年10 月31 日在本院使用丹紅注射液的住院患者,共4163 例。從HIS 系統中提取患者的性別、年齡、過敏史、病情(危重/一般)、診斷、丹紅注射液使用情況(溶媒種類、溶媒量、單次用藥劑量、用藥天數、合并用藥)等資料,導出至Excel 表格。
1.2 不良反應數據收集
運用CHPS 主動監測功能,收集丹紅注射液出現不良反應的病例。臨床藥師在HIS 系統中新增“丹紅安全性監測”項目,從2018 年4 月1 日起至2019 年10 月31 日止,在本院范圍對使用丹紅注射液的病例進行監測。在HIS 系統監測計劃中設置的條件(使用該藥且病程記錄中有“不良反應”字樣)遍歷中間庫的患者信息,然后利用文本檢索技術對符合基礎條件的患者的電子病歷進行 “不良反應”關鍵詞檢索,篩選出與丹紅注射液ADR 匹配的患者病歷,最后由藥師判斷ADR 的發生與丹紅注射液的相關性。
ADR 關聯性評價采用國家藥品不良反應監測中心制定的6 級標準:肯定、很肯定、可能、可能無關、待評價、無法評價;其中關聯性評價為肯定、很肯定、可能的定為發生了ADR 病例。從HIS 系統中導出發生ADR 的患者信息、給藥情況以及ADR 發生情況。
1.3 病例組和對照組
從監測開始到結束,將4163 例使用丹紅注射液的患者,根據是否發生ADR 分為病例組和對照組。
病例組:醫院藥物警戒系統共呈報可疑不良反應76 例,根據國家藥品不良反應監測中心評定標準,由人工判斷上述病例中使用丹紅注射液是否發生ADR,最后篩選出15 份發生ADR 的作為病例組。
對照組:按照成組設計原則,以1∶4 比例從研究隊列中隨機抽取60 例使用丹紅注射液未發生ADR的病例作為對照組。兩組間年齡、性別無顯著差異。
1.4 統計方法
采用SPSS21.0 軟件進行統計分析,計量資料采用t 檢驗,計數資料以例數和百分比表示。分別統計兩組各變量的頻數分布情況,采用Logistic 回歸進行單因素分析,并將單因素篩選中具有統計學意義(P≤0.05)的因素納入到多因素模型中,篩選出ADR 相關的危險因素。
2 結果
2.1 丹紅注射液不良反應發生情況
經過關聯性評價,確定丹紅注射液不良反應15例、其發生率為3.6‰。其中男性7 例,女性8 例。發生ADR 的患者年齡在44~97 歲,平均年齡為64.13歲。ADR 癥狀為惡心、嘔吐、皮疹、頭痛等。其中嚴重ADR 1 例,表現為全身粟粒樣皮疹。見表1。
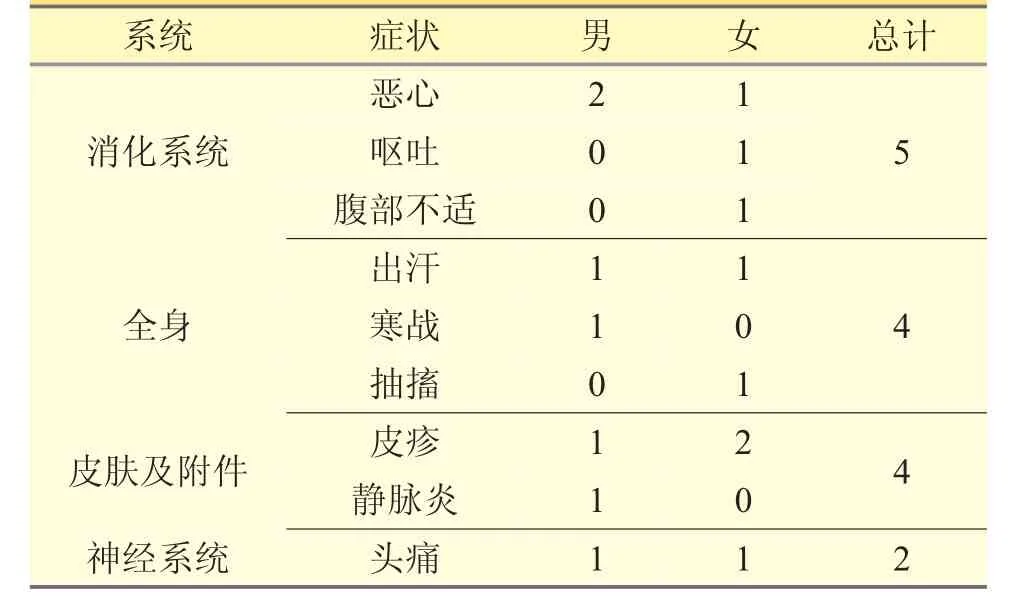
表1 不良反應發生主要器官系統分布及臨床表現(例)
2.2 兩組入院病情、過敏史及超說明書用藥比較
病例組入院病情與對照組比較有顯著差異(P<0.05),病例組病情危重者顯著多于對照組;而病例組過敏史和超說明書用藥與對照組比較無顯著差異(P>0.05)。見表2。
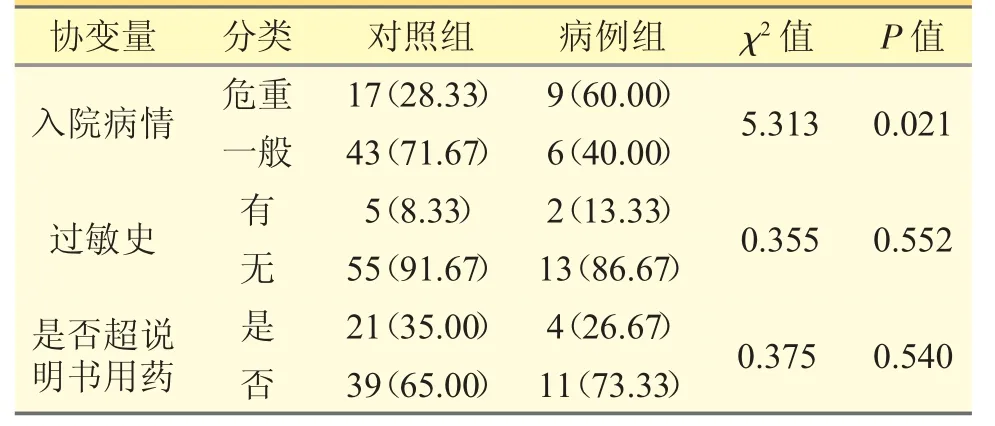
表2 兩組患者入院病情、過敏史及超說明書用藥比較[n(%)]
2.3 兩組溶媒、單次用藥劑量及藥物配置濃度比較
兩組使用溶媒種類有顯著差異(P<0.05),而兩組單次用藥劑量和藥物配制濃度無顯著差異(P>0.05),見表3。
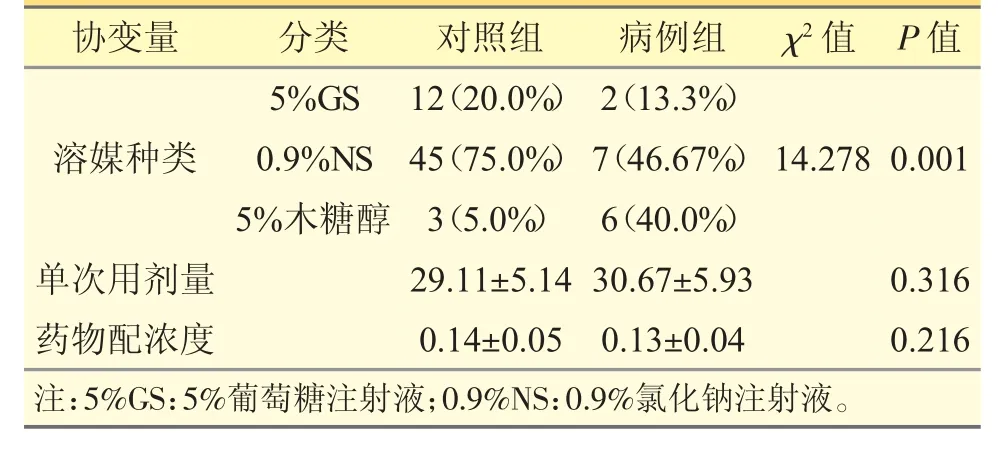
表3 兩組患者溶媒、單次用藥劑量及藥物配置濃度比較
2.4 單因素分析
采用單因素Logistic 回歸方法,對兩組合并用藥進行分析,發現丹紅注射液合并使用二丁酰環磷腺苷鈣針是發生ADR 的危險因素;丹紅注射液合并使用乙酰谷酰胺針、奧拉西坦針、阿司匹林腸溶片、氯吡格雷片、阿托伐他汀鈣片、美托洛爾緩釋片、瑞舒伐他汀鈣片、雷貝拉唑腸溶片、阿卡波糖片、前列地爾針不是發生ADR 的危險因素。見表4。
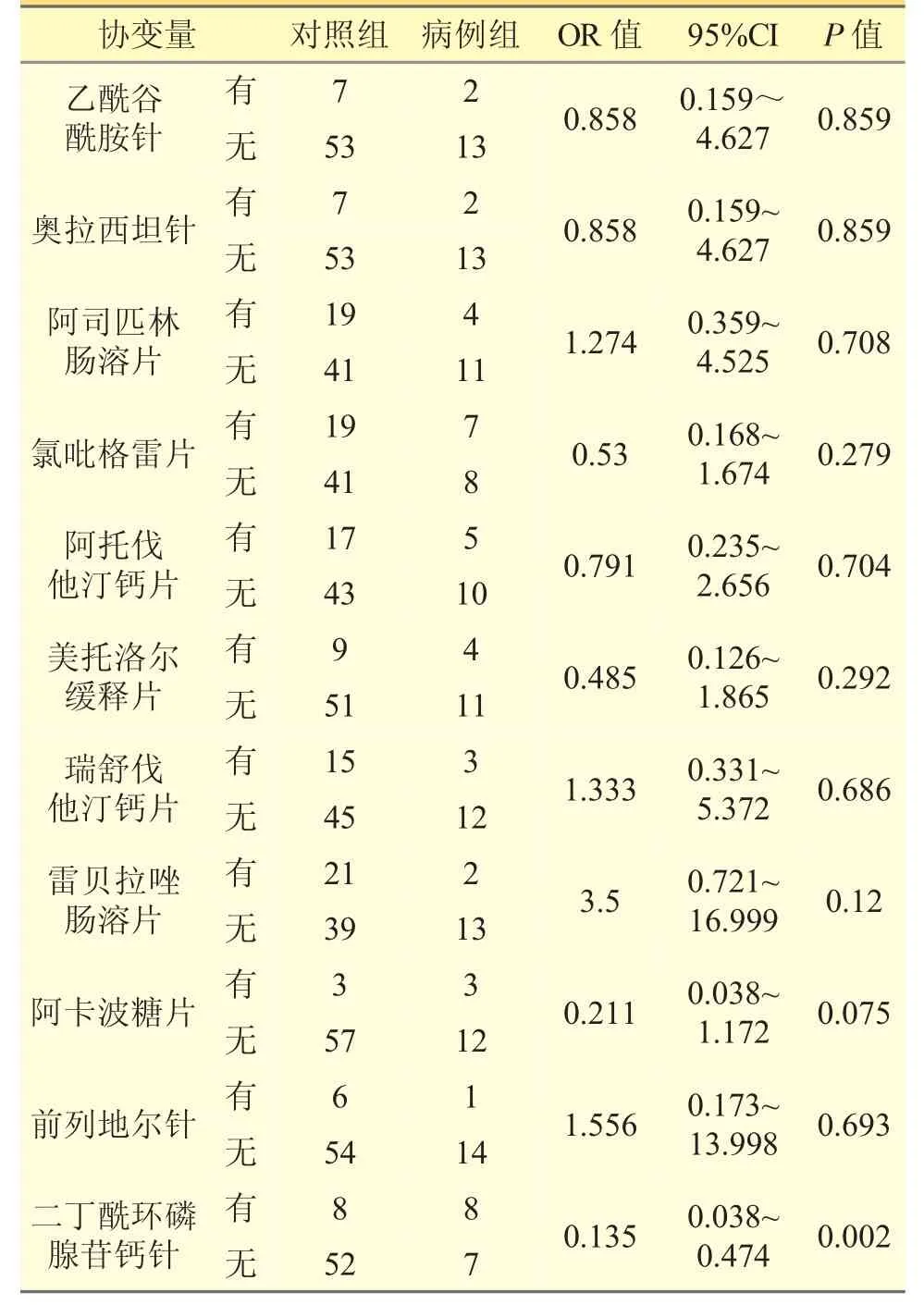
表4 兩組患者合并用藥情況分析
2.5 多因素分析
將入院病情、溶媒(分為木糖醇和非木糖醇兩種)及合并二丁酰環磷腺苷鈣這3 項因素作多因素Logistal 回歸分析,發現溶媒種類與丹紅注射液發生ADR 有很大相關性;入院病情、合并使用二丁酰環磷腺苷鈣與發生ADR 相關性不大。見表5。
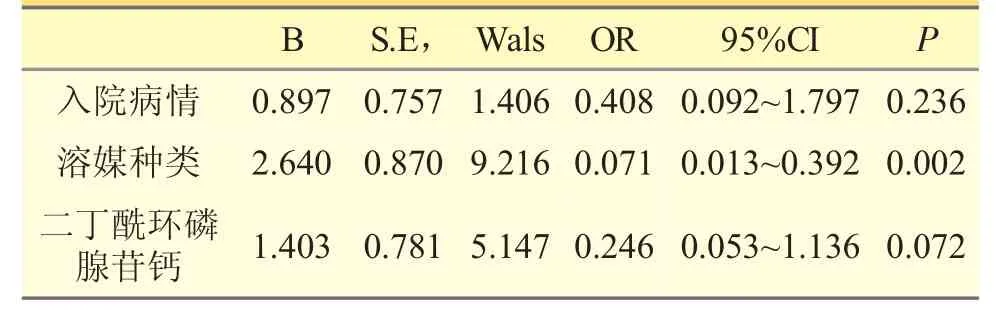
表5 Logistal 多因素回歸分析
3 討論
既往報道,使用自發呈報收集的丹紅注射液ADR 約為0.67‰[1],雖然自發呈報法覆蓋面廣,費用較低;但是漏報病例較多。本研究顯示,丹紅注射液ADR 發生率為3.6‰,明顯高于自發呈報法。與傳統的ADR 自發呈報模式相比,CHPS 可對重點藥品進行實時監測,可發現更隱蔽的ADR 病例,它反映ADR 發生的“真實世界”。舒婷等[4]報道的醫院集中監測下的丹紅注射液ADR 發生率為3.5‰,與本研究結果相近,這提示運用CHPS 主動監測ADR 方法切實可行。本研究共收到CHPS 呈報的可疑ADR 76 例并對其重點關注。若使用集中監測法,雖然收集到的ADR 信息較全面、準確性高;但是需要對所有使用丹紅注射液的患者進行關注,耗時耗力。綜合比較,CHPS 主動監測能節約經費及人力、物力。
本研究發現,丹紅注射液不良反應涉及消化系統、全身反應以及皮膚及其附件損害多見,癥狀為惡心、嘔吐、腹部不適、頭痛、寒戰、靜脈炎等。其中嚴重ADR 1 例,表現為全身粟粒樣皮疹。在15 例ADR 中,有10 例患者停藥后好轉,另外5 例在停藥并給予相應藥物治療后好轉。
對丹紅注射液不良反應影響因素分析:病例組入院病情嚴重、溶媒為木糖醇以及合并二丁酰環磷腺苷鈣的病例顯著多于對照組。將上述3 項因素進行多因素Logistal 回歸分析,發現溶媒使用木糖醇是丹紅注射液發生ADR 的危險因素。根據該藥說明書,其溶媒應為5%GS 葡萄糖注射液,在伴有糖尿病等特殊情況時可改用0.9%氯化鈉注射液。相比于0.9%氯化鈉注射液和5%GS 注射液,使用木糖醇注射液作溶媒時,更易發生ADR,這提示在使用丹紅注射液時,應嚴格按照該藥說明書進行輸液配制。
本研究表明,丹紅注射液不良反應發生率較低。而利用醫院藥物警戒系統結合巢氏病例對照研究進行藥物安全性評價方法更為適宜,值得推廣。

