慢性丙型肝炎伴ANA、LC-1陽性的自身免疫現象1例并文獻復習
楊永生 邵晨 張雷
患者男性,64歲,主因體檢發現HCV抗體陽性16年,肝功能明顯異常1月余,于2021年9月24日入本院。患者16年前于當地醫院行中耳炎術前檢查發現HCV抗體陽性,當時肝功能正常故未治療,此后定期復查肝功能均基本正常,1月余前于當地醫院檢查發現肝功能明顯異常,為求進一步診治前來我院就診,并以“病毒性肝炎,丙型,慢性”收入院治療。患者自發病以來神志清,精神佳,睡眠及飲食可,無鼻衄及牙齦出血,二便正常。既往于1992年因大面積燒傷在當地醫院住院并輸血治療;2型糖尿病病史20余年,長期注射中長效胰島素降糖治療,血糖控制可;16年前因中耳炎于當地醫院住院并手術治療,術后恢復好;高血壓4年,規律口服硝苯地平緩釋片降壓治療,血壓控制可;否認心臟病病史,否認食物、藥物過敏史。查體無陽性體征。入院后查尿、糞常規無異常,WBC 5.79×109/L,PLT 166×109/L,Hb 145 g/L;HAV抗體陰性,HEV抗體IgM、IgG均陰性,HCV抗體陽性;HBV血清標志物抗-HBs、抗-HBc陽性;HBV DNA陰性;ALT 236 U/L,AST 103 U/L,ALP 40 U/L,GGT 38 U/L,CHE 9788 U/L,Alb 36.4 g/L,球蛋白38.8 U/L,TBil 11.7 μmol/L,DBil 4.8μmol/L,IBil 6.9 μmol/L,BUN 6.4 mmol/L,CRE 79 μmol/L,UA 400 μmol/L,GLU 4.81 mmol/L,TC 2.82 mmol/L,TG 1.00 mmol/L,HDL-C 0.71 mmol/L,LDL-C 1.66 mmol/L,CK 53 U/L,CM-MB 6 U/L,LDH 172 U/L;PTA 102.03%,INR 0.97;IgA 342.5 mg/dL,IgG 1 951 mg/dL,IgM 113.7mg/dL,補體C3 96.0 mg/dL,補體C4 18.2 mg/dL。肝膽脾B超:肝實質彌漫性損傷。HCV RNA 2.91×105IU/mL。HCV基因分型1b亞型。抗線粒體亞型-2抗體(M2)陰性,抗肝腎微粒體抗體(LKM-1)陰性,抗肝溶質抗原1型抗體(LC-1),抗可溶性肝抗原/肝胰抗原抗體(SLA/LP)陰性,抗核抗體(ANA)核均質型1:80+胞漿型1:80+,抗平滑肌抗體(ASMA)陰性。中日友好醫院肝病病理會診報告:肝穿組織2條,分別長0.6 cm、1.0 cm。組織切染HE、網織+Masson、D-PAS、CK7、CD34、Mum1各1。鏡下檢查:切片內見6個炎性擴大的中小匯管區,間質輕度纖維化,中度或灶狀單個核細胞浸潤,局灶漿細胞聚集,輕度界面炎(圖1左HE)。匯管區邊緣見細膽管增生(圖1右CK7免疫染色)。小葉內肝板尚整,中央靜脈周圍少數肝細胞呈大泡性脂變,范圍約達10%(見圖1左HE),伴輕度竇周纖維化,并見少數小壞死灶。另于一肝靜脈周圍見少數單個核細胞浸潤。病理診斷:肝內輕度慢性炎癥,伴輕度邊緣細膽管增生;輕度肝細胞大泡性脂變。自身免疫性肝炎綜合診斷積分系統(1999年)9分,見表1。診斷:病毒性肝炎丙型慢性伴自身免疫現象;2型糖尿病3.高血壓。治療經過:給予異甘草酸鎂、肝水解肽、五靈膠囊、艾爾巴韋格拉瑞韋、諾和靈30R、硝苯地平緩釋片保肝、抗病毒、降糖、降壓治療。治療2周后復查肝功能恢復正常并停用保肝治療;4周后HCV RNA轉陰,肝功能正常。
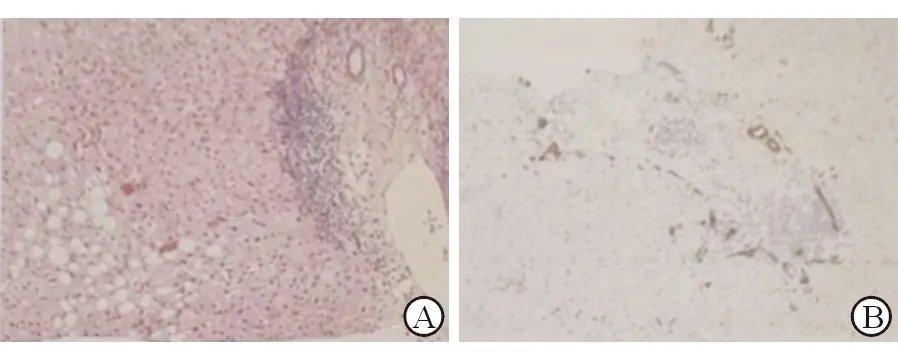
A:HE染色(×200);B:CK7免疫組化染色(×200)

表1 自身免疫性肝炎綜合診斷積分系統(1999年)
討論丙型肝炎和自身免疫性肝炎(AIH)是兩種不同原因引起的肝臟疾病,兩者均可引起疾病的慢性化,從而導致肝臟炎癥、肝纖維化、肝硬化甚至肝癌的發生。各種病毒性肝炎均可誘發機體出現自身免疫反應從而發生自身免疫現象甚至AIH,而丙型肝炎患者發生上述情況的幾率更高。且丙型肝炎患者容易出現肝外自身免疫性疾病,如糖尿病、腎小球腎炎、白塞氏病等[1-2]。若丙型肝炎與AIH兩種疾病同時存在則會加速疾病進展,需分別應用抗病毒治療及免疫抑制治療。但AIH與自身免疫現象極易混淆,若盲目地給予免疫抑制治療則會加重丙型肝炎的病毒血癥。因此當丙型肝炎患者伴隨自身免疫反應發生時,首要任務就是辨別清楚是發生了AIH還是自身免疫現象。
AIH在中老年女性高發,以出現自身抗體陽性、免疫球蛋白G升高、高丙種球蛋白血癥、特殊的肝臟病理改變為特征。根據自身抗體陽性的不同將其分為兩型:1型為ANA和(或)ASMA陽性或SLA/LP陽性,此型在臨床中最常見,對免疫抑制治療的效果佳;2型為LKM-1和(或)LC-1陽性,此型好發于兒童,可快速進展為肝硬化,復發率高,對免疫抑制治療效果欠佳。其中LC-1陽性對于診斷2型AIH特異性高,并與疾病的活動和進展高度相關,但陽性率低[3-4]。AIH典型的病理表現為中-重度界面炎、淋巴細胞漿細胞浸潤、淋巴細胞穿入、肝細胞玫瑰花節樣改變等。與病毒性肝炎的診斷不同,AIH的診斷需要根據綜合的積分評估,目前公認的評分標準是1999年更新的自身免疫性肝炎綜合診斷積分系統。對于符合AIH治療指征的則予以糖皮質激素及免疫抑制劑進行治療。
丙型肝炎伴自身免疫現象者以男性居多,其特點與AIH相比不同之處為[5-7]:(1)前者自身抗體水平通常較低,例如ANA及SMA滴度常小于1:160;而后者自身抗體常呈高水平表現,ANA多大于1:320,SMA多大于1:160,且二者同時陽性幾率較高。(2)根據抗原的不同,前者多表現為非抗肌動蛋白SMA陽性,少數表現為斑點型ANA陽性;而ANA異質體和SMA異質體則在1型AIH的診斷中特異性高。(3)肝臟病理上前者可見匯管區淋巴細胞聚集并形成淋巴濾泡,小葉間膽管損傷較常見,肝實質可出現大泡樣脂肪變性、Mallory小體等表現;而后者匯管區可見漿細胞浸潤、淋巴細胞穿入現象,肝細胞玫瑰花節樣改變,小葉間膽管損傷則少見。
目前尚無針對慢性丙型肝炎(CHC)合并自身免疫現象治療的規范,因此需施行個體化治療方案。一項多中心大樣本的臨床研究表明[1],部分患者僅需要單純進行抗病毒治療即可,而另一些患者則需要在抗病毒治療的同時應用糖皮質激素或免疫抑制劑。需要注意的是抗病毒方案的選擇應以無干擾素方案為宜,以避免干擾素可能誘發的免疫紊亂甚至AIH的出現。同樣,在接受免疫抑制治療期間應對患者進行病毒學監測,以避免病毒血癥加重。
該病例特點為老年男性,CHC合并2型糖尿病,IgG升高,ANA和LC-1兩種自身抗體呈陽性,且LC-1對于2型AIH的診斷具有較高的特異性,若不行肝臟病理檢查則容易誤診為CHC合并AIH。但結合該患者的肝臟病理結果無典型AIH表現,而是符合HCV感染引起的細膽管損傷、肝細胞出現大泡樣脂肪變性等表現。輕度界面炎在活動性肝炎患者中則沒有特殊意義。該患者雖然ANA和LC-1兩種自身抗體同時呈陽性,但ANA呈低水平陽性,并且其是一種廣泛存在的抗體,可見于多種自身免疫性疾病,在健康老年人中也可見低水平存在;有研究表明,LC-1在AIH中的特異性為100%,可作為AIH的特異性指標,但老年、肝臟炎癥、肝細胞損傷及肝纖維化均與自身抗體的檢出呈正相關,這些可能是該患者LC-1陽性的重要原因[4,8]。雖然該患者IgG呈中等程度升高,但慢性肝病患者可因肝功能下降致肝臟對血液中IgG的滅活減少從而引起其升高[9]。筆者認為結合該患者的肝臟病理特點、年齡及高病毒載量,其肝功能異常為CHC引起,因此僅給予了直接抗病毒藥物進行抗病毒治療,從結果來看該患者病毒轉陰后肝功能未再反復也進一步證實了上述觀點。通過該病例說明1999年更新的自身免疫性肝炎綜合診斷積分系統在區分CHC患者究竟是合并了自身免疫現象還是AIH是十分重要的,需要在臨床工作中加以重視。雖然該患者目前排除了合并AIH,但CHC患者檢出自身抗體陽性標志著合并AIH的可能性增加[4],說明其將來有進展至AIH的可能,因此對該患者進行動態隨訪是十分必要的。

