我國與美國歐盟醫療器械上市注冊流程比較
林新文,海樂,楊澤華,李穎,扈麟,唐閃光
(1.湖南省藥品審核查驗中心,湖南 長沙410001;2.湖南一格制藥有限公司,湖南 湘潭411100)
醫療器械在疾病的預防、診斷、治療、監護、康復等方面發揮著重要作用,隨著科技的發展,越來越多的醫療器械甚至創新醫療器械問世,不斷推進著醫療水平的進步。醫療器械產品的安全、有效,是醫療器械上市前所必須關注的,也是保障廣大人民群眾身體健康和生命安全的重要問題。按照國際慣例,醫療器械在上市前必須獲得監管部門的審查批準,這一過程稱為醫療器械上市許可或醫療器械注冊。2017年10月,中共中央辦公廳、國務院辦公廳印發了《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》,旨在推動醫療器械監管和產業高質量發展,滿足公眾臨床需要,進一步加快醫療器械的上市審評審批,促進醫療器械創新。世界各國/地區醫療器械上市注冊流程不盡相同,其中美國、歐盟的管理模式具有代表性,在國際上的影響力較廣泛。在此,通過對比我國、美國、歐盟醫療器械上市注冊的法規、管理模式、注冊流程的差異,探討可借鑒的經驗,為加強我國醫療器械監管工作提供參考。
1 醫療器械法規沿革
1.1 我國
1996年,我國頒發《醫療器械產品注冊管理辦法》,要求自1997年1月1日起,進入中國市場的任何一種醫療器械產品,須由產品生產者或其委托代理人向中國政府醫療器械行政監督管理部門提出產品注冊申請。全國采用統一的醫療器械產品注冊證書和注冊號。2000年,我國頒發《醫療器械監督管理條例》(以下簡稱《條例》),對規范醫療器械研制、生產、經營、使用活動,加強醫療器械監督管理,保障醫療器械安全有效,促進產業發展,起到了積極作用。隨著經濟社會的發展和醫療器械產業的不斷壯大,《條例》在實行分類管理、強化企業責任、創新監管手段、推進社會共治、嚴懲違法行為等方面已不能完全適應發展的需要。為此,啟動了《條例》的修訂工作。經過反復研究、論證、修改,歷時6年,修訂后的《條例》于2014年6月1日施行。7年后再次修訂,于2021年6月1日起施行。最新《條例》從風險管理、全程管控、科學監督、社會共治等方面進行補充和完善,落實了注冊人、備案人制度,強化了企業主體責任;落實改革舉措,鼓勵行業創新發展;完善監管制度,提高監管效能;加大懲處力度,提高違法成本。新《條例》從產品命名、分類界定、注冊檢驗、臨床評價、性能研究、風險管理等方面提供了全面的法律法規依據及指導,使醫療器械的安全性和有效性得到了保證[1]。
1.2 美國
美國早在1906年的《純食品和藥品法》中就提及了醫療器械,1938年通過的《聯邦食品、藥品和化妝品法》增加了對醫療器械的管理。1976年,頒布了《醫療器械修正案》,確定了醫療器械的分類體系,并加大了監察力度。1990年,美國國會通過了《安全醫療器械法》,授權美國食品藥物管理局(FDA)對生產永久性植入器械的企業進行產品上市后的安全監管,還賦予FDA對于不合規器械有要求召回的權力。此外,該法案還提出了1個新定義“實質相等”(SE)[2]。1997年至2007年,隨著技術的發展,FDA相應地增加了符合現狀的法規條例。隨后,大力推行“唯一器械標識”(UDI),目的在于讓最終用戶如診所、醫院、患者等能更好地追蹤器械來源和企業,加速回收不合規產品并進行管理。2002年的《醫療器械用戶收費和現代化法》獲批,規定生產企業在進行注冊、產品登記及提交申請或產品上市通告時需向FDA繳納一定費用。該法案旨在促使FDA加速對相關醫療器械的審批進度,自獲批以來,FDA審批醫療器械產品的時間縮減近半,同時還引入了外部獨立評審專家,以增強審批工作的科學性。2012年7月9日,《FDA安全與創新法案》正式生效,該法案是對2002年《醫療器械用戶收費和現代化法》的重新授權,涉及醫療器械生產企業的用戶費用。2012年至2021年,FDA加強了和醫療器械相關的國際標準的工作,包括頒布FDA承認的國際標準和制定合規指導原則。而FDA對于自身文件管理,也更加趨向于無紙化(電子化),更加便利于注冊審批及資料保管。
1.3 歐盟
歐盟在1993年頒布《歐盟醫療器械指令》(MDD),適用于除90/385 EEC指令和98/79 EEC指令規定以外的一般醫療器械,也適用于歐盟全體成員國醫療器械的準入要求,屬于強制認證,于1995年1月1日生效,1998年6月14日起強制實施。1998年12月7日,《歐盟體外診斷醫療器械指令》(IVDD)生效,自2003年12月7日起強制實施。新修訂版的《歐盟醫療器械法規》(MDR)和《體外診斷醫療器械法規》(IVDR),分別于2020年5月26日和2022年5月26日 實 施,替 代原有MDD和IVDD。新法規在受監管方、參與監管方、產品分類、符合性評估途徑、臨床監管、醫療器械數據庫的使用等方面都做出了重大調整,提出了很多新的、更高的要求[3-4]。總體來說,歐盟MDR新規更加關注臨床性能、可追溯性和對患者更大的透明度。具體變化:醫療器械的范圍擴大;提出醫療器械新概念和定義;設立中央電子資料庫(Eudamed);設立產品獨立的產品識別碼(UDI);完善了醫療器械的通用安全和性能要求;加強對技術文件的要求;加強器械上市后的監管;完善臨床評價相關要求;對授權認證機構(NB)提出更嚴格的要求等。這意味著對進入歐洲市場的醫療器械將實施更嚴格的限制,對企業提出了更高要求。
2 醫療器械監管模式比較
2.1 總體情況
我國和美國都將醫療器械按預期用途和風險程度實行分類管理,分為Ⅰ類、Ⅱ類和Ⅲ類,Ⅰ類風險最小,Ⅲ類風險最高。不管哪類產品在美國都在FDA直接受理;我國則根據產品類別不同、境內境外注冊人不同需向不同的行政管理部門進行注冊申報。歐盟則將產品上市的審批權交由第三方有相應認證授權資質的機構執行,歐盟各成員國負責指定第三方機構即公告機構,并告知歐盟委員會,國家主管部門負責監督和管理第三方機構。
2.2 各國/地區監管模式
2.2.1 我國
國家藥品監督管理局(NMPA)對不同管理類別的產品監管方式不同。境內Ⅲ類、進口Ⅱ類、進口Ⅲ類醫療器械需向NMPA提出審評審批申請,進口Ⅰ類醫療器械需向NMPA提出備案申請;境內Ⅱ類醫療器械需向所在地省、自治區、直轄市藥品監督管理部門提出審評審批申請,境內Ⅰ類需向所在地設區的市級藥品監督管理部門提出備案申請[5]。醫療器械臨床試驗申請的技術審評時限為60日,申請資料補正后的技術審評時限為40日;Ⅱ類醫療器械注冊申請、變更注冊申請、延續注冊申請的技術審評時限為60日,申請資料補正后的技術審評時限為60日;Ⅲ類醫療器械注冊申請、變更注冊申請、延續注冊申請的技術審評時限為90日,申請資料補正后的技術審評時限為60日[6-7]。
2.2.2 美國
FDA對不同管理類別的產品監管方式也不同。通常而言,Ⅰ類屬低風險產品,采用“一般管制”方式監管;Ⅱ類屬中風險產品,采用“特殊管制”,需獲得上市前通知,也就是獲得510(k)認證;Ⅲ類產品屬高風險產品,采用“上市前許可(PMA)”。每類產品中會有一些特殊產品,監管方式向上一級類別靠攏。具體如下。
一般管制:包括企業注冊和產品列名,針對Ⅰ類低風險產品,如醫用手套、壓舌板、手動手術器械等,行業內也稱作510(k)豁免產品。FDA對這些產品大多豁免上市前通告程序,一般生產企業向FDA提交符合生產質量管理規范(GMP)的證明并進行登記后,即可上市銷售[8]。
特殊管制:在“一般管制”基礎上,還要實施標準管理或特殊管理,以保證產品質量。FDA只對少量的Ⅱ類產品豁免上市前通告程序,其余大多數產品均要求進行上市前通告510(k)。生產企業必須在上市前90日向FDA提出申請,通過510(k)審查后,產品才能上市銷售。510(k)分為3種,即傳統的(traditional)、特殊的(special)和簡化的(abbreviated)510(k)。特殊的510(k)和簡化的510(k)是對傳統的510(k)的一種補充,只有在特定情況下才可遞交,而傳統的510(k)適用于所有情況。傳統的510(k)最關鍵的是要找到對比器械,法規要求提交申請者需選取1個或多個對比器械進行比較,并制定支持它們實質性等同的聲明。
上市前許可(PMA):Ⅲ類產品為PMA產品,是指具有較高風險或危害性,或是支持或維護生命的產品,如人工心臟瓣膜、心臟起搏器、人工晶體、人工血管等。FDA對此類產品采取上市前批準制度,生產企業在產品上市前必須向FDA提交PMA申請書及相關資料,證明產品質量符合要求,在臨床中使用安全、有效。FDA在收到PMA申請后45天內通知生產企業是否對此申請立案審查,并在180天(不包括生產企業重新補充資料的時間)內對受理的申請做出是否批準的決定。只有當FDA做出批準申請的決定后,該產品才能上市銷售。
除普通定義的體外診斷試劑(IVD)外,美國市場上還存在一類特殊的試劑,即分析物特異性試劑(ASR)。ASR被定義為抗體(包括單克隆抗體和多克隆抗體),特定的蛋白受體、配體、核酸序列及其他類似試劑,它們可特異性地與樣品中的底物相互結合或發生化學反應,其目的在于診斷應用以識別和量化生物樣本中的單個化學底物或配體[9]。ASR受FDA監管,大部分ASR屬于Ⅰ類,受到“一般管制”,但有些ASR屬Ⅱ類和Ⅲ類,必須經過FDA批準才能上市。有3個聯邦規章典籍對ASR進行管理和指導,即21CFR864.4020明確了ASR的定義和分類,21CFR809.30對ASR的銷售、分銷和使用進行了限制,21CFR809.10(e)對ASR的標簽提出了要求。
ASR用于檢測單個配體或靶標(如蛋白質,單核苷酸變化、表位),不標注使用說明或性能聲明,也不提倡在指定儀器和特定測試中使用。如單一抗體、單個正向/反向寡核苷酸引物對、核酸探針、純化的蛋白質屬于ASR。假如多個單獨的ASR(抗體、探針、引物對)捆綁在一個預先配置或優化的混合物中一起使用,FDA認為此類產品不屬于ASR。ASR被認為是臨床實驗室自建項目(LDT)或IVD測試的組成成分,可銷售給IVD制造商,受特定監管的臨床實驗室,不向患者或從業者提供診斷信息的特定機構(法醫、學術等)。
2.2.3 歐盟
新法規IVDR將體外診斷醫療器械按風險程度分為A類(最低風險)、B類(低到中風險)、C類(中風險)和D類(最高風險)。分類規則的使用受控于器械的預期用途。新法規的實施在整個IVD領域,涉及公告機構介入的產品數量從IVDD監管體系下的10%~20%增至80%~90%。公告機構介入量的增加,意味著絕大多數的體外診斷設備在歐盟成員國地區的市場準入將要告別原先“自我宣稱”的形式,取而代之的將是一個實質性的注冊過程。A類通常不需要公告機構參與(除無菌狀態產品),B類、C類需要公告機構參與,D類需要公告機構、歐盟參考實驗室和專家小組的共同參與。
3 醫療器械注冊流程比較
3.1 我國、美國、歐盟注冊流程的差異
以境外生產的全自動生化分析儀在我國、美國、歐盟上市前的申報為例,分析各國注冊流程的差異,詳見表1。

表1 我國與美國和歐盟醫療器械注冊流程比較Tab.1 Comparison of registration process of medical devices in China,the USA and the EU
3.2 境外產全自動生化分析儀的注冊申請流程
我國:境外生產的全自動生化分析儀需向NMPA申報注冊,申請流程見圖1。
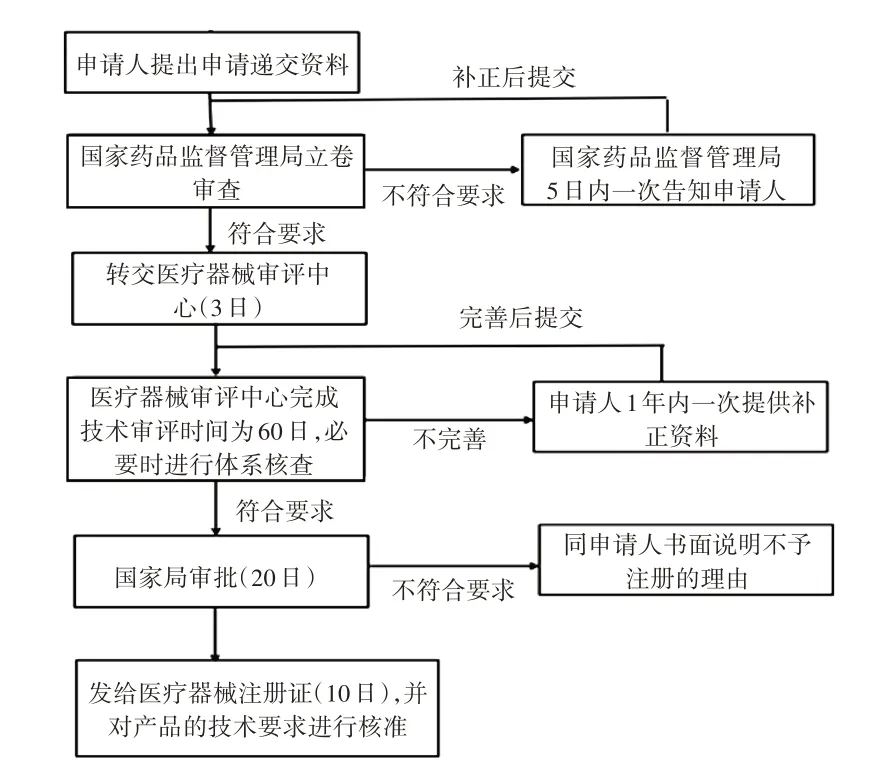
圖1 境外生產的全自動生化分析儀在我國的注冊申請流程Fig.1 Process of registration application of full-automatic biochemical analyzer produced overseas in China
美國:全自動生化分析儀屬于需進行510(k)的產品,510(k)的注冊申請流程見圖2。
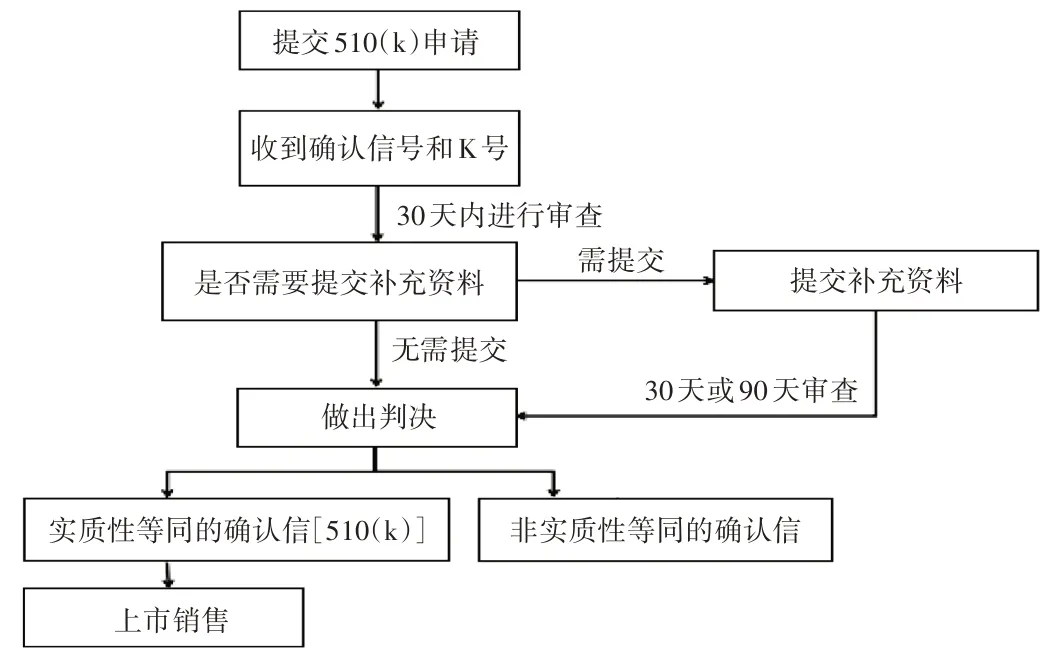
圖2 境外生產的全自動生化分析儀在美國的注冊申請流程Fig.2 Process of registration application of full-automatic biochemical analyzer produced overseas in the USA
歐盟:生產企業需向公告機構提供認證資料,具體流程見圖3。
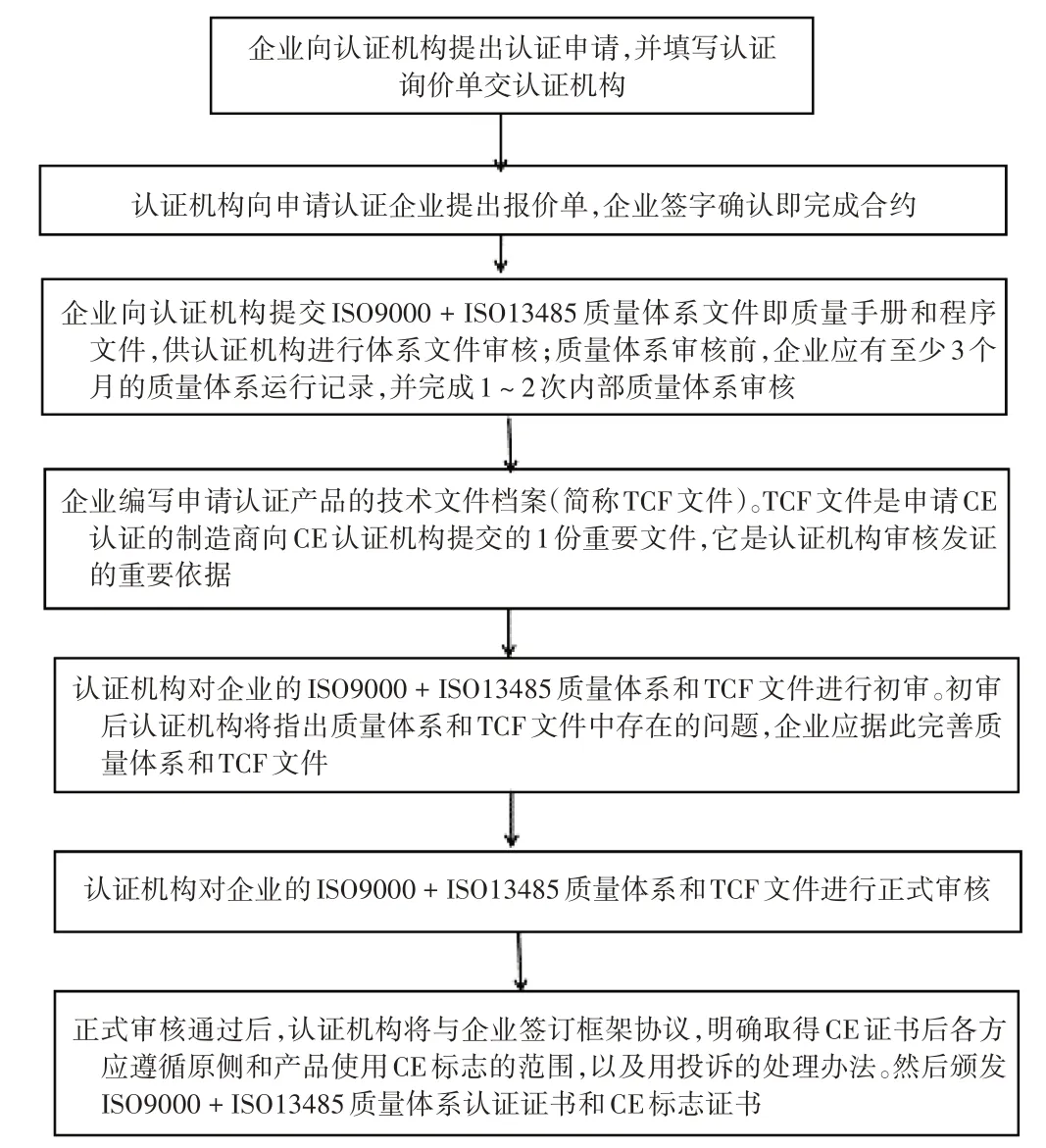
圖3 境外生產的全自動生化分析儀在歐盟的注冊申請流程Fig.3 Process of registration application of full-automatic biochemical analyzer produced overseas in the EU
4 討論與展望
全球不同國家/地區采用不同的方式對醫療器械上市前進行監管,以確保其安全性和有效性。從管理上看,我國、美國、歐盟都進行了分級管理,將主要的監管資源都用在高風險產品上。我國高風險產品(Ⅲ類)和境外產品由NMPA進行審評審批,Ⅰ類和Ⅱ類則由省級藥監部門進行審評審批,充分體現了分級管理的思路,兼顧效率與風險管控。美國采用集中審評的方式,所有產品都由FDA進行審評審批,審評尺度的把握一致。歐盟則將產品上市的審批權交由經過授權的第三方機構執行,有利于充分利用社會資源,節約行政成本。
全面、系統、科學的醫療器械管理制度讓我國的醫療器械安全更有保障。近幾年來,我國對醫療器械行業的法律法規進行了大規模修訂,分步落實了醫療器械審評審批制度的改革要求,在鞏固“放管服”改革成果、釋放市場創新活力的同時,進一步加強了醫療器械全生命周期和全過程的監管,在明確企業的主體責任的同時,更加大了違法行為的處罰力度。在分類管理制度、風險管理制度、注冊人備案人管理制度、臨床評價制度、生產經營許可備案制度、生產質量管理、經營質量管理、使用質量管理、不良事件監測再評價、產品召回等全生命周期管理若干制度,以及檢查員隊伍職業化、專業化管理方面邁上了新的臺階。
近年來,我國先后出臺了多項政策引導醫療器械產業高質量發展,在鼓勵創新醫療器械和加速國產替代方面給予了更多關注。《國務院辦公廳關于促進醫藥產業健康發展的指導意見》明確指出,國產藥品和醫療器械能滿足要求的,政府采購項目原則上須采購國產產品,逐步提高公立醫療機構國產設備配置水平。同時,隨著《政府采購法》的實施,讓采購過程更透明、更公平。投標掛網、陽光采購、集中采購等措施將讓規模較小、產品線單一、沒有核心技術的醫療器械生產企業逐漸失去競爭力。未來,醫療器械行業機遇與挑戰并存,我國醫療器械生產企業想要做大做強,加大研發投入、提升企業創新能力、掌握核心技術是必由之路。

