基于數字化三維重建技術的精準肝切除術治療原發性肝癌的療效及安全性分析*
李嘉興 尹承龍 歐陽俊光 郭永學 莫奇霏
廣東省江門市人民醫院普外科 529000
手術肝切除為臨床治療原發性肝癌常見辦法,對控制病情發展和延長患者生存期具有重要意義。然而肝切除是一項高風險性操作。據相關文獻[1]報道,肝切除術后并發癥發生率高達23.40%~40.00%,手術死亡率為1.60%~7.55%,無疑說明了這項手術的高風險性和復雜性,因此如何精確切除病變,減少對周圍組織不必要的損傷,最大限度保留正常肝組織,進而降低并發癥一直是外科醫生追求的目標。數字化三維重建(3D)技術因能準確顯示腫瘤與周圍組織、脈管之間的關系,廣泛用于各種良惡性疾病診斷中[2]。近年來,隨著臨床對數字化三維重建技術的進一步應用,發現其對原發性肝癌患者具有較高的應用價值,譬如評估整體肝臟及剩余肝臟體積,顯示腫瘤與肝動脈、門靜脈、肝靜脈之間關系及模擬腫瘤切割等,能為制定手術方案提供參考。本文為了證實其在原發性肝癌患者手術治療中的應用價值,選取86例原發性肝癌患者作為研究對象,旨在探討基于數字化三維重建技術的腹腔鏡精準肝切除術治療原發性肝癌的療效及安全性,結果如下。
1 資料與方法
1.1 臨床資料 前瞻性選取2018年5月—2020年1月于本院就診并隨訪至2022年1月的86例原發性肝癌患者作為研究對象,按照隨機數字表法分為觀察組(基于數字化三維重建技術指導下予以腹腔鏡精準肝切除術)與對照組(予以腹腔鏡精準肝切除術),各43例。診斷標準:符合《原發性肝癌規范化病理診斷指南(2015年版)》[3]中診斷標準。納入標準:臨床確診為原發性肝癌;均接受腹腔鏡精準肝切除術治療;既往未接受過放化療;認知功能正常。排除標準:既往存在腹部手術史;病變侵襲第一、第二肝門區域。納入本次研究患者均知情同意,經醫院倫理委員會批準。兩組一般資料比較,差異無統計學意義(P>0.05),具有可比性,見表1。

表1 兩組一般資料比較
1.2 方法 兩組患者均在術前予以128排螺旋CT增強薄層掃描。
觀察組根據CT增強薄層掃描數據行三維重建。(1)肝臟三維重建:將CT數據導入肝臟三維重建軟件,自動提取肝實質、病灶、門靜脈、肝靜脈等部位圖像信息后,重建肝實質、肝內各管道空間結構,分割出肝內病灶,三維重建其空間形態、大小、部分及肝內各管道之間的關系,在三維平面內旋轉模型,多角度觀察病灶。(2)肝臟體積測算:在肝臟三維重建系統中采用其系統自帶的測量工具測量患者肝臟三維模型的全肝體積、病灶體積及預切除肝臟體積、剩余肝臟體積等參數。(3)虛擬手術設計:通過觀察肝臟三維重建模型,明確病灶與肝靜脈、門靜脈、膽道關系,分析肝門、肝后下腔靜脈受侵犯情況,并采用切割工具對三維重建模型進行模擬切割,測算預切割部分肝臟和剩余肝臟體積,以及評估剩余肝臟體積是否滿足術后機體代償情況,最終設計合理的手術方案。(4)手術步驟:依據三維重建技術成像對病灶進行精準定位,術前預定切線,評估切除體積及殘肝體積,經氣管插管復合靜脈麻醉后取仰臥位,并根據腫瘤所在位置協助患者右傾或左傾15°~30°,頭高腳低位15°,雙腳分開;建立氣腹(13~15mmHg,1mmHg=0.133kPa),采用五孔法行肝切除,觀察孔位于臍下或臍上1~2cm建立Trocar,操作孔根據病灶位置而定,采用超聲刀按順序切割肝圓韌帶、肝鐮狀韌帶,并按照CT三維重建成像和血管造影,采用明膠海綿微粒(60mg)栓塞切除的肝段動脈和靜脈,參照無瘤原則采用超聲刀切除病灶周圍至少1cm距離,病灶切除后送檢,電凝止血,沖洗創面,放置引流管,縫合創口。
對照組根據術前影像結果評估腫瘤侵犯范圍,明確切除肝段。經氣管插管復合靜脈麻醉后取仰臥位,根據腫瘤所在位置協助患者右傾或左傾15°~30°,頭高腳低位15°,雙腳分開;建立氣腹,采用五孔法行肝切除,觀察孔位于臍下或臍上1~2cm建立Trocar,操作孔根據病灶位置而定,采用超聲刀按順序切割肝圓韌帶、肝鐮狀韌帶,并按照術前影像結果采用超聲刀切除病灶周圍至少1cm距離,切除后送檢,電凝止血,沖洗創面,放置引流管,縫合創口。
1.3 觀察指標 (1)對比兩組手術時間、術中出血量、住院時間及肛門排氣時間。(2)肝功能:于術前、術后1周采集空腹靜脈血5ml,離心處理后取上清液,采用AU5800全自動生化儀(American貝克曼褲爾特公司產)測定谷丙轉氨酶(ALT)、總膽紅素(TBiL)、谷草轉氨酶(AST)、白蛋白(ALB)。(3)生化指標:于術前3d內、術后1周內采用酶聯免疫吸附法測定甲胎蛋白(AFP)、角蛋白19片段(CYFRA21-1),試劑盒購于上海恒斐生物科技有限公司。(4)并發癥:觀察術后1個月內有無出現切口感染、膽漏、肺部感染、腹腔感染等情況。(5)肝切緣陽性、復發率及死亡率:根據術后肝切緣病理結果判定:以病變累及切緣,病變剛及切緣或切緣可見病變、病變距切緣<1mm,在切緣的一個高倍鏡視野內可見。對兩組患者進行為期24個月的隨訪,隨訪期間以患者出現復發視為事件終點,記錄為2年復發率;隨訪期間以原發性肝癌進展病死為事件終點,記錄為2年死亡率。
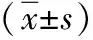
2 結果
2.1 兩組圍術期相關指標比較 觀察組的術中出血量少于對照組,住院時間及肛門排氣時間短于對照組,而手術時間長于對照組(P<0.05)。見表2。
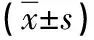
表2 兩組圍術期相關指標比較
2.2 兩組肝功能情況比較 術前,兩組ALT、TBiL、AST、ALB比較,差異無統計學意義(P>0.05);術后,觀察組的ALT、TBiL、AST低于對照組,而ALB高于對照組(P<0.05)。見表3。
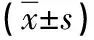
表3 兩組肝功能比較
2.3 兩組血清AFP、CYFRA21-1比較 術前,兩組AFP、CYFRA21-1比較,差異無統計學意義(P>0.05);術后,觀察組的AFP、CYFRA21-1低于對照組(P<0.05)。見表4。
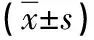
表4 兩組AFP-L3、CYFRA21-1比較
2.4 兩組并發癥情況比較 觀察組的并發癥發生率低于對照組(χ2=12.770,P<0.001)。見表5。

表5 兩組并發癥情況比較[n(%)]
2.5 兩組肝切緣陽性、復發率及死亡率比較 觀察組肝切緣陽性率、復發率均低于對照組(P<0.05),而兩組死亡率比較差異無統計學意義(P>0.05)。見表6。

表6 兩組肝切緣陽性、復發率及死亡率比較[n(%)]
3 討論
目前外科手術為治療原發性肝癌的首選手段,譬如肝切除術,通過切除肝段、肝葉或半肝等組織,徹底清除目標病灶,并保留足以維持肝功能的正常肝組織[4]。但經實際發現傳統肝切除術雖然能徹底清除腫瘤組織,但同時也遺留下較大的手術創傷,不僅會影響患者術后康復,而且會造成肝功能迅速下降,影響預后。近年來,隨著精準理念、微創理念在肝膽外科領域的深化和發展,提出了術前精準評估,優選個體化方案,有利于避免術中誤傷和減少術中出血量,實現肝臟的最大保護。即在數字化肝臟三維重建系統下通過快速完成肝臟三維重建,實現量化分析肝臟數據目標,再根據其分析結果制定精密的手術規劃,以便手術中按照之前擬定的計劃進行精細操作[5-6]。其中,數字化三維重建技術能讓醫師在術前了解患者肝臟剩余體積,并通過多角度旋轉觀察腫瘤位置、肝內脈管走形及腫瘤與脈管關系,模擬對腫瘤組織的切割,進而及時調整手術方案,對提高手術安全性具有重要意義。在本文結果中,基于數字化三維重建技術下予以腹腔鏡精準肝切除術的觀察組,其術中出血量低于單純實施腹腔鏡精準肝切除術的對照組,與卓翔等[7]學者研究結果基本一致,可能是經三維重建技術的術前評估能為腹腔鏡精準肝切除術規劃提供參考和優化手術路徑,可以最大限度切除病灶和減輕對周圍臟器損傷,最大限度保留正常肝臟組織,從而達到減少出血量的目的,并縮短住院時間和肛門排氣時間。
據相關研究[8]指出,肝癌患者術后復發、轉移可能與手術切緣有關。但目前關于原發性肝癌患者早期肝切除安全切緣尚無統一定論,若切緣選擇不當,可引起復發,影響患者預后。雖然腫瘤根治術要求切緣越大,病灶組織切除越徹底,但在原發性肝癌患者中,切緣太大,可能會減小保留的剩余肝體積,同時肝功能也會受到嚴重損害,譬如引起肝功能失代償。因此準確把握肝切除范圍一直是臨床研究的重點[9-10]。本文實施的腹腔鏡精準肝切除術,在數字化三維重建技術的輔助下,能充分把握脈管系統與腫瘤的空間關系,實現更準確地解剖性肝切除,降低肝切緣陽性率,提高生存率[11-12]。本文結果顯示,觀察組的肝切緣陽性率、復發率均低于對照組,說明基于數字化三維重建技術下實施腹腔鏡精準肝切除術有利于改善原發性肝癌患者預后[13]。CYFRA21-1是一種細胞角蛋白19可溶性片段;AFP則是一種糖蛋白。據相關研究報道,這些指標參與了肝癌的發生發展,因此本文認為監測其水平變化有利于為治療效果評估提供參考。在本研究結果中可見,觀察組術后的AFP、CYFRA21-1顯著低于對照組,提示數字化三維重建技術下腹腔鏡精準肝切除術能準確地切除病灶組織,有利于改善預后。另外,在數字化三維重建技術指導下優化手術方案,能更加準確、可靠地處理肝臟斷面血管及膽管結構等,減少對肝臟的損害。故在肝功能指標比較中可見,觀察組術后ALT、TBiL、AST低于對照組,而ALB高于對照組,提示數字化三維重建技術下的腹腔鏡精準肝切除術能良好地改善肝功能情況。
綜上所述,基于數字化三維重建技術的腹腔鏡精準肝切除術治療原發性肝癌有利于縮短手術時間和減少出血量,加之病灶的精準切除對肝功能改善更明顯,對殘肝的保護更確切且安全性高。

