基于P物質和P-糖蛋白探討黃芪多糖溫敏凝膠改善小鼠放射性皮炎的機制
張國榮,張建萍,馬小花,周燕,武新安(蘭州大學第一醫院藥劑科,蘭州 730000)
黃芪為豆科植物蒙古黃芪Astragalusmembranaceus(Fisch.)Bge. var.mongholicus(Bge.)Hsiao或膜莢黃芪Astragalusmembranaceus(Fisch.)Bge.的干燥根,具有補氣升陽、固表止汗、斂瘡生肌等功效[1]。黃芪多糖(Astragalus polysaccharides,APS)是黃芪中含量最多的一類物質,是由葡萄糖、果糖、木糖、核糖、阿拉伯糖、半乳糖、甘露糖和鼠李糖組成的酸性多糖[2-3]。現代藥理學研究發現APS 具有抗感染、抗氧化、抗自由基和免疫調節等藥理作用,臨床廣泛應用于皮膚創傷、皰疹病毒感染、瘡瘍、過敏性皮膚病和燙傷等[4-6]。
放療是利用放射線治療腫瘤的一種局部方法,是目前治療惡性腫瘤的重要手段之一,約70%腫瘤患者需要接受放療。然而,95%的放療患者在放療后均會出現不同形式的放射性皮炎[7],部分患者甚至因出現3 級和4 級放射性皮炎,而不得不進行傷口處理,甚至中斷放療。因此,緩解或減慢放射性皮炎進展對于確保放療順利進行具有重要的意義。研究表明放射性皮炎與DNA 破壞,氧化應激和免疫破壞等有關[7-8]。P物質(substance P,SP)是參與皮膚局部免疫炎癥反應和促進創面修復的重要介質。P-糖蛋白(P-glycoprotein,P-gp)是分布于細胞膜上的外排轉運體,可促進毒性物質的排出。免疫組化研究顯示P-gp 在表皮、表皮角質形成細胞或真皮成纖維細胞中的表達較弱,而在人皮膚汗管、血管、神經鞘和肌肉中有明顯表達,其可將表皮細胞吸收的毒性物質及代謝廢物及時分泌到血流和汗管中,促進皮膚微環境的改善[9]。為此,本研究基于SP 和P-gp 探討APS 溫敏凝膠對小鼠放射性皮炎的作用及其機制。
1 材料
1.1 儀器
Western blot 電泳儀(DYCZ-24DN)、 濕轉儀(DYCZ-40D)和水平脫色搖床(WD-9405B)(北京六一儀器廠);Unique 型直線加速器(美國VARIAN 醫療設備有限公司);羅氏實時熒光定量PCR 儀(480/480 Ⅱ)(瑞士羅氏公司);GBS 光學顯微鏡(德國GBS 公司)。
1.2 試藥
APS (西安明澤生物科技有限公司,純度>90%,批號:89250-26-0);泊洛沙姆407(德國巴斯夫公司,批號:GNC08825B);泊洛沙姆188(德國巴斯夫公司,批號:GNC33221B);SDS-PAGE 凝膠配制試劑盒和組織裂解液(碧云天生物科技研究所);RNA 提取試劑盒和甲苯胺藍染液(北京索萊寶科技有限公司);蘇木素染液和伊紅染液(博士德生物);ECL 發光液(北京天能公司);CD31(武漢塞維爾生物科技有限公司);P-gp 抗體(Abcam 有限公司);雙染檢測試劑(抗小鼠IgG/AP+抗兔IgG/HRP)(北京中杉金橋生物技術有限公司);去離子水(自制)。
1.3 動物
健康SPF 級昆明種小鼠,雄性,體質量18 ~22 g,動物許可證書號:SCXK(甘)2019-0723,由蘭州大學實驗動物中心提供。所有實驗均按照動物保護法進行,并經蘭州大學第一醫院倫理委員會批準。
2 方法
2.1 APS 溫敏凝膠的制備
將處方量的APS、1,2-丙二醇和0.02%苯扎溴銨先溶于適量純化水中,攪拌加入泊洛沙姆407 和泊洛沙姆188,4℃放置24 h 至泊洛沙姆完全溶解,最后加水至全量,攪拌混勻,即得。膠凝溫度為(32.3±0.2)℃,pH 值為7.03。
2.2 小鼠放射性皮炎模型的制備[10-11]
小鼠隨機分為正常對照組、模型組、APS 溫敏凝膠組和空白溫敏凝膠組,每組10 只,除正常對照組,其他組小鼠腹部以8% Na2S 溶液去毛,將同組10 只小鼠固定于鼠板上,進行10 Gy X 線的照射,每日照射1 次,連續照射5 d(如圖1所示)。每次照射后,在腹部涂抹APS 溫敏凝膠或空白溫敏凝膠,每日涂抹2 次,涂抹15 d。
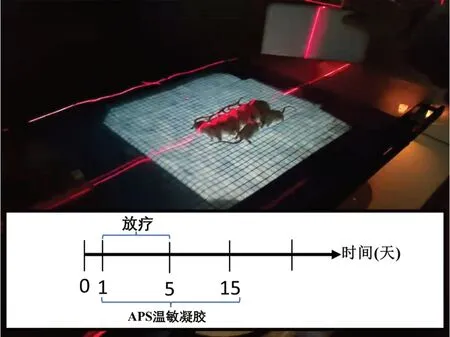
圖1 小鼠放射性皮炎模型的制備Fig 1 Preparation of radioactive dermatitis model in mice
2.3 RT-PCR 法測定皮膚中SP 和炎癥因子的mRNA
根據RNA 提取試劑盒說明書提取皮膚組織中的總RNA,經總RNA 濃度測定、反轉錄、PCR 反應和PCR 產物定量分析,考察APS 對皮膚中SP和炎癥因子白介素(IL)-6、IL-10、IL-12 mRNA的影響。SP 和各炎癥因子引物序列見表1[12]。

表1 引物序列Tab 1 Primer paris for RT-PCR
2.4 Western blot 法測定皮膚中P-gp 的表達
稱取皮膚組織0.04 g,加組織裂解液提取蛋白。然后采用BCA 蛋白定量檢測法測定并計算蛋白濃度。再采用聚丙烯酰胺凝膠電泳,依次經制膠、上樣與電泳、轉膜、封閉、抗體孵育和ECL 發光液顯影成像,最后用Image J 軟件對成像結果進行灰度值統計及分析。
2.5 組織形態學檢查
將皮膚組織置于10% 甲醛溶液中固化48 h,常規制備石蠟組織切片,經蘇木精-伊紅染色及甲苯胺藍染色,于光學顯微鏡下觀察皮膚組織病理學形態。
2.6 CD31 免疫熒光染色[13]
組織切片常規梯度脫蠟后,用抗原修復緩沖液進行抗原修復、洗滌(5 min×3 次)、封閉液封閉30 min、4℃孵育一抗過夜、洗滌(5 min×3次)、孵育二抗50 min、洗滌(5 min×3 次)、加 DAPI 染液避光-室溫孵育10 min、洗滌(5 min×3 次)、抗熒光淬滅封片劑封片,最后于熒光顯微鏡下觀察并采集圖像。
2.7 數據處理
數據結果以平均值±標準差表示,采用IBM SPSS21 統計軟件進行數據分析,通過單因素方差進行統計學分析,P<0.05 為差異具有統計學意義。采用Graphpad Prism 軟件繪圖。
3 結果
3.1 APS 溫敏凝膠對放射性皮炎小鼠創面的影響
模型組照射5 d 時,小鼠皮膚開始發紅伴輕度水腫,有少量分泌物滲出,紅腫部位向外蔓延趨勢;恢復5 d 后紅腫減輕,無明顯分泌物滲出;恢復10 d 后無明顯紅腫,皮毛恢復生長。與模型比較,APS溫敏凝膠組照射5 d 時,皮膚紅腫及分泌物滲出情況較輕,小鼠抓撓次數較少;恢復5 d 后可見明顯結痂;恢復10 d 后無明顯紅腫,皮毛恢復生長較好(見圖2)。空白溫敏凝膠組對小鼠創面無明顯影響。
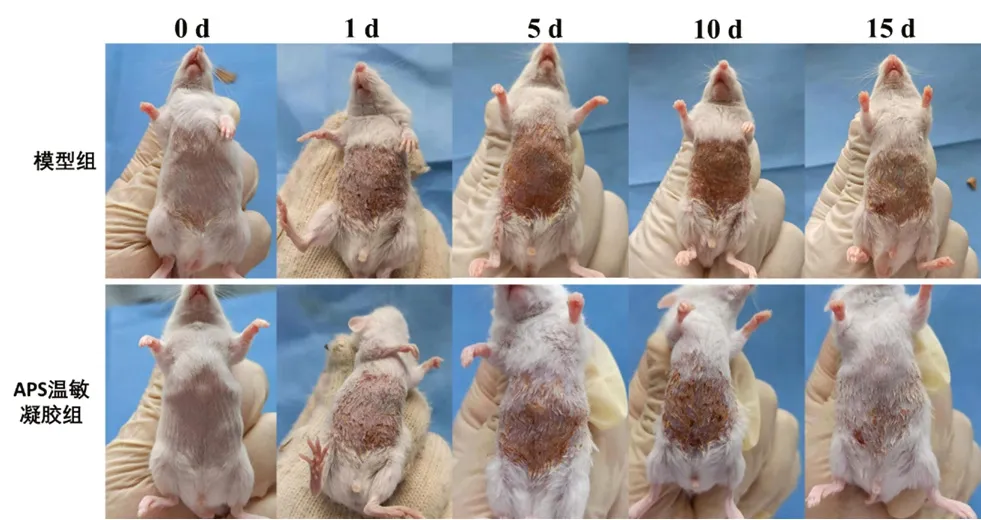
圖2 APS 溫敏凝膠對放射性皮炎小鼠創面情況的考察Fig 2 Effect of APS thermosensitive gel on the wound of radioactive dermatitis
3.2 APS 溫敏凝膠對放射性皮炎SP 和炎癥因子的影響
0 ~5 d 時,模型組和APS 溫敏凝膠組的SP、IL-6、IL-10 和IL-12 mRNA 隨照射時間延長而逐漸升高,且APS 溫敏凝膠組的SP 高于模型組;10 d 和15 d 時APS 溫敏凝膠組的SP、IL-6、IL-10 和IL-12 mRNA 較模型組均顯著降低,見圖3。
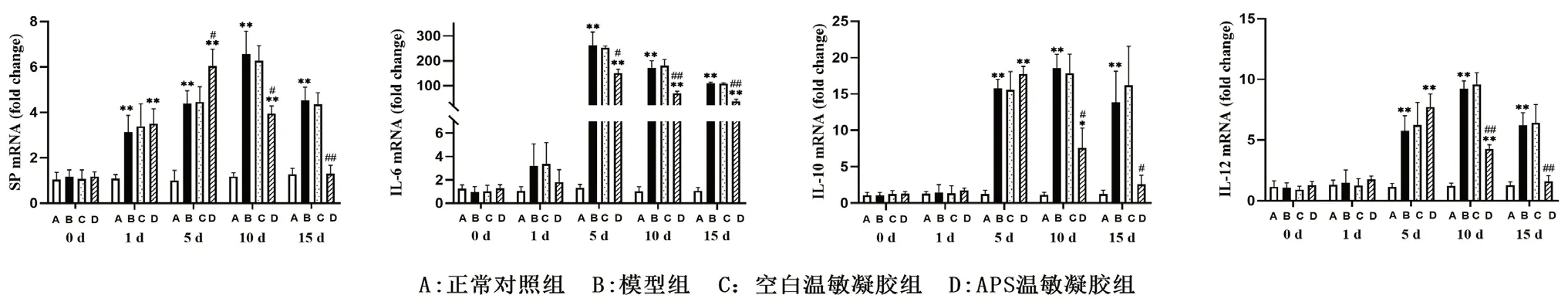
圖3 ASP 溫敏凝膠對放射性皮炎SP 和炎癥因子的影響Fig 3 Effect of APS thermosensitive gel on SP and inflammatory factors of radioactive dermatitis
3.3 APS 溫敏凝膠對放射性皮炎P-gp 的影響
如圖4a 所示,放療后皮膚組織中P-gp 的表達顯著降低,即使放療結束10 d 后,皮膚組織中的P-gp 仍顯著低于正常對照組。在放療的同時給予APS 溫敏凝膠,可顯著增加皮膚組織中的P-gp 表達,且放療后第5 d 的表達量仍顯著高于正常對照組,直到放療結束10 d 后,P-gp 較正常對照組差異無統計學意義。
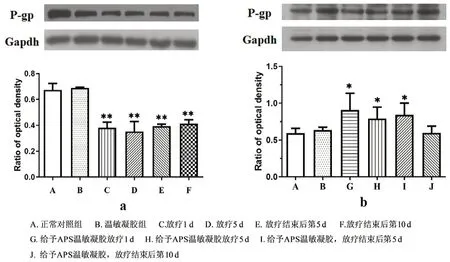
圖4 放療(a)及放療的同時給予APS 溫敏凝膠(b)對皮膚組織中P-gp 表達的影響Fig 4 Effect of radiotherapy(a)and combination with APS thermosensitive gel(b)on P-gp in the skin tissue
3.4 APS 溫敏凝膠對放射性皮炎病理學改變的影響
HE 染色顯示正常對照組及空白溫敏凝膠組表皮輕度角化,真皮淺層可見少量淋巴細胞、中性粒細胞、肥大細胞浸潤,毛囊汗腺未見明顯異常。模型組15 d 時可見表皮過度角化伴角化不全,真皮充血水腫,真皮淺層皮膚附屬器周圍有較多淋巴細胞、中性粒細胞、肥大細胞浸潤。APS 溫敏凝膠組給藥15 d 時表皮輕度角化,真皮輕度水腫,真皮淺層皮膚附屬器周圍有少量淋巴細胞、中性粒細胞、肥大細胞浸潤。甲苯胺藍染色顯示正常對照組及空白溫敏凝膠組真皮淺層有少量肥大細胞,模型組15 d 時可見真皮淺層有大量肥大細胞,APS 溫敏凝膠組15 d 時真皮淺層有少量肥大細胞,較模型組明顯減少,見圖5。
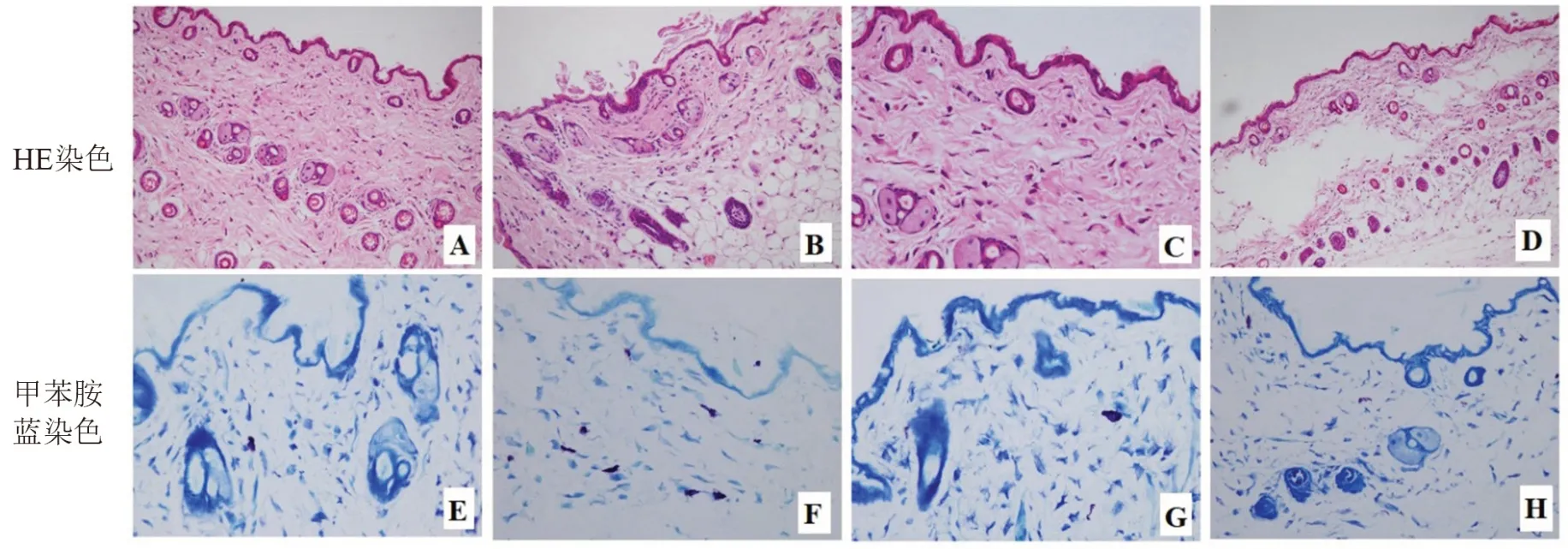
圖5 APS 溫敏凝膠對放射性皮炎病理學改變的影響Fig 5 Effect of APS thermosensitive gel on the pathological changes in radioactive dermatitis
3.5 APS 溫敏凝膠對放射性皮炎微血管的影響
與正常對照組、模型組和空白溫敏凝膠組相比較,APS 溫敏凝膠組的血管損傷最小,見圖6。
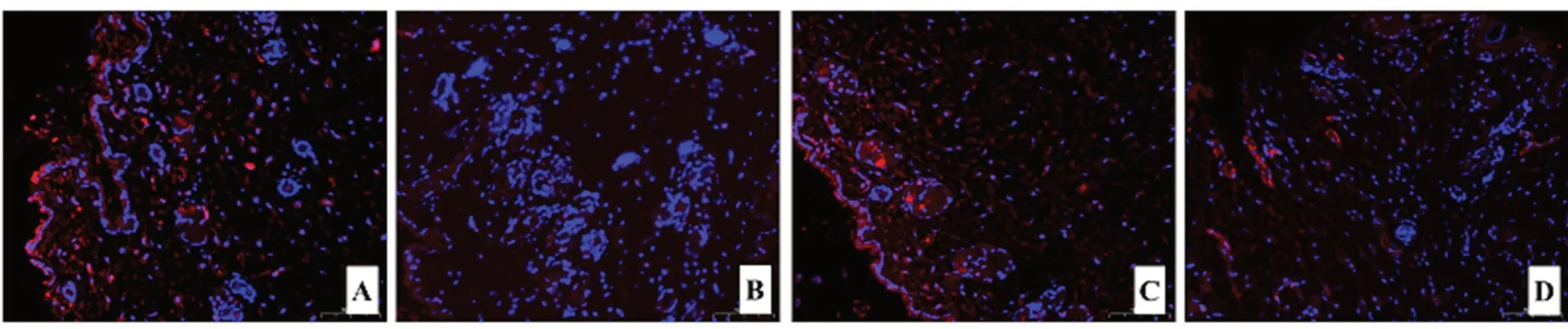
圖6 免疫熒光染色檢測APS 溫敏凝膠對放射性皮炎微血管的影響(×15)Fig 6 Effect of APS thermosensitive gel on the microvascular of radioactive dermatitis detected by immunological fluorescence assay(×15)
4 討論
放射治療中高能X 線產生大量的自由基,并導致DNA 雙鏈斷裂,其不僅抑制了皮膚基底角質形成細胞的增殖和分化,而且還可引起炎性反應,引發放射性皮炎[14]。SP 是一種高活性神經肽類物質,合成于背根神經節的小型神經元胞體中,再由軸漿運輸至外周神經末梢,儲存于皮膚感覺神經末梢的大囊泡中。當神經末梢受到刺激時,囊泡中SP 釋放,并與其受體結合后,在皮膚免疫炎癥和創傷修復中扮演重要角色。Kim 等[15]研究發現慢性皮膚損傷如糖尿病大鼠皮膚潰瘍因無充足的血供,使營養物質和生長因子很難達到損傷部位,導致傷口難以愈合,SP 偶聯自組裝肽水凝膠可動員具有修復作用的內源性間充質干細胞歸巢,促進糖尿病大鼠皮膚的傷口愈合。有學者報道生物活性SP 和轉化生長因子裝載的殼聚糖微粒復合水凝膠可顯著增加放射性皮炎的再生修復[16]。
本研究發現,0 ~5 d 時小鼠皮膚組織中SP、IL-6、IL-10 和IL-12 mRNA 逐漸升高,且APS 溫敏凝膠組的SP 高于模型組,提示APS 在炎癥早期一定程度可增加SP 表達以促進皮膚局部免疫炎性因子參與的修復反應。15 d 時模型組肥大細胞數目顯著增加、病理損傷以及血管丟失最嚴重,15 d 時APS 溫敏凝膠組SP 及炎癥因子mRNA 顯著降低,且可有效緩解肥大細胞數目的增加、改善病理學損傷和血管丟失。這些結果與文獻報道一致,SP 可增加肥大細胞蓄積[17],高濃度SP 可誘導肥大細胞脫顆粒[18],肥大細胞脫顆粒和組胺釋放的免疫反應進一步加重了急性放射性皮炎[19]。與野生型小鼠相比較,敲除外排性轉運體P-gp 和乳腺癌耐藥蛋白的小鼠皮炎及抓撓行為更嚴重,代謝組學分析顯示皮膚代謝物組胺、尿酸鹽和5-羥色胺在皮膚中的濃度較高[20],提示這兩種轉運體可能與皮膚炎癥介質有關,二者具有保護作用。本研究也發現模型組P-gp 的表達顯著降低,APS溫敏凝膠在一定時間內可增加P-gp 的表達。
綜上所述,APS 溫敏凝膠可增加SP 和P-gp的表達,降低炎癥因子的表達,有效緩解小鼠放射性皮炎,提示APS 具有一定的皮膚保護作用。