毛白楊雌、雄花蕾總黃酮含量及抗氧化活性的比較
李卓俊,吳翠,徐博,宋平平,劉震營,巢志茂(中國中醫科學院中藥研究所,北京 100700)
毛白楊(Populus tomentosaCarrière)為楊柳科楊屬落葉大喬木,在華北地區有大量的種植,屬于常見的造林綠化樹種,其葉、樹皮和雄花序均可作為中藥使用。1977年版《中國藥典》中記載毛白楊干燥雄花序是中藥楊樹花的植物來源,具有化濕止痢的功效,用于治療細菌性痢疾和急性腸炎[1]。在《中藥大辭典》中記載,毛白楊樹皮具有清熱利濕的功效,主要用于治療赤白痢疾、日久不止、淋濁白帶、急性肝炎、支氣管炎、肺炎、蛔蟲、習慣性便秘等[2]。臨床上使用毛白楊花、葉和樹皮用于治療急性菌痢、骨肉瘤、外傷感染[3-4]。楊樹花目前還用作獸藥,用于治療牛羊豬等的痢疾、腹瀉等疾病,并在山東等地有食用的歷史[5-7]。毛白楊的化學成分主要有黃酮類、甾醇類、有機酸類、酚及其苷類[8-10],具有抗炎鎮痛、抗腹瀉、抑菌、抗氧化等藥理活性[11-13]。
雌雄異株植物是指在具有單性花的種子植物中,雌花和雄花長在不同的植株中[14]。對于雌雄異株植物性別之間存在的理化性質和藥效活性的差異的研究,早期僅見極少的報道[15]。有研究通過高效液相色譜指紋圖譜方法結合多元統計分析方法對毛白楊的樹皮進行雌雄的比較發現,雌株中micranthoside 的含量高于雄株,而siebolside B、櫻花苷、異櫻花苷、isograndidentatin A 的含量低于雄株[16]。有研究通過頂空進樣固相微萃取氣質聯用法對毛白楊花蕾的揮發性成分進行比較發現,雌株中2-環己烯-1-酮、苯甲酸芐酯和苯甲酸甲酯的含量高于雄株,而苯甲酸乙酯的含量低于雄株[17]。通過磁共振技術結合多元統計分析對毛白楊雌雄花蕾進行化學成分研究發現,雌雄花蕾間主要差異成分有胡蘿卜苷、β-谷甾醇、熊果酸和白樺脂酮酸,均為雄株中的含量高于雌株[18]。盡管存在一些成分含量高低不等的現象,但對于雌雄異株植物毛白楊的花蕾尚未見總黃酮含量及抗氧化活性差異的研究報道。
本文收集了成年毛白楊雌株和雄株的花蕾,通過亞硝酸鈉-硝酸鋁顯色法測定了總黃酮的含量,通過DPPH 和ABTS 自由基清除法評價了體外抗氧化活性,并進行了雌雄組之間的比較,為毛白楊的開發利用了提供科學依據。
1 材料
1.1 試藥
于2020年2月23日至28日在北京市東城區東直門北大街、通教寺、民安小區、安定門東大街、青龍胡同和朝陽區黃金苑等地點(東經116°22'53'' ~116°26'57'', 北緯39°52'36'' ~39°57'17'')采集了成年毛白楊的花蕾,陰干。性別是通過該植株之后形成的花序和果實確認。雌株花蕾標記為F1 ~F11,雄株花蕾標記為M1 ~M11。經中國中醫科學院中藥研究所巢志茂研究員鑒定為楊柳科植物毛白楊的干燥花蕾,樣品貯藏于中國中醫科學院中藥研究所。
亞硝酸鈉、氫氧化鈉(分析純,北京化工廠),硝酸鋁[分析純,福晨(天津)化學試劑有限公司],兒茶素對照品(批號:154-23-4,純度:98%,成都埃法生物科技有限公司),6-羥基-2,5,7,8-四甲基色烷-2-羧酸[Trolox,貨號:238813,Sigma-Aldrich(上海)貿易有限公司,純度≥97%],2,2-聯苯基-1-苦基肼基(DPPH,批號:D1915107,上海阿拉丁生化科技股份有限公司,純度≥97%),2,2'-聯氮雙(3-乙基苯并噻唑啉-6-磺酸)二銨鹽[ABTS,貨號:A1888,純度≥98%,Sigma-Aldrich(上海)貿易有限公司];無水乙醇(分析純,天津市鼎盛鑫化工有限公司),甲醇(分析純,天津市富宇精細化工有限公司),純凈水(杭州娃哈哈集團有限公司)。
1.2 儀器
TU-1810 紫外可見分光光度計(北京普析通用儀器有限責任公司);Ohaus CP224C 型電子天平[精度:0.1 mg,奧豪斯(上海)儀器有限公司];ME155DU型電子天平[精度:0.01 mg,梅特勒-托利多儀器(上海)有限公司];DFT-50A 型手提式高速粉碎機(溫嶺市林大機械有限公司);DFD-700 型雙列四孔電熱恒溫水浴鍋(天津泰斯特儀器有限公司)。
2 方法
2.1 溶液的制備
2.1.1 供試品溶液的制備 將樣品粉碎,過40目篩。精密稱取2.0 g 粉末,置于50 mL 具塞錐形瓶中,精密加入70%甲醇25 mL,稱定質量后,水浴鍋上加熱回流30 min,放置室溫后,再次稱定質量,用70%甲醇補足減失的質量,搖勻,過濾,取續濾液即得。
2.1.2 顯色溶液的制備 精密稱取亞硝酸鈉5.0 g,加水溶解并定容至100 mL 量瓶中,搖勻即得5%NaNO2溶液。精密稱取硝酸鋁10.0 g,加水溶解并定容至100 mL 量瓶中,搖勻即得10%Al(NO3)3溶液。精密稱取氫氧化鈉4.0 g,加水溶解并定容至100 mL 量瓶中,搖勻即得1 mol·L-1NaOH 溶液。精密稱取DPPH 7.00 mg,加甲醇溶解并定容至100 mL 棕色量瓶中,搖勻即得0.07 mg·mL-1DPPH 溶液。精密稱取ABTS 0.10 g,加水溶解并定容至25 mL 棕色量瓶中,搖勻即得7 mmol·L-1ABTS 溶液。精密稱取過硫酸鉀0.19 g,加水溶解并定容至5 mL 棕色量瓶中,搖勻即得140 mmol·L-1K2S2O8溶液。
2.2 總黃酮的含量測定
參考相關文獻[19-20]并對測定方法進行優化。
2.2.1 標準曲線的制備 精密稱取兒茶素10.80 mg,加水溶解并定容至100 mL 量瓶中,搖勻,即得0.11 mg·mL-1兒茶素對照品溶液。精密吸取0.11 mg·mL-1兒茶素對照品溶液1.4、1.6、2.0、3.0、4.0、5.0 mL,置于25 mL 量瓶中,加入6 mL 水,搖勻,加入5%NaNO21 mL,搖勻,靜置6 min,加入10%Al(NO3)31 mL,搖勻,靜置6 min,加入1 mol·L-1NaOH 溶液10 mL,加水至刻度線,搖勻,放置10 min 后測定,以70%甲醇為空白,在510 nm 的波長處測定吸光度,以兒茶素對照品溶液質量濃度(mg·mL-1)為橫坐標,以吸光度為縱坐標,繪制標準曲線。
2.2.2 供試品溶液的測定 精密吸取毛白楊雌、雄花蕾的供試品溶液20 μL,按“2.2.1”項下方法測定吸光度。根據標準曲線計算毛白楊雌、雄花蕾中總黃酮的含量。
2.3 DPPH 自由基清除能力測定
參考相關文獻[21-22]并對測定方法進行優化。
2.3.1 標準曲線的制備 精密稱取Trolox 對照品10.14 mg,加甲醇溶解并定容至50 mL 棕色量瓶中,搖勻,即得0.20 mg·mL-1Trolox 對照品溶液。精密吸取Trolox 對照品溶液20、40、60、80、100、120 μL,置于5 mL 棕色量瓶中,加入0.07 mg·mL-1DPPH 溶液2 mL,搖勻,加甲醇至刻度線,搖勻,避光靜置30 min,在517 nm 波長下測定吸光度為A0,計算DPPH 自由基清除率,以Trolox 對照品溶液的濃度(μmol·L-1)為橫坐標,清除率為縱坐標,繪制標準曲線。
DPPH 清除率(%)=[1-(A1-A0)/A2]×100%
式中:A1為70%甲醇空白組的吸光度;A2為DPPH 溶液對照組的吸光度。
2.3.2 供試品溶液的測定 將“2.1.1”項下供試品溶液稀釋10 倍,精密吸取20 μL,按“2.3.1”項下方法測定吸光度A0,平行測定3 次,取平均值,計算DPPH 自由基清除率。根據標準曲線結合稀釋程度計算TEAC 值。TEAC 值是指在對DPPH 自由基相同的清除率情況下,樣品所對應的Trolox 濃度。
2.4 ABTS 自由基清除能力測定
參考相關文獻[23-24]并對測定方法進行優化。精密吸取140 mmol·L-1K2S2O8溶液176 μL 置于具塞錐形瓶中,加入7 mmol·L-1ABTS 溶液10 mL,搖勻,室溫且黑暗條件下反應16 h,即得ABTS 儲備液。使用前量取一定量的ABTS 儲備液,加無水乙醇稀釋,在734 nm 波長下測定吸光度,直至稀釋后的吸光度為(0.70±0.02),即得ABTS 工作液。
2.4.1 標準曲線的制備 分別精密稱取Trolox 對照品0.24、1.02、1.50、2.14、2.60、3.16 mg 置于5 mL 棕色量瓶中,加無水乙醇溶解并定容,搖勻,即得0.048、0.204、0.300、0.428、0.520、0.632 mg·mL-1Trolox 對照品溶液。精密吸取各質量濃度的Trolox 對照品溶液20 μL,置于5 mL 棕色量瓶中,加入ABTS 工作液3 mL,搖勻,避光反應4 min,在734 nm 的波長下測定吸光度為Aa,計算ABTS 自由基清除率,以Trolox 對照品溶液的濃度(mmol·L-1)為橫坐標,清除率為縱坐標,繪制標準曲線。
ABTS 清除率(%)=[1-(Ab-Aa)/Ac]×100%
式中:Ab為70%甲醇空白組的吸光度;Ac為ABTS 工作液對照組的吸光度。
2.4.2 供試品溶液的測定 將“2.1.1”項下供試品溶液稀釋10 倍,精密吸取20 μL,按“2.4.1”項下方法測定吸光度Aa,平行測定3 次,取平均值,計算ABTS 自由基清除率。根據標準曲線結合稀釋程度計算TEAC 值。TEAC 值是指在對ABTS 自由基相同的清除率情況下,樣品所對應的Trolox 濃度。
3 結果
3.1 總黃酮含量測定結果
按“2.2.1”項下方法繪制標準曲線,得到線性回歸方程為Y=31.50X-0.01(r2=0.9995),線性范圍為0.0069 ~0.0259 mg·mL-1。 按“2.2.2”項下方法對22 個毛白楊花蕾樣品進行總黃酮含量的測定,結果見表1。

表1 毛白楊花蕾的總黃酮含量的測定結果(n =3)Tab 1 Total flavonoid content of flower buds of Populus tomentosa(n =3)
3.2 DPPH 自由基清除法
按“2.3.1”項下方法繪制標準曲線,得到線性回歸方程為Y=1.187×104X+2.53(r2=0.9990),線性范圍為0.0081 ~0.0049 mg·mL-1。按“2.3.2”項下方法對22 個毛白楊花蕾樣品的DPPH 自由基清除能力進行測定,其TEAC 值結果見表2。
3.3 ABTS 自由基清除法
按“2.4.1”項下方法繪制標準曲線,得到線性回歸方程為Y=105.25X+1.22(r2=0.9998),線性范圍為0.0480 ~0.6320 mg·mL-1。按“2.4.2”項下方法對22 個毛白楊花蕾樣品的ABTS 自由基清除能力進行測定,TEAC 值結果見表2。
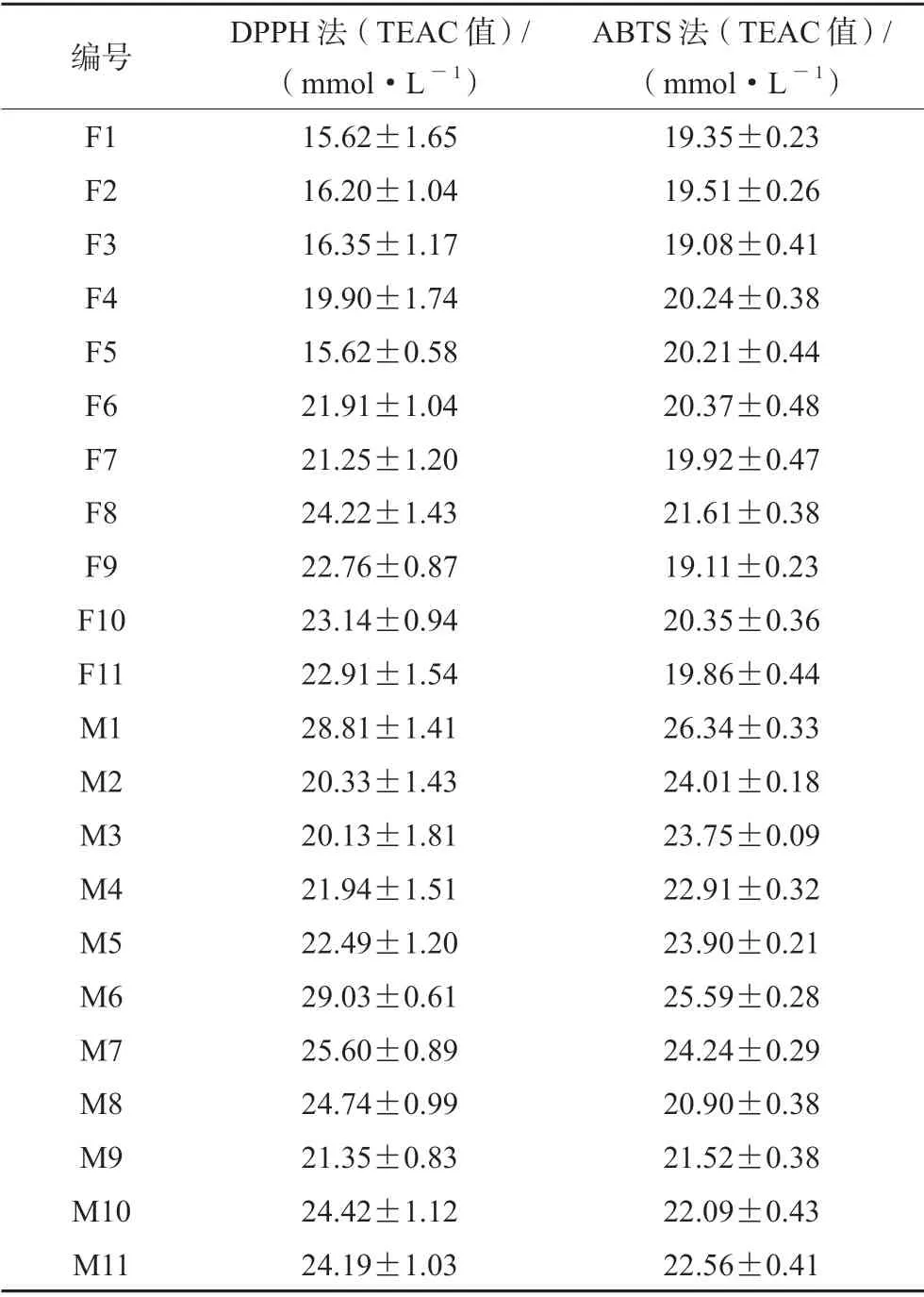
表2 毛白楊花蕾的體外抗氧化活性(n =3)Tab 2 In vitro antioxidant activity of flower buds of Populus tomentosa (n =3)
3.4 總黃酮含量的統計學分析
運用IBM SPSS Statistics 25 對毛白楊花蕾的總黃酮含量進行統計學分析,結果呈明顯的正態分布(P>0.05);對其進行獨立樣本t檢驗,結果顯示雌雄花蕾之間的總黃酮含量差異具有統計學意義(P<0.05)。其中雌花蕾的總黃酮含量為24.30 ~27.56 mg·g-1,雄花蕾的總黃酮含量為25.54 ~32.55 mg·g-1。雌雄花蕾之間的結果比較顯示,雄花蕾中的總黃酮含量高于雌花蕾,說明毛白楊的總黃酮含量與性別有關。
3.5 體外抗氧化活性的統計學分析
運用IBM SPSS Statistics 25 分別對毛白楊雌雄花蕾的TEAC 值(DPPH 法和ABTS 法)進行統計學分析,結果認為均呈明顯的正態分布(P>0.05);對DPPH 法和ABTS 法各自的TEAC 值分別進行獨立樣本t檢驗,結果顯示這兩種方法的TEAC 值在雌雄花蕾之間差異均具有統計學意義(P<0.05)。其中DPPH 法毛白楊雌、雄花蕾的TEAC 值分別為15.62 ~24.22 mmol·L-1和20.13 ~29.03 mmol·L-1;ABTS 法毛白楊雌、雄花蕾的TEAC 值分別為19.08 ~21.61 mmol·L-1和20.90 ~26.34 mmol·L-1。雌雄差異之間的結果比較顯示,雄花蕾的TEAC 值(DPPH 法和ABTS 法)均大于雌花蕾。TEAC 值越大,對DPPH 和ABTS 自由基的清除能力越強,抗氧化能力越強,即雄花蕾的抗氧化活性高于雌花蕾。
3.6 毛白楊花蕾總黃酮含量與其抗氧化活性的相關性分析
運用IBM SPSS Statistics 25 軟件,將22 個毛白楊花蕾的總黃酮含量與其對應的DPPH 法和ABTS 法所測定的TEAC 值分別進行相關性分析,結果見表3。兩種活性方法測定的TEAC 值均與總黃酮含量成正相關,說明毛白楊花蕾的抗氧化活性與其總黃酮含量成正相關。
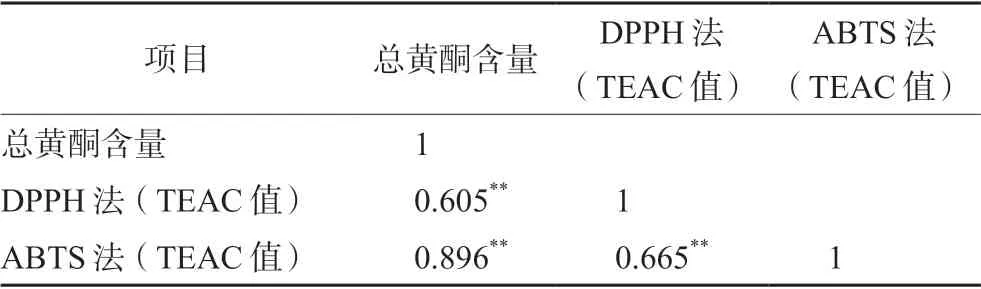
表3 毛白楊花蕾總黃酮含量與其抗氧化活性的相關性Tab 3 Correlation between total flavonoid content and antioxidant activity of flower buds of Populus tomentosa
4 討論
本研究通過亞硝酸鈉-硝酸鋁顯色法測定了毛白楊雌雄花蕾的總黃酮含量,結果顯示雌花蕾的總黃酮平均含量為25.60 mg·g-1,雄花蕾的為30.39 mg·g-1,兩者差異有統計學意義,雄花蕾的黃酮含量高于雌花蕾。黃酮類成分多具有抗氧化、抗菌、抗炎等活性[25],這可能是選擇雄花序入藥的理由之一。此外,通過DPPH 和ABTS 自由基清除法評價和比較毛白楊雌雄花蕾的體外抗氧化活性,認為雌雄花蕾均具有一定的抗氧化活性,雌花蕾的平均TEAC 值(DPPH 法和ABTS 法)分別為19.99 mmol·L-1和19.97 mmol·L-1,雄花蕾的平均TEAC 值(DPPH 法和ABTS 法)分別為23.91 mmol·L-1和23.44 mmol·L-1,雌雄花蕾的比較差異均具有統計學意義,雄花蕾兩種方法的TEAC 值均高于雌花蕾,表明雄花蕾的抗氧化活性高于雌花蕾。兩種方法測得的毛白楊花蕾的體外抗氧化活性均與其總黃酮含量成正相關,表明黃酮類成分可能是楊樹花的重要有效成分。
與毛白楊一樣來源于雌雄異株植物的中藥還有杜仲、天花粉、桑葉等,毛白楊的花蕾入藥是有明確的性別限制,但是,其他品種在實際的中醫臨床應用中并未進行性別的區別和限制。毛白楊花蕾的抗氧化活性與雌雄有關,其他品種的中藥是否也存在性別間活性大小的差異,臨床上是否需要進行性別的區分,本研究的結果給出了一個新的啟發。雌雄異株植物在外觀性狀上是存在一定差異的,開展化學成分含量、藥效活性以及臨床效果的差異的研究,不僅將揭示雌雄異株植物的性別本質,還將有可能在提高中醫藥的臨床療效提供新的思考角度。