蒼耳子治療變應性鼻炎的網絡藥理學分析及作用機制研究
李丹,章秀梅,宣自華,劉叢彬,俞年軍,2,3,謝冬梅,2,3*(.安徽中醫藥大學,合肥 23002;2.安徽省中醫藥科學院 中藥資源保護與開發研究所,合肥 23002;3.中藥研究與開發安徽省重點實驗室,合肥 23002)
變應性鼻炎(allergic rhinitis,AR)又稱過敏性鼻炎,是特異性個體的鼻黏膜受到過敏原的刺激后,IgE 的介導功能被激活而引起的鼻腔慢性炎癥性疾病。西醫臨床常用包括抗組胺藥物、糖皮質激素、口服抗白三烯類等藥物進行治療,但是不同患者之間可能存在療效差異,且對持續性AR 需維持治療[1],因此尋找療效顯著的中藥顯得尤為重要。
蒼耳子(Xanthii Fructus)為菊科植物蒼耳(Xanthium sibiricumPatr.)的干燥成熟帶總苞的果實,具有散風寒、通鼻竅、祛風濕的功效[2],為歷代醫家常用的鼻科要藥。現代研究表明,蒼耳子含有揮發油類、甾醇類、倍半萜內酯類、水溶性苷類、酚酸及其衍生物、黃酮類、蒽醌類等化合物[3-6],其抗炎作用已得到相關學者的認可[7]。但是對蒼耳子發揮抗炎活性的機制仍不清晰,因此本研究通過網絡藥理學對蒼耳子治療AR 的主要化學成分、作用靶點及信號通路進行了預測分析;同時,通過動物實驗對預測得到的通路上的關鍵靶點進行檢測,探究蒼耳子治療AR 的活性成分及其作用機制。
1 資料與方法
1.1 網絡藥理學
1.1.1 數據庫靶點篩選 查閱文獻,并搜索中藥系統藥理學分析平臺數據庫(TCMSP,https://tcmspw. com/index. php),整理數據庫中蒼耳子的全部成分。對搜索得到的化學成分保存后導入SwissADME 數據庫中,進行預測分析確定出其作用靶點;按照Uniprot 編號,在Uniprot 數據庫中查找對應的gene offical sympol 格式,將其作為靶點基因保存。
1.1.2 成分-炎癥疾病的交集靶點分析 以“rhinitis”為關鍵詞,在DisGeNET 相關的數據庫中進行搜索,確定出可能的靶點,接著基于中位數篩選“Relevance score”值,在此基礎上進行搜索得到滿足相關要求的靶點信息。合并處理提取的信息,刪除其中重復項后,將對應的靶點導入Venn 工具中進行繪圖處理,從而確定出相關的交集靶點。
1.1.3 靶點的GO 及KEGG 通路富集分析 核心靶點確定后導入Metascape 數據庫中,設定物種為“人類”,開展GO 生物功能富集處理,從而確定出生物過程(biological process,BP)、細胞組成(cell composition,CC)、分子功能(molecular function,MF)富集分析;KEGG 通路在富集研究時選擇同樣的數據庫,將以上確定出的結果導入Cytoscape 3.5.1 中進行相關性分析,從而得到成分-靶點-通路網絡圖。
1.2 動物實驗
1.2.1 儀器與試藥 SDS-PAGE 凝膠制備試劑盒(ASPEN 公司);RIPA 總蛋白裂解液、BCA 蛋白質濃度測定試劑盒(ASPEN 公司);ECL 化學發光檢測試劑盒(上海碧云天生物技術有限公司);GAPDH 抗體(ab37168)(Abcam 公司);PI3K 抗體(CST 4249);Akt 抗體(CST 9272);P-Akt抗體(CST 4060);IL-4 ELISA 檢測試劑盒(批號:05/2021)、IFN-γELISA 檢測試劑盒(批號:05/2021)、IgE ELISA 檢測試劑盒(批號:05/2021)(上海將來實業股份有限公司)。
1.2.2 動物 SPF 級健康SD 大鼠60 只,雌雄各半,體質量200 ~250 g [濟南朋悅實驗動物繁育有限公司,許可證號:SCXK(魯)20190003]。
1.2.3 藥物的制備 蒼耳子藥材購于安徽省亳州藥材市場,經安徽中醫藥大學謝冬梅副教授鑒定為菊科植物蒼耳(Xanthium sibiricumPatr.)成熟帶總苞的果實。取蒼耳子藥材500 g,自然干燥后粉碎,參考文獻中的煎煮法進行提取,獲得蒼耳子石油醚、乙酸乙酯、正丁醇和水提取部位[8]。
1.2.4 AR 模型大鼠的復制 參照課題組前期的造模方法[9]制備AR 大鼠模型。基礎致敏階段:以150 mg 雞卵清蛋白(ovalbumin,OVA)作為抗原,15 g 氫氧化鋁粉末作為佐劑,兩者共同混懸于50 mL 生理鹽水中,作為致敏劑。采用腹腔注射的方法,每只大鼠注射致敏劑1 mL,隔日1次,共進行7 次基礎致敏,用時14 d,正常組大鼠腹腔注射等容積的生理鹽水。局部刺激階段:第15 ~21日采用滴鼻法,以2% OVA 生理鹽水溶液滴入大鼠兩側鼻孔,每側50 μL,每日1 次,正常組大鼠以等容積的生理鹽水進行滴鼻。造模成功后,需要以2%OVA 生理鹽水溶液隔日滴鼻維持對鼻部的刺激以及過敏性癥狀直到實驗結束。
1.2.5 實驗分組與給藥 將造模成功的大鼠重新隨機分成模型組、氯雷他定組、石油醚組、乙酸乙酯組、正丁醇組和總水提物組。各給藥組大鼠通過灌胃分別給予相應的藥物,每日1 次,共給藥14 次。氯雷他定給藥劑量為2 mg·kg-1;石油醚部位、乙酸乙酯部位、正丁醇部位受試物以及總水提物的給藥劑量為5 g(生藥)·kg-1,各組大鼠的給藥體系均為1 mL/100 g。模型組和正常組大鼠灌胃給予等容積的生理鹽水。
1.2.6 鼻黏膜組織病理觀察 末次給藥1 h 后,用10%水合氯醛麻醉,腹主動脈取血后剝除上頜骨部的皮膚,取出整個鼻甲后放入4%甲醛固定,制作病理切片,在光學顯微鏡下觀察、拍照、分析。
1.2.7 指標檢測 末次給藥1 h 后,用10%水合氯醛麻醉,腹主動脈取血5 ~10 mL,在離心管中靜置2 h 后,3000 r·min-1離心10 min,收集血清,于-20℃冰箱中儲存備用。檢測前取出,室溫下放置1 h 后按照ELISA 試劑盒說明書進行操作,分別對大鼠血清中IgE、IL-4 和IFN-γ的含量進行檢測。
1.2.8 Western blot 實驗 取大鼠鼻腔黏膜組織,采用液氮研磨法,以1∶10 比例(0.1 g 組織∶1 mL裂解液)進行研磨,12 000 r·min-1離心10 min,取上清液,用BCA 試劑盒進行蛋白定量。制備樣品,采用SDS-PAGE 凝膠制備試劑盒制備10%的分離膠和5%的濃縮膠,上樣,電泳,PVDF 轉膜,5%脫脂奶粉封閉2 h 后加一抗,其中內參1∶5000,其他抗體1∶1000,過夜,TBST 沖洗3次,加入二抗1∶5000,TBST 沖洗3 次,ECL 發光液顯影。
1.3 統計分析方法
在研究過程中基于SPSS 25.0 軟件進行統計分析,同時利用GraphPad Prism6.0 軟件工具進行繪圖,連續變量用均數±標準差表示。組間結果差異進行單因素方差分析,計數數據通過百分比描述,P<0.05 為差異有統計學意義。
2 結果
2.1 網絡藥理學分析
2.1.1 成分庫的構建與篩選 搜索蒼耳子化學成分,共得到138 種化學成分,去掉無對應靶點的成分,共得到了23 個潛在有效成分,其中羧基蒼術苷、洋薊素(1,3-二咖啡酰奎寧酸)、N-反式-阿魏酰酪胺、噻嗪二酮在Uniprot 數據庫中無對應靶點信息,故蒼耳子最終得到19 個潛在有效成分,具體信息見表1。

表1 蒼耳子潛在有效成分Tab 1 Potential active components inXanthii Fructus
2.1.2 化合物靶點的篩選 將搜集到的化學成分導入SwissADME 數據庫(http://www.swissadme.ch),對搜集到的蒼耳子活性成分進行篩選,將篩選得到的化學結構式導入SwissTargetPrediction(www.sib.swiss)數據庫,預測其作用靶點;按照Uniprot 編號,在Uniprot 數據庫中查找對應的gene offical sympol 格式,將其作為靶點基因保存。將篩選的各活性成分化合物的靶點與疾病靶點進行對照,得到各個活性成分的潛在抗炎靶點基因,綜合后獲得217 個蒼耳子潛在抗炎靶點基因。
2.1.3 成分-疾病的交集靶點分析 以“rhinitis”為關鍵詞,在GeneCards 數據庫中查詢到有關疾病候選靶點10 275 個,通過“Relevance score”取中位數(n≥12.43),篩選得到2803 個相關疾病靶點。藥物與疾病的交集靶點共108 個,提示這些靶點可能是蒼耳子抗鼻炎作用的潛在靶點。
2.1.4 成分-疾病靶點的 GO 生物功能及 KEGG 信號通路富集分析 將得到的108 個核心靶點導入Metascape 數據庫,物種選擇為“人類”,共確定1859 個GO 條目(P<0.01),其中BP 有1632 個條目,主要涉及白細胞遷移(leukocyte migration)、積極調控細胞遷移(positive regulation of cell migration)、對受傷的反應(response to wounding)、細胞對激素刺激的反應(cellular response tohormone stimulus);CC 有99 個條目,主要涉及膜筏(membrane raft)、膜微結構域(membrane microdomain)、膜區域(membrane region)、溶酶體(lysosome)等;MF 有128 個條目,主要涉及蛋白激酶活性(protein kinase activity)、磷酸轉移酶活性(phosphotransferase activity)、生長因子結合(growth factor binding)、受體配體活動(receptor ligand activity)。每項取P值前10 位條目,見圖1。
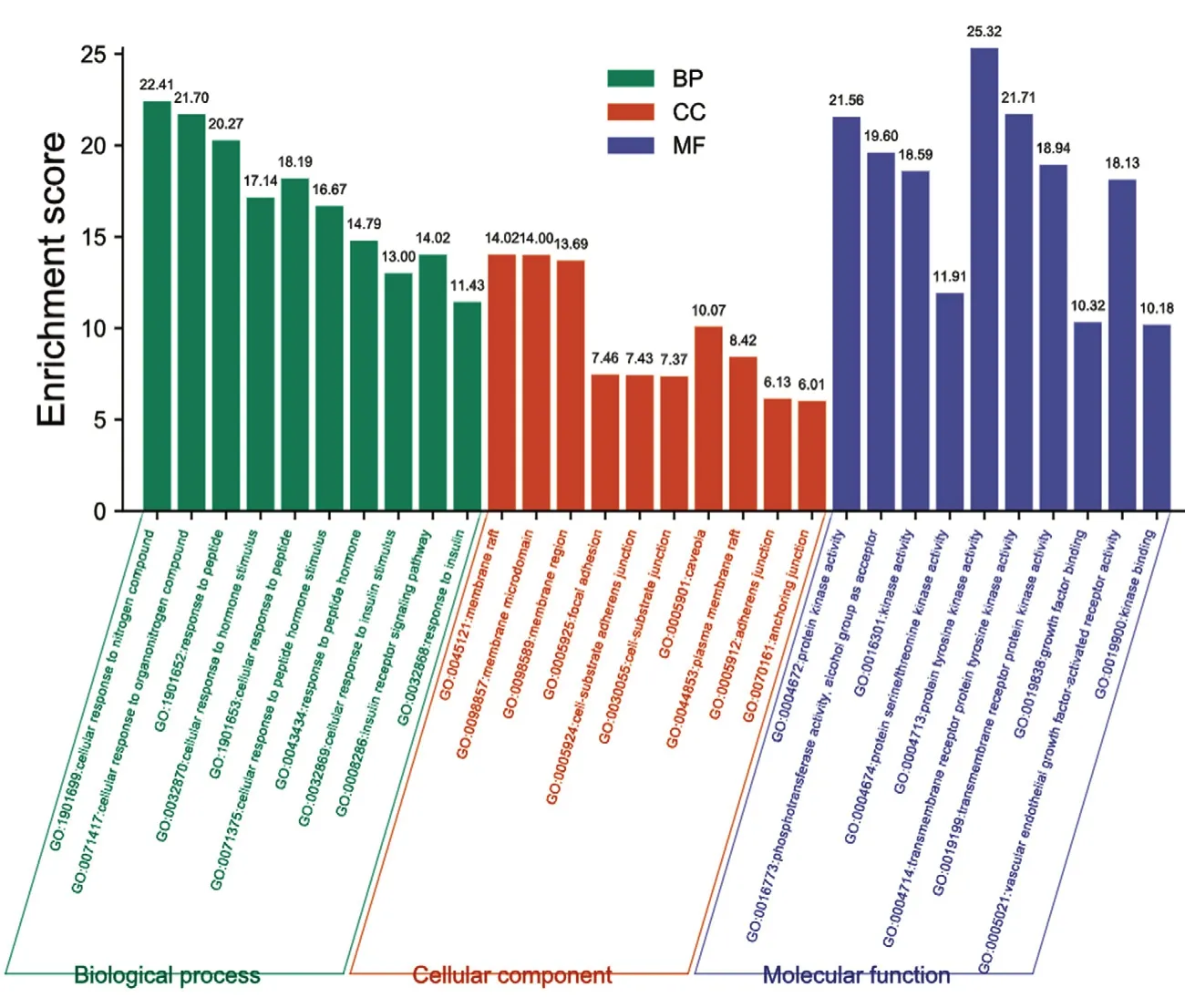
圖1 成分-疾病靶點的GO 生物功能富集分析Fig 1 GO biological enrichment analysis of component-disease targets
將比對得到的108 個核心靶點導入Metascape數據庫,限定物種為“人類”,對其進行KEGG信號通路功能富集分析,共確定292 個條目(P<0.01),根據-log10(P)值的大小取前20位KEGG 信號通路,見圖2。主要涉及癌癥通路、乙型肝炎、MAPK 信號通路、PI3K-Akt 信號通路、T 細胞受體信號通路等。以上通路表明,蒼耳子活性成分與抗炎作用密切相關,詳見表2。
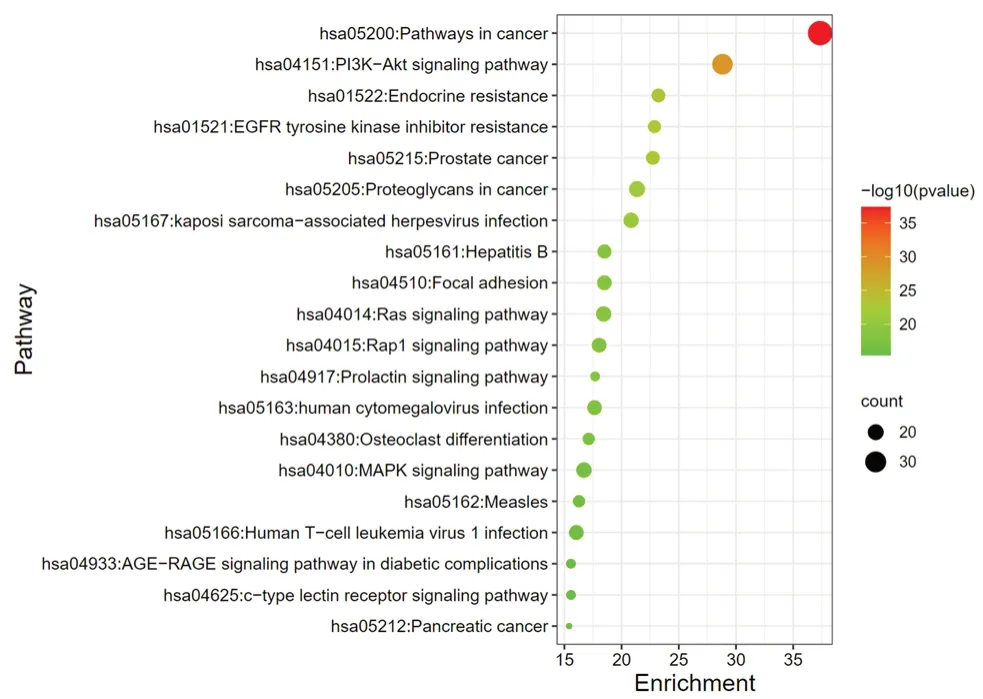
圖2 KEGG 富集分析氣泡圖Fig 2 Bubble diagram of KEGG enrichment analysis

表2 成分-疾病靶點的KEGG 信號通路(前20 條)Tab 2 KEGG signaling pathways of component-disease targets (top 20 items)
2.1.5 成分-靶點-通路的網絡構建 上述的20條通路,包含108 個靶點,涉及19 個成分,將其導入Cytoscape 3.5.1 軟件,構建“成分-靶點-通路”的網絡關系圖。紅色圓形為中藥蒼耳子,紫色正方形為蒼耳子的主要活性成分,黃色菱形為關鍵靶點,綠色六邊形為關鍵通路,圖形面積大小和顏色深淺與Degree 值成正比,如圖3所示。根據Degree 值,排名前5 位的靶點為CASP3、TP53、TNF、MYC、PIK3CG。以上信息提示這些靶點可能是蒼耳子發揮抗炎作用的重要靶點。
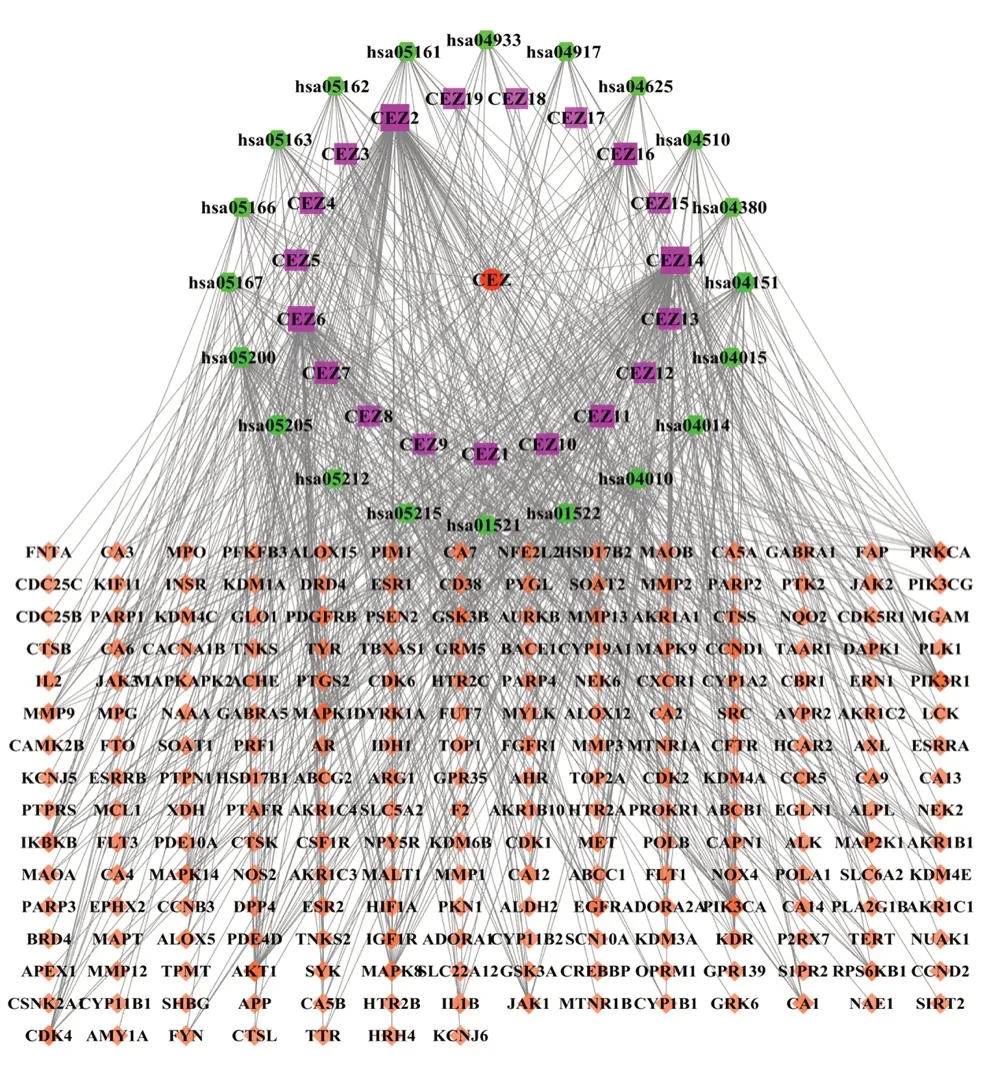
圖3 成分-靶點-通路網絡圖Fig 3 Component-target-pathway network diagram
2.2 動物實驗驗證
2.2.1 鼻黏膜組織病理變化 各組大鼠鼻黏膜組織經HE 染色后在光學顯微鏡下觀察,結果正常組大鼠鼻黏膜上皮組織結構完整,血管正常,組織未發生水腫,無浸潤的嗜酸性粒細胞(見圖4A);模型組大鼠鼻黏膜上皮組織發生脫落,血管擴張充血,組織出現水腫,可見大量的嗜酸性粒細胞浸潤(見圖4B);氯雷他定組及總水提液組大鼠鼻黏膜上皮組織基本完整,未見明顯擴張的小血管,有少量浸潤的嗜酸性粒細胞(見圖4C及4D);石油醚組大鼠鼻黏膜上皮組織脫落不明顯,小血管充血擴張,伴有大量嗜酸性粒細胞浸潤(見圖4E);乙酸乙酯組大鼠鼻黏膜上皮組織脫落,血管擴張,組織水腫,可見大量浸潤的嗜酸性粒細胞(見圖4F);正丁醇部位組大鼠鼻黏膜上皮組織結構較為完整,血管無明顯擴張的現象,有嗜酸性粒細胞浸潤(見圖4G)。
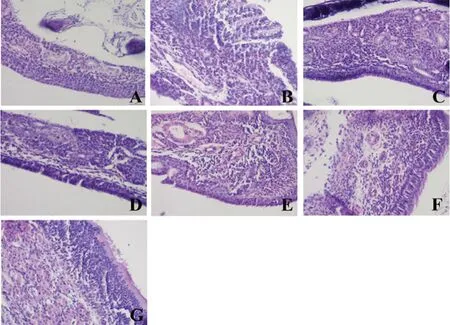
圖4 各組大鼠鼻黏膜組織形態學變化比較(HE 染色,×200)Fig 4 Morphological changes in the nasal mucosa of the rats in each group(HE staining,×200)
2.2.2 對大鼠血清中IgE、IL-4 及IFN-γ水平的影響
各組大鼠血清中IgE、IL-4 及IFN-γ水平見表3。模型組大鼠血清中IgE 和IL-4 水平均明顯高于正常組,IFN-γ水平明顯低于正常組。與模型組相比,氯雷他定組、正丁醇組和總水提液組大鼠血清中IgE水平均明顯低于模型組;石油醚組和乙酸乙酯組無顯著性差異;各給藥組大鼠血清IL-4 水平較模型組含量均顯著降低,IFN-γ水平明顯升高。
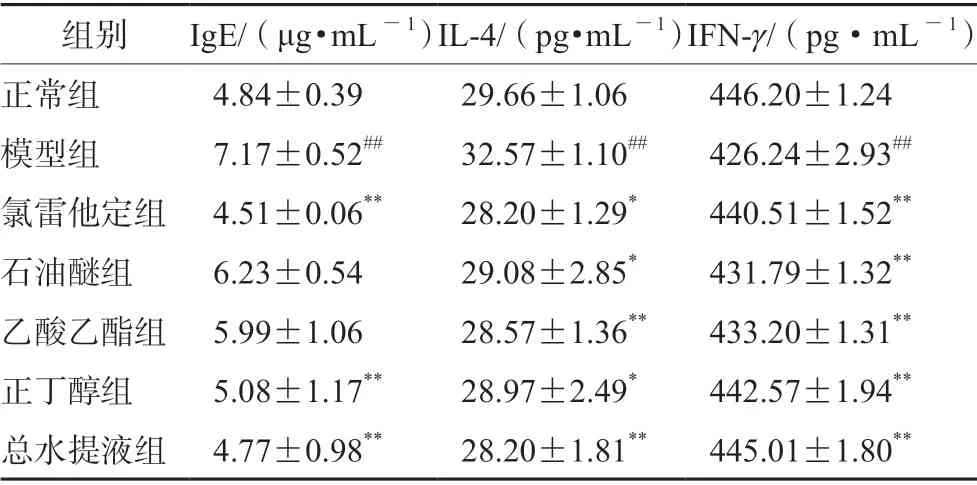
表3 各組大鼠血清中IL-4、IFN-γ 及IgE 的水平(n =8)Tab 3 Level of IL-4,IFN-γ and IgE in the rat serum in each group(n =8)
2.2.3 鼻黏膜組織PI3K、P-AKT、AKT 蛋白表達水平 與正常組相比,模型組PI3K 表達明顯增加;與模型組相比,石油醚組,乙酸乙酯組與總水提液組PI3K 表達無顯著性差異;正丁醇組PI3K 表達顯著降低。與正常組相比,模型組P-AKT 表達顯著增加;與模型組相比,石油醚組、總水提液組和正丁醇組P-AKT 蛋白表達明顯降低,乙酸乙酯組P-AKT 蛋白表達無顯著性差異;與正丁醇組相比,總水提液組和氯雷他定組P-AKT 蛋白表達無顯著性差異,石油醚組和乙酸乙酯組P-AKT 蛋白表達顯著性增加。各組大鼠AKT 總蛋白表達無明顯差異。實驗結果見圖5。
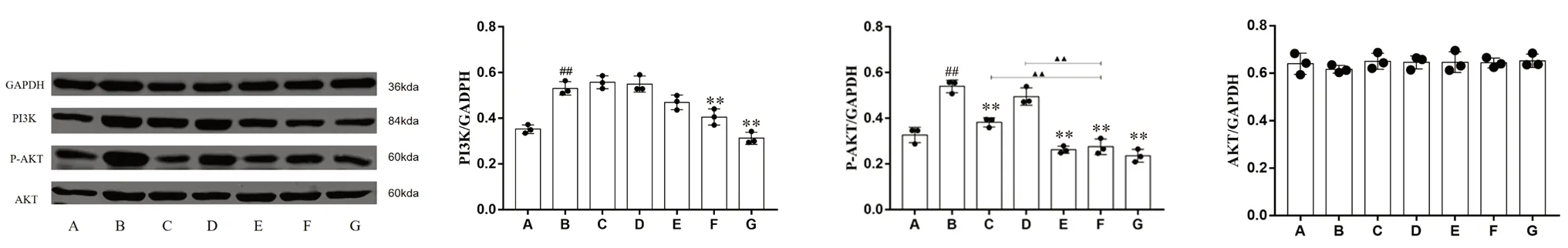
圖5 各組大鼠鼻黏膜組織PI3K、P-AKT、AKT 蛋白相對表達量Fig 5 Relative expression levels of PI3K,P-Akt and AKT in the nasal mucosal of the rats in teach group
3 討論與結論
AR 作為一種常見的免疫異常類疾病,全球患有AR 者已超過5 億,目前已成為主要的呼吸道慢性炎性疾病,給患者的生活質量和社會經濟帶來了負面影響[10]。中醫認為AR 屬于“鼻鼽”的范疇,認為正氣不足、外邪侵襲是導致鼻鼽發生的主要原因[11]。機體免疫系統具有免疫監視、防御、調控機體的作用,這與“中醫正氣”抵御外邪入侵、驅邪外出、修復調節能力及維持臟腑經絡的功能相似。因而治療AR 需“扶正祛邪”,增強機體免疫調節能力。蒼耳子作為一味傳統中藥材,已在臨床上使用上千年,常被廣泛用作發散風寒藥,其最主要功效為“通鼻竅”作用,被稱為“鼻科要藥”。蒼耳子臨床常用于治療鼻塞流涕、鼻鼽、鼻淵等病癥,具有很好的療效,但是對其藥效作用機制仍需要不斷研究。
蒼耳子臨床使用多為水煎煮法,本研究旨在研究蒼耳子水提取部位中的有效成分對AR 的影響。蒼耳子經過水煎煮法后依次使用石油醚、乙酸乙酯、正丁醇依次萃取,咖啡酸、肉桂酸、阿魏酸、香草酸、綠原酸和丁二酸等水溶性成分,可出現在各個萃取部位中[8]。本研究通過網絡藥理學得到PIK3CA、AKT1、MAPK1 等108 個蒼耳子核心治療AR 的靶點,GO 分析結果主要涉及磷酸轉移酶活性、信號轉導、細胞增殖等。KEGG分析結果得到292 條通路,主要有涉及癌癥通路、PI3K-Akt 信號通路、乙型肝炎、MAPK 信號通路、T 細胞受體信號通路等。其中PI3K-Akt 信號通路是細胞內重要的信號轉導通路之一,廣泛存在于細胞中,調控細胞增殖、凋亡及分化等功能。有研究表明PI3K-Akt 信號通路參與了炎性痛的形成與發展,在炎癥部位損失組織及脊髓小膠質細胞中高表達,阻斷或抑制PI3K/Akt/NF-κB 信號通路可緩解和減輕炎性痛的發生發展[12]。
本研究通過給予大鼠蒼耳子不同提取部位,探究其作用機制,對網絡藥理學結果進行驗證。AR 發病機制非常復雜,隨著研究的不斷深入,發現Th1/Th2 平衡與AR 的發病過程有著密切的聯系,IL-4 和IFN-γ等Th 細胞因子參與了AR 的發病過程,并且對AR 的發生發展具有重要的影響。IL-4 和IFN-γ間存在著拮抗關系,能夠互相調節,Th1 細胞釋放的IFN-γ可以抑制Th2 的活化,進而抑制IgE 的產生。當γ-干擾素的釋放量缺少時,Th2 細胞因子功能亢進,分泌的IL-4 增多,誘導B 淋巴細胞釋放IgE,導致AR 發生[13]。通過觀察鼻黏膜病理學變化可以科學地反映AR 的變化情況,并且可以直接根據AR 大鼠鼻黏膜組織病理變化及血清中IL-4、IFN-γ及IgE 濃度判斷造模是否成功。本研究綜合分析各種檢測指標的結果,蒼耳子水提液經萃取得到的正丁醇部位可以減輕AR 大鼠打噴嚏、流鼻涕等過敏性癥狀,改善鼻黏膜組織形態學的變化,降低血清中IL-4 和IgE 的水平,升高IFN-γ的水平,可能是蒼耳子發揮治療AR 的作用的活性部位。KEGG 結果表明PI3K/AKT 通路為蒼耳子治療AR 的關鍵通路。袁家勝[14]研究發現通過敲除小鼠的CCR3基因可以降低PI3K/AKT 信號通路的激活水平,緩解小鼠AR癥狀。Chen 等[15]發現屋塵螨(HDM)提取物刺激的鼻上皮細胞(NEC)和體外刺激得到的AR 模型小鼠鼻黏膜組織中均發現PI3K/AKT 通路表達被激活。PI3K/AKT 通路和中性粒細胞關系密切,其下游因子對中性粒細胞的趨化和存活有重要影響。PI3K/AKT 通路可以通過活化HIF-1α,來調節巨噬細胞和樹突狀細胞的活性;調節中性粒細胞的功能;調節T細胞的發育、分化和功能。本實驗結果表明,AR 模型大鼠鼻黏膜組織中PI3K 和P-AKT 蛋白表達增加,AKT 總蛋白含量無明顯變化。給予藥物治療干預后,各給藥組PI3K、P-AKT蛋白表達下調且正丁醇組的蛋白表達量下調最為顯著。由此推斷,蒼耳子正丁醇部位可抑制PI3K蛋白表達,而使得AKT 蛋白磷酸化被抑制,減輕鼻部炎性癥狀。
綜上,本研究通過網絡藥理學預測了治療AR 的靶點與通路,通過鼻黏膜組織HE 染色,血清炎癥因子IL-4、IFN-γ及IgE 及鼻黏膜組織中PI3K、AKT、P-AKT 蛋白的檢測來驗證網絡藥理學預測結果,初步揭示了蒼耳子正丁醇部位治療AR 的作用機制,為后期繼續探索其治療AR 機制提供理論依據。