數軸在電化學教學中的妙用
藍尤釗,王月娟
浙江師范大學化學與生命科學學院,浙江 金華 321004
在化學教學中,為了便于理解記憶一些規律性或系統性的知識點,我們通常會引入一些直觀的“模型”來輔助教學[1]。“模型認知”已成為現階段高中化學要求培養的核心素養之一,這里的“模型”分為實物模型和非實物模型兩大類,其中非實物模型包括數學模型、圖像模型和語義模型等,基于“數軸”的圖像模型在化學教學中有著豐富的應用。例如,數軸可以用來理解各類化學反應[2-6],其中在氧化還原反應中,數軸模型可以直觀體現物質的量的關系和電子轉移的數值[4,5]。數軸模型容易記憶,數值表示從左到右增大的規律可以用于理解和記憶一些規律性的知識點[3,7-12],如溶解度、pH、金屬活動順序表、蓋斯定律,等等。本文以數軸為模型,簡單直觀地講解了電池符號、電極電勢和電極極化三個電化學中的重要知識點。電池符號中的正負極規定和氧化還原反應中的得失電子與數軸的正負端和正負號完美對應。結合金屬活動順序表,數軸上數值的大小與電極電勢的大小位置相對應,我們可以很容易理解記憶金屬電極電勢的大小與氧化還原反應的能力。電極極化導致電極電勢的變化,其極化的程度或大小直觀地體現在數軸上。
1 數軸與電池符號
電池符號的書寫是與電池相關的電化學教學的重要內容,它遵循一般的慣例。這個慣例主要涉及以下四個方面[13]:① 電池的正負極,正負極發生的氧化還原反應;② 不同相態的分隔,鹽橋的表示;③ 各物質的相態;④ 由電極電勢計算電池電動勢。從學習的角度看,寫多了自然可以記起來,但時間久了難免忘記,比如左邊右邊是什么極和發生什么反應的問題。下面結合我們熟知的數軸來理解和記憶電池符號的表示慣例,因為數軸是個非常簡單的模型,基于這個模型的記憶非常清楚,且不容易忘記。我們以銅鋅Danel電池為例來說明數軸和前面述及的電池符號慣例中的第①和第④兩個方面的對應關系。如圖1所示,對于第①個方面,數軸的原點(即0點)對應電池符號中正極和負極的分界,數軸的負端(-)對應電池的負極,正端(+)對應電池的正極。負極的負號后加一個電子符號即(-e),表示失去電子反應即氧化反應。類似地,正極的正號后加一個電子符號即(+e),表示得電子反應即還原反應;對于第④個方面,電池的電動勢計算定義為正極的電極電勢減去負極的電極電勢,即φ右-φ左。例如我們以Cu和Zn的標準電極電勢為例,整個電池的電動勢為1.1015 V。總之,我們以數軸的原點作為電池符號正負極的分界點,而數軸的正負端對應了電池的正負極端,正負號對應得失或加減電子,正負端的數值差的大小對應了電池電動勢的大小。
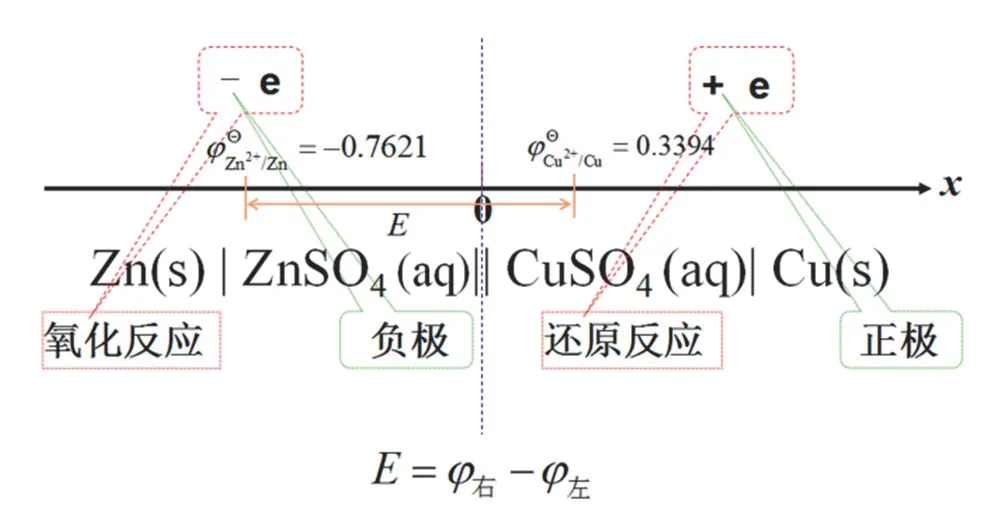
圖1 數軸與電池符號的對應關系
2 數軸與電極電勢
電極電勢的大小沒有絕對值,它是相對于某一標準電極定義的電勢差。按照國際純粹與應用化學聯合會的規定,我們采用標準氫電極作為標準電極,其電極電勢定為0。未知電極電勢的定義方法是一定溫度下把未知電極與標準氫電極組成如下電池:
標準氫電極||未知電極
該電池的電動勢即為未知電極的氫標電極電勢。又因為未知電極是在正極發生還原反應,所以由此定義的電極電勢又稱為氫標還原電極電勢。現在我們結合數軸來說明電極電勢及其在理解氧化還原順序方面的應用。如圖2所示,我們把氫電極電勢放在數軸的0點,則數軸正負兩端的數值就代表未知電極電勢的值。下面我們以回答兩個問題的方式來進一步闡述如何結合數軸理解電極電勢的定義及其應用。
① 如果把標準氫電極電勢定為0.1 V (圖2b),其他電極電勢如何變化?
答:因為各個未知電極與標準氫電極之間的電勢差不變,所以未知電極的電勢就是在原來的電極電勢(圖2a)的基礎上進行平移即可,數值上在原來電極電勢的基礎上+0.1 (圖2b)。
② 如何理解記憶“電極電勢越負,越容易被氧化;電極電勢越正,越容易被還原”?
答:我們已熟記的金屬活動順序表為[7]:
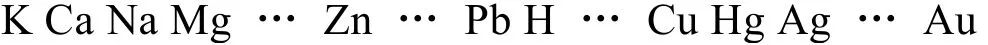
從圖2可知,活潑的K在數軸的最左端,即在數值上是最小的,因此,我們自然得出電極電勢越負,越容易被氧化,而惰性的Au在最右邊,電極電勢越正,越容易被還原。
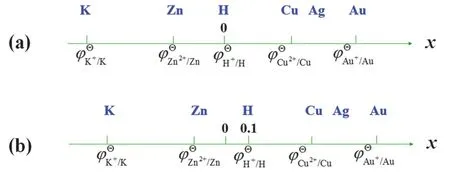
圖2 數軸與電極電勢的表示
3 數軸與電極極化
電極的極化是指電極工作時隨著電極上電流密度的增加其電極電勢偏離可逆電極電勢的現象,偏離程度的大小用超電勢或過電位來衡量。下面我們從兩個方面闡述如何結合數軸理解電極的極化現象及其對電解的影響。
① 電極極化會使得電池實際做功比其可逆功小,而使得電解時需要比可逆電動勢更大的電壓。圖3a給出了電池的極化曲線及對應的數軸模型,正極和負極極化曲線分別位于數軸的正負端,這與前面電池符號的定義一致。從圖中我們可以看出,正極極化曲線和負極極化曲線近似對稱,相應的電位都向數軸0點方向靠攏,最后電池可做的功的大小數值zFE不可逆小于可逆電池功的大小zFE可逆。對于電解池(圖3b),正好相反,電極的極化導致電極電位由數軸中心向兩邊移動,導致實際需要比可逆電池電動勢更大的電壓。無論是原電池中的向原點靠攏,還是電解池中的遠離原點,都是朝著超電勢增大的方向。基于這些特點,我們總結為“靠攏原點,做更小的功;遠離原點,需更大的電壓”。在這里,“靠攏”可以理解為數軸上兩點相互靠攏,間距變小(寓意更小的功);而“遠離”可以理解為數軸上兩點相互遠離,間距變大(寓意更大的電壓)。最后,基于數軸右邊的數減去左邊的數為正值,可以理解記憶超電勢計算定義的慣例,定義超電勢為正值[13]。即,對于電解池,陰極的超電勢η陰= (φ可逆-φ不可逆),而陽極的超電勢η陽= (φ不可逆-φ可逆)。例如[13],有0.005 mol·kg-1的ZnSO4溶液,Zn2+在陰極上的理論析出電勢(φ可逆)為-0.808 V,而實際的析出電勢(φ不可逆)為-0.838 V,則η陰= -0.808 - (-0.838) = 0.030 V。
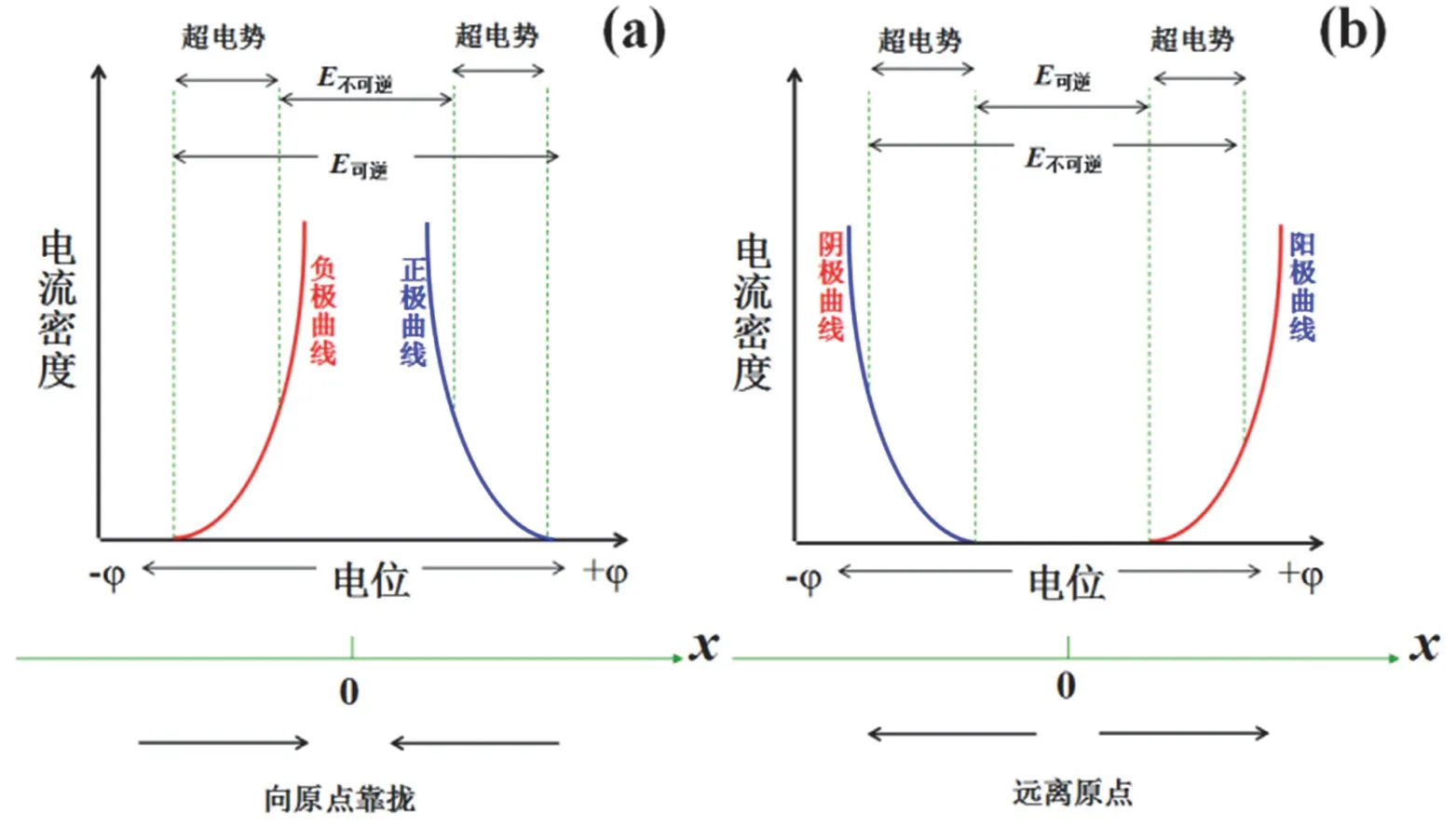
圖3 原電池(a)和電解池(b)的兩極極化與數軸模型的對應關系
② 在電鍍的時候,為什么比氫活潑的一些金屬如Zn可以比H更早析出?從圖3b我們可以看到電極極化導致陰極的電位向更負的方向移動,即向更不容易被還原的方向移動。從圖4的數軸模型可以很直觀地看出,在沒有極化時,H的電極電勢(設中性溶液,φH+/H)位于Zn的電極電勢(φZn2+/Zn)的右邊,H更容易析出。發生極化后,由于H具有較大的超電勢(η),其極化后的電極電勢φ’H+/H移到了φZn2+/Zn的左邊,導致了Zn更易析出。
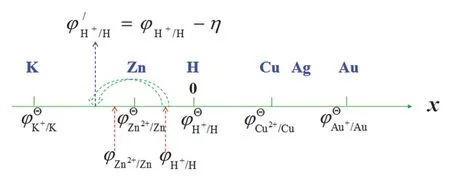
圖4 超電勢影響離子的氧化還原順序的數軸模型
4 結語
數軸模型本身非常簡單,極易記憶,可以幫助學生很好地理解和記憶電池符號的規定。金屬活動順序表在數軸上的體現,可以幫助學生理解電極電勢的大小與金屬氧化還原順序之間的關系。電極極化的概念及對電解的影響從數軸上可以直觀地體現。本文討論的三方面內容涉及電化學教學的最基本概念和電化學電極從非極化到極化的進階內容。本文對教師來說,是模型化物理化學教學內容的一個完美例證,而對學生來說,則是物理化學學習簡單化的一個標樣。本論文的模型化方法已在多屆學生中實踐并收到好評。

