鄰二氮菲測鐵的實驗教學改進與實踐
張悅,王曉艷,高素華
天津理工大學化學化工學院,天津 300384
鄰二氮菲測鐵實驗是各大高校化學及相關專業學生必做的實驗。實驗原理是在pH為2-9的溶液中,Fe2+與鄰二氮菲生成穩定的紅色配合物[1]。實驗內容通常為條件實驗或標準曲線法測定未知水樣中的鐵含量。通過此次實驗,加強學生對實驗基本原理的理解,同時,熟悉并掌握分光光度計的使用方法,掌握標準曲線法測定水溶液中微量鐵。近年來,許多高校對鄰二氮菲測定鐵實驗進行了內容擴充及方法改進,如采用手持技術、增設采用不同光譜法含量測定對比或樣品前處理的實驗環節、Origin/Excel軟件輔助分析實驗數據等[2-8]。
我院前期通過統一更新722型分光光度計為普析通用T6紫外-可見分光光度計,降低本實驗操作的繁瑣度,同時,采用Excel進行標準曲線的回歸,提高實驗效率的同時,突出本實驗的教學目標。但在本實驗的教學過程中,仍發現有諸多問題。我校分析化學實驗在大一年級開設,在預習和課堂教學互動過程中發現,學生對實驗原理理解并不到位,如課堂提問“本次實驗原理是……”,大部分學生根據講義都能答出“Fe2+與鄰二氮菲生成穩定的紅色配合物”;但當問及“本次實驗測定的是總鐵?Fe3+還是Fe2+?”“鄰二氮菲測鐵為什么要找最大吸收波長”時,只有個別學生能夠回答出大概的原因。另外,在課后學生教學反饋中,部分同學對Fe3+與鄰二氮菲絡合是否對Fe2+與鄰二氮菲絡合有影響存在疑問;部分同學對標準曲線法測定未知水樣的實驗流程及數據處理的理解也不到位;少部分學生實驗做完,卻仍然不能明白實驗設置的目的是什么。
因此,本實驗對鄰二氮菲測鐵實驗進行了改進,在原有內容的基礎上,讓學生對實驗原理部分“Fe2+與鄰二氮菲生成穩定的紅色配合物,Fe3+也可與鄰二氮菲生成淡藍色配合物”進行實驗驗證;在測定吸收光譜的同時,計算不同波長處的摩爾吸光系數;同時,測定并計算未知水樣中的總鐵、Fe2+和Fe3+。同時,基于筆記本電腦的普及,通過Excel、Origin軟件進行數據處理和作圖。實驗內容的改進,旨在充分調動學生主觀能動性,同時讓學生親自通過實驗結果解決困惑,加深學生對基本原理及操作的理解,在掌握分光光度法的基礎上,引導學生學習解決實際問題的方法。
1 實驗內容
1.1 實驗目的
掌握分光光度計的使用方法;掌握鄰二氮菲測鐵的基本原理;掌握標準曲線法測定未知水樣中鐵的濃度。
1.2 實驗原理
在pH = 2-9的溶液中,鄰二氮菲與Fe2+生成穩定的紅色配合物[Fe(phen)3]2+,其lgK穩= 21.3 (20 °C)。紅色配合物的最大吸收峰在510 nm處,摩爾吸光系數ε= 1.1 × 104L·mol-1·cm-1。
Fe3+也可與鄰二氮菲生成淡藍色配合物,其穩定常數lgK穩= 14.1 (20 °C)。因此,在測定總鐵時,顯色之前應預先用鹽酸羥胺將Fe3+還原Fe2+。
1.3 儀器與試劑
儀器:T6紫外-可見分光光度計(北京普析通用)、1 cm玻璃比色皿。
試劑:鹽酸羥胺(100 g·L-1,現配現用)、鹽酸溶液(6 mol·L-1)、鄰二氮菲溶液(1.5 g·L-1新配制)、NaAc溶液(1 mol·L-1)、Fe3+標準溶液(含鐵0.1 mg·mL-1)。
1.4 實驗步驟
(1) 吸收曲線的繪制。
鄰二氮菲-Fe3+絡合物吸收曲線:精確移取1.00 mL Fe3+標準溶液(0.1 mg·mL-1)注入50.00 mL容量瓶中,依次加入2.00 mL鄰二氮菲、5.00 mL NaAc,用去離子水稀釋至刻度,搖勻。以試劑空白溶液為參比,在440-560 nm之間每10 nm測定一次吸光度(其中在500-530 nm范圍內,每間隔5 nm測量一次。每調一次波長,儀器都要調零),以波長為橫坐標,以吸光度為縱坐標,用Excel軟件繪制吸收曲線。
鄰二氮菲-Fe2+絡合物吸收曲線:精確移取1.00 mL Fe3+標準溶液(0.1 mg·mL-1)注入50.00 mL容量瓶中,加入1.00 mL鹽酸羥胺,搖勻,再依次加入2.00 mL鄰二氮菲、5.00 mL NaAc,用去離子水稀釋至刻度,搖勻。以試劑空白溶液為參比,在440-560 nm之間每10 nm測定一次吸光度(其中在500-530 nm范圍內,每間隔5 nm測量一次。每調一次波長,儀器都要調零),以波長為橫坐標,以吸光度為縱坐標,用Excel軟件繪制吸收曲線,確定最大吸收波長λmax。
(2) 標準曲線的繪制。
精確移取5.00 mL Fe3+標準溶液(0.1 mg·mL-1),加入2.00 mL 6 mol·L-1鹽酸溶液,定容于50 mL容量瓶,為0.01 mg·mL-1Fe3+標準溶液。在6個50 mL容量瓶中分別加入0.00、2.00、4.00、6.00、8.00、10.00 mL 0.01 mg·mL-1Fe3+標準溶液,加入1.00 mL鹽酸羥胺,搖勻,再依次加入2.00 mL鄰二氮菲、5.00 mL NaAc,用去離子水稀釋至刻度,定容后放置10 min。在最大吸收波長處,以試劑空白溶液為參比,分別測定吸光度。以濃度為橫坐標,以吸光度為縱坐標,用Excel軟件對數據進行線性回歸處理,記錄線性方程及R2。
(3) 未知樣品的測定。
精確移取一定體積未知樣品溶液于50.00 mL容量瓶中,加入1.00 mL鹽酸羥胺,搖勻,再依次加入2.00 mL鄰二氮菲、5.00 mL NaAc,用水稀釋至刻度,定容后放置10 min。在最大吸收波長處,以試劑空白溶液為參比,測定吸光度(吸光度需在標準曲線范圍內,如遠高于標準曲線中最大濃度標樣的吸光度,調整樣品的移取體積或對樣品進行逐級稀釋)。根據線性方程計算稀釋后樣品中總鐵含量,并計算原樣濃度。
精確移取一定體積未知樣品溶液于50.00 mL容量瓶中,依次加入2.00 mL鄰二氮菲、5.00 mL NaAc,用水稀釋至刻度,定容后放置10 min。在最大吸收波長處,以試劑空白溶液為參比,測定吸光度(吸光度需在標準曲線范圍內,如遠高于標準曲線中最大濃度標樣的吸光度,調整樣品的移取體積或對樣品進行逐級稀釋)。根據線性方程計算稀釋后樣品中Fe2+含量,并計算原樣濃度。
2 實驗結果評價
2.1 實驗數據分析評價
分析化學實驗室有8臺紫外-可見分光光度計,每班學生人數在30左右。因此,本實驗將一個班分成8個小組,每組3-4人。教師講解實驗原理和分光光度計的使用方法后,學生根據實驗步驟完成相關內容,并進行數據處理。
根據實驗步驟(1)所得數據繪制吸收曲線,如圖1所示。從圖中可以看出,鄰二氮菲-Fe2+形成的配合物的吸光度隨波長的增大,先增大后減小,存在最大吸收波長。計算鄰二氮菲-Fe2+、鄰二氮菲-Fe3+絡合物不同波長處的摩爾吸光系數,結果見表1、表2。通過摩爾吸光系數的計算,讓學生進一步理解朗伯比爾定律公式在實際中的應用。A=εbc,當c濃度一定時,使用相同的比色皿,b也為常數,因此,吸光度A與摩爾吸光系數成正比。在最大吸收波長處,摩爾吸光系數最大,靈敏度最高。這也是本實驗確定最大吸收波長的原因。
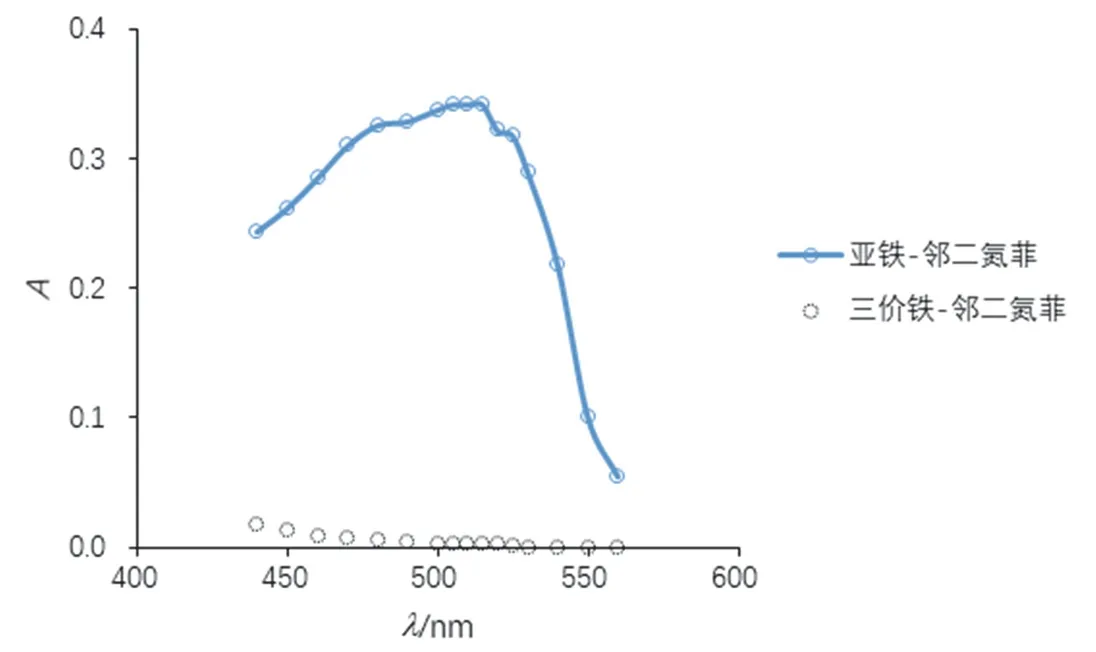
圖1 吸收曲線
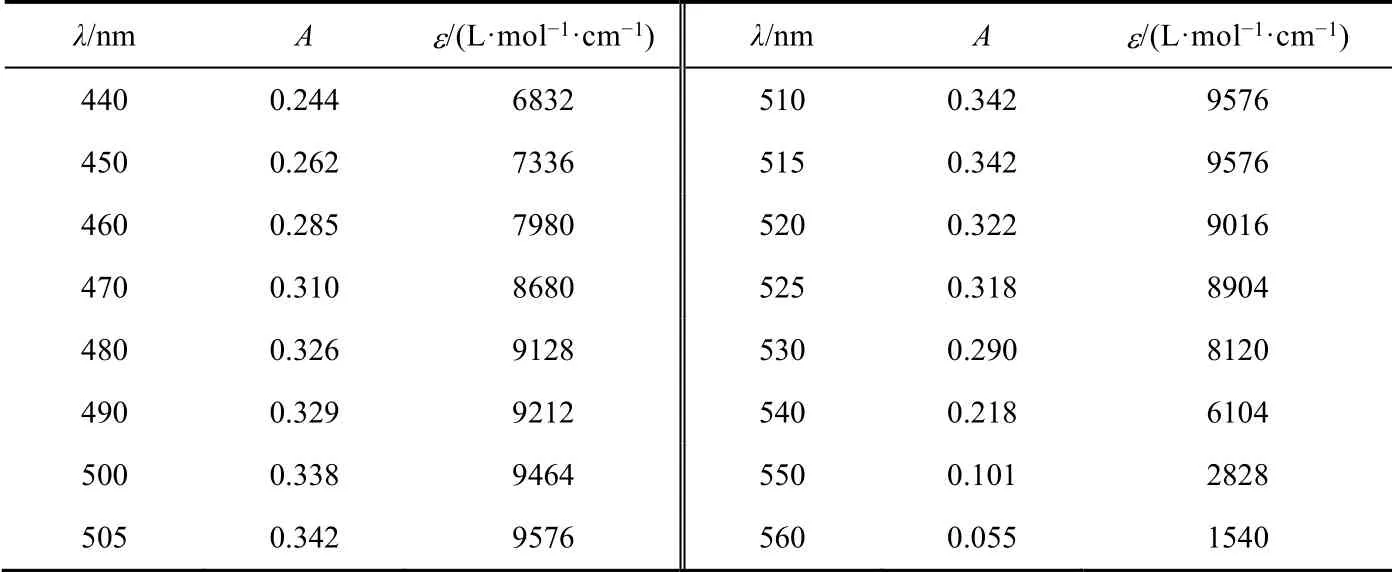
表1 鄰二氮菲-Fe2+吸收曲線數據
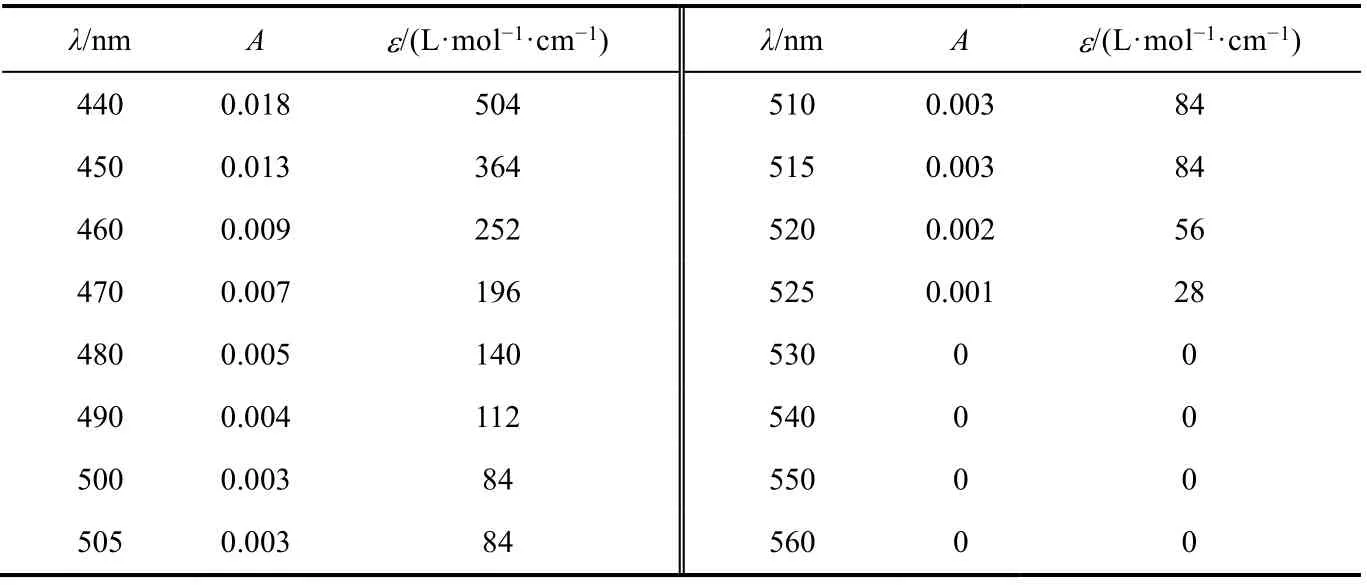
表2 鄰二氮菲-Fe3+吸收曲線數據
另一方面,值得注意的是,鄰二氮菲-Fe3+形成的配合物的吸光度較小,在510 nm處僅為0.003,其摩爾吸光系數僅為84 L·mol-1·cm-1,遠小于9576 L·mol-1·cm-1(鄰二氮菲-Fe2+)。因此,Fe3+對鄰二氮菲-Fe2+配合物吸光度的影響可以忽略。這也是本方法可以用于測定總鐵、Fe2+的原因。在本次實驗中,為加深學生印象,吸收曲線溶液配制濃度較高。在后續教學中,也嘗試過以0.0004 mg·mL-1標樣(即表3中標1)進行吸收曲線的測定,測定鄰二氮菲-Fe2+配合物摩爾吸光系數為10220 L·mol-1·cm-1,更接近教材中的數值(1.1 × 104L·mol-1·cm-1)。
根據實驗步驟(2) (3)所得數據繪制標準曲線,如表3所示。標準曲線數據經Excel線性回歸處理后,得到線性方程A= 201.75c- 0.0099,線性回歸系數R2= 0.999,見圖2。根據線性方程可計算出稀釋后水樣的濃度,見表3。未知水樣稀釋25倍后,總鐵濃度c(Fe)為0.0017 mg·mL-1,亞鐵離子濃度c(Fe2+)為0.0012 mg·mL-1,三價鐵離子濃度c(Fe3+)為c(Fe) -c(Fe2+),為0.0005 mg·mL-1。最后根據稀釋倍數,可進一步計算原樣中的c(Fe)、c(Fe2+)及c(Fe3+)。
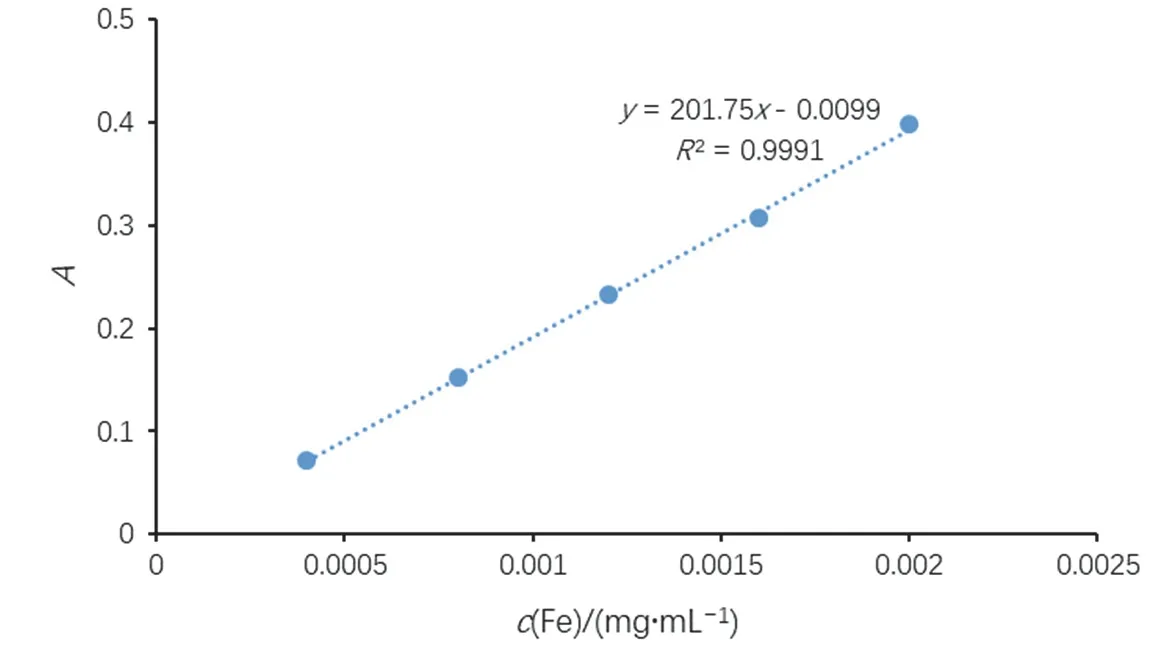
圖2 標準曲線
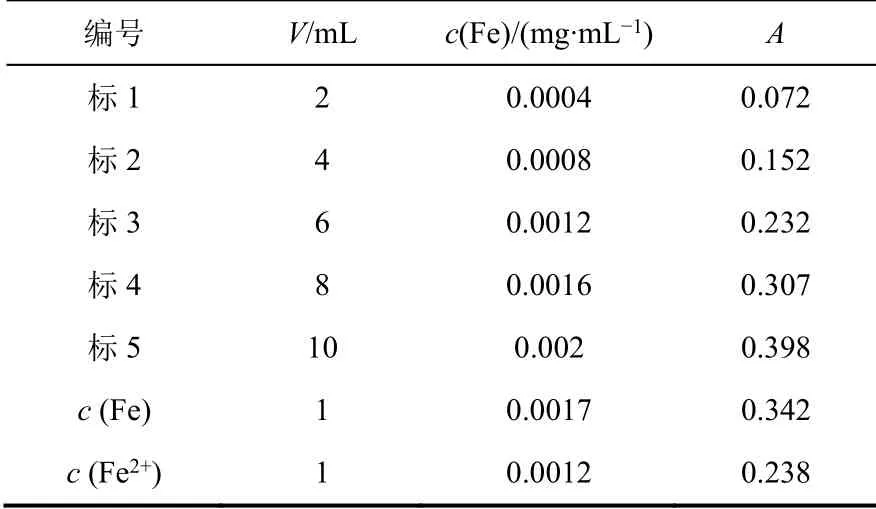
表3 標準曲線及樣品數據
2.2 實驗教學效果評價
通過紫外-可見分光光度計測定吸收曲線,原有實驗通常為確定其最大吸收波長λmax。在本次教學改革中,學生計算不同波長處鄰二氮菲-Fe2+絡合物的摩爾吸光系數,使學生進一步掌握摩爾吸光系數隨吸收波長的變化趨勢,明確在鄰二氮菲測鐵實驗中,最大吸收波長處摩爾吸光系數最大的原理。在本次教學改革中,學生對比Fe3+-鄰二氮菲、鄰二氮菲-Fe2+配合物的吸光度,加深其對實驗原理的理解;并通過測定總鐵、Fe2+,使學生進一步掌握鄰二氮菲測鐵原理,并熟悉本原理在實踐過程中的具體應用,達到對知識的融會貫通。
在本次教學改革中,也嘗試不同的教學方法。學生通過預習掌握Excel數據處理和作圖方法,教師講授基本原理后,學生進行實驗。實驗結束后,教師引導學生分析所得數據,通過數據分析得出的規律,加深學生吸收光譜測定的實驗目的;對比坐標紙作圖和Excel作圖兩種方法、722分光光度計和普析通用T6紫外-可見分光光度計,讓學生了解科技進步對儀器分析的影響。
3 結語
本次教學改革實驗項目,在原有實驗的基礎上,教師根據學生的反饋和疑問,對實驗內容進行改進,實踐效果良好。在學生進行實驗的過程中,引導學生分工合作,在提升學生實驗技能的同時,提高學生團隊合作能力。未來教學改革中,教師實驗教學過程中仍應以學生為主體,關注學生教學反饋,針對學生提出的問題或存在的疑惑,引導學生積極參與實驗教學過程,同時鼓勵學生思考、探索和提出自己的見解,真正實現自主學習。
不足之處在于,本次實驗樣品為模擬水樣,無樣品前處理過程。未來教學改進還需更多引入實際樣品中鐵的測定,讓學生學習樣品前處理的相關技術和方法;也可開展開放實驗,鼓勵學生“學以致用”,從日常食物、飲料中鐵的測定著手,查閱文獻、設計實驗步驟,從而提高學生解決實際問題的綜合能力。

