“兩性一度”教學要求下的物理化學綜合實驗教學探索
——以無表面活性劑微乳的構筑及應用為例
張永民,樊曄,劉雪鋒,胡學一,方云
江南大學化學與材料工程學院,江蘇 無錫 214122
在國家全面實施一流本科專業、一流本科課程“雙萬計劃”的背景下,如何實現物理化學實驗課程的“兩性一度”,更好地支撐我校物理化學一流課程的建設與發展,正面臨新的機遇和挑戰。
物理化學一向被認為是一門“教師難教,學生難學”的課程,具有公式推導多且適用條件嚴格、概念抽象、理論難于理解的特點。為了幫助學生更好地掌握這一課程,夯實理論基礎,提高科研能力,物理化學實驗是必不可少的。然而,常規的實驗教學設計多局限于單個知識點的應用,較少涉及多個知識點的綜合運用;教學內容的更新滯后于科學發展,新技術、新知識融入較慢;教學過程重操作輕設計,重驗證輕拓展。上述問題的存在造成了學生理論與實際聯系不足、創新意識不強、主觀能動性不高、綜合實踐能力欠缺的現象[1,2]。因此,為了充分激發學生的主觀能動性,培養學生的創新意識和創新能力,使其成為建設創新型國家的合格一分子[3,4],迫切需要把一些物理化學的前沿研究巧妙地融入實驗教學,通過與理論知識的有機融合展現給本科生。
微乳液是一種均勻透明、光學各向同性和熱力學穩定的膠體分散體系[5],其分散質點尺寸一般在1-100 nm之間。自問世以來,微乳液便因其納米液滴的小尺寸效應和限域作用,被廣泛用于納米顆粒制備、藥物輸送等領域[5,6]。
傳統微乳液通常需要高濃度的表面活性劑(> 10% (w),質量分數)來乳化液滴,并輔以助表面活性劑降低界面張力,從而穩定巨大的油/水界面。這類體系被稱為表面活性劑基微乳(Surfactant-Based Microemulsion,SBME)。大量表面活性劑的使用不僅帶來高成本,而且也導致了潛在的環境安全隱患[7],嚴重制約了微乳技術的可持續性發展。更為嚴重的是,基于SBME制備的納米顆粒往往會因表面活性劑(特別是陽離子表面活性劑)的吸附,對納米材料的性能產生不可忽視的影響[8]。Smith等[9]發現兩種不混溶的液體在一定配比的兩親性溶劑存在下可自發形成熱力學穩定的分散體系,即無表面活性劑微乳液(Surfactant-Free Microemulsion,SFME)。這為上述問題提供了一種全新的解決方案,且可避免表面活性劑帶來的成本和環境問題[10]。
在此,我們以SFME這一物理化學前沿研究為抓手,通過“SFME的構筑-Ag納米顆粒(AgNPs)制備-催化活性評價”將物理化學中的相平衡、膠體化學、界面化學和動力學等知識有機串聯,設計了一個新的物理化學綜合實驗。
1 SFME的構筑及膠體性能評價
1.1 實驗原理
SFME是由兩種不混溶的液體和一種兩親性溶劑所形成的均勻透明、熱力學穩定的納米分散體系,如圖1中的單相區。根據連續相和分散相的不同,SFME可進一步劃分為水包油(O/W)、油包水(W/O)和雙連續(B.C.)三種類型。SFME的形成主要有兩種解釋[11]。一方面,SFME的形成與各組分之間的氫鍵作用密切相關。基于氫鍵作用,兩親性溶劑可分別與水相和油相互溶,但主要吸附于油水兩相的界面區,具有類似SBME中表面活性劑的作用,可降低油水界面張力。另一方面,SFME的形成是水化力和混合熵之間相互平衡的結果。
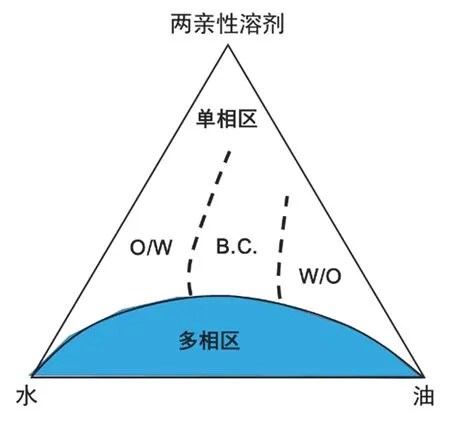
圖1 油、水和兩親性溶劑構筑的三元相圖
1.2 水-乙醇-乙酸乙酯SFME的構筑及Tyndall現象觀察
在干燥的玻璃試管中按照一定的質量比(建議比例:0 : 10、2 : 8、4 : 6、5 : 5、6 : 4、8 : 2和10 : 0)依次加入乙酸乙酯和水。25 °C超級恒溫槽中恒溫5 min后,在磁力攪拌下緩慢滴加乙醇,記錄體系發生相轉變(由渾濁變澄清)時乙醇的質量。重復此步驟三次,計算各組分的質量分數,即為三元相圖中的一個坐標點。用平滑的曲線將相轉變點連接起來即可構成單相區與多相區的分界線,得到水-乙醇-乙酸乙酯三元相圖(圖2A)。與已有報道的SFME相似[12],水-乙醇-乙酸乙酯三元相圖也可簡單分為兩個區域:單相區和多相區。
沿著圖2A中所示路徑配制一系列不同乙醇含量的樣品a、b、c、d、e。將激光從樣品瓶一側或底部射入,在入射光的垂直方向上觀察到了不同的Tyndall現象(圖2B):越靠近兩相分界線,樣品的Tyndall現象越明顯;反之,則越弱。當乙醇含量超過50% (w)后,則幾乎觀察不到Tyndall現象。這說明在單相區中有納米聚集體存在,從而導致了光的散射,證實了微乳液的形成。但是,這種Tyndall現象在高乙醇含量時則完全消失,即納米聚集體的瓦解,此時體系為真溶液,而非納米分散體系。簡言之,水-乙醇-乙酸乙酯三元相圖的單相區包括含有納米液滴的微乳區和真溶液區。
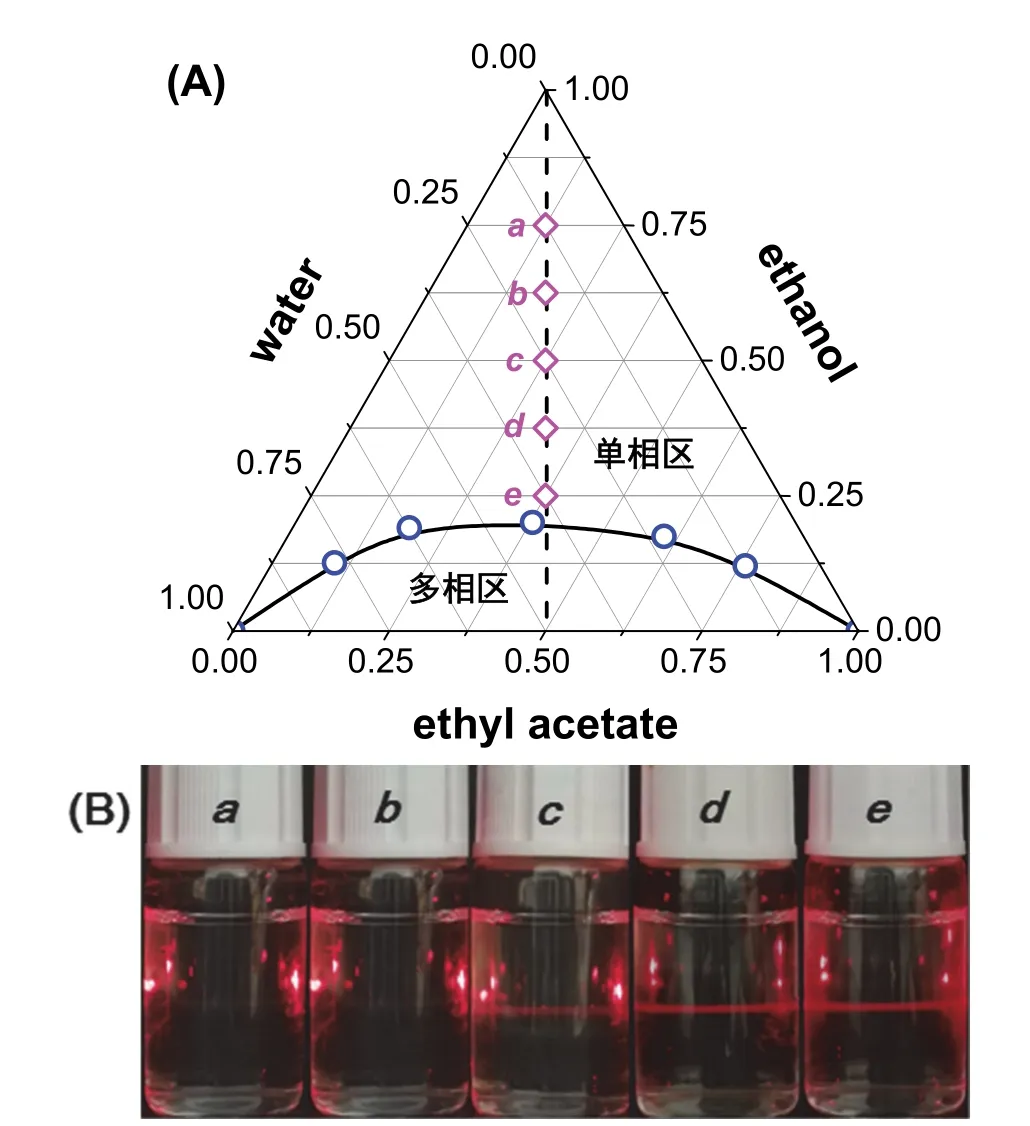
圖2 水-乙醇-乙酸乙酯的三元相圖(A)和樣品的Tyndall現象照片(B)
在教學過程中可根據時間和小組分工的變化,對微乳區的完整繪制作進一步要求,也可要求學生探索Tyndall現象沿不同路徑的變化。即可加深印象、鞏固知識,也可拓展發散思維。
1.3 微區劃分
以對微環境極性敏感的甲基橙(MO)作為探針對三元相圖中的單相區進行微區劃分[13]。固定乙酸乙酯與乙醇的質量比,配制一系列水相質量分數(fw)不等的SFME樣品,控制水相中MO濃度為0.096 mmol·L-1。利用紫外-可見分光光度儀(UV-Vis)測定樣品中MO的最大吸收波長(λmax),然后繪制λmax隨fw的變化曲線。如圖3A所示,隨含水量(fw)的增大,λmax發生了紅移,表明MO所處環境極性增大。根據λmax隨fw的變化可將SFME劃分為W/O、B.C.和O/W三種微觀結構(圖3B),得到一組轉折點。即隨著fw增大,SFME從W/O依次向B.C.和O/W發生轉變。改變乙酸乙酯/乙醇質量比,重復實驗,可獲得其他幾組轉折點。將相同轉變的轉折點相連,即可得到三個微區的分界線。
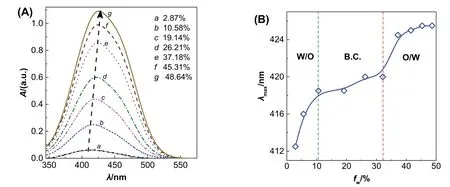
圖3 含水量fw對MO紫外-可見吸收光譜(A)和λmax (B)的影響
考慮到時間和后續實驗的需要,每一組同學可自行選擇三個乙酸乙酯/乙醇質量比進行微區劃分。
2 AgNPs顆粒的制備及表征
在W/O微區選擇配方作為納米反應器用于制備AgNPs。分別用5 mmol·L-1AgNO3和50 mmol·L-1NaBH4水溶液代替微乳配方中的水,獲得含AgNO3微乳(AgNO3-SFME)和含NaBH4微乳(NaBH4-SFME)。觀察發現樣品依然保持透明和光學各向同性,且Tyndall現象明顯(圖4A),說明AgNO3或NaBH4的引入并未破壞SFME中的納米聚集體。
攪拌下將2 mL NaBH4-SFME緩慢滴入2 mL AgNO3-SFME,樣品逐漸由無色變成淡黃色或黃褐色,即AgNPs形成。繼續攪拌1 h后,獲得含有AgNPs的SFME (2.5 mmol·L-1)。為了獲得較小的納米顆粒,應快攪拌慢滴加。
通過TEM觀察發現AgNPs-SFME均勻地排布在銅網上,沒有明顯團聚現象發生(圖4B)。對約150個粒子進行粒徑統計分析,得到AgNPs-SFME的平均粒徑約2.36 ± 0.13 nm,分布較窄。
XRD譜圖(圖4C)顯示了單質銀[111]、[200]、[220]和[311]面的特征衍射峰,沒有其他雜質銀的衍射峰被發現,即AgNPs-SFME屬于純度很高的單質銀結晶。

圖4 AgNO3-SFME和NaBH4-SFME樣品的Tyndall現象照片(A);AgNPs-SFME的TEM照片(B)和XRD譜圖(C)
在實際教學中,可根據情況選擇一種或兩種技術對AgNPs進行表征。即使無法對AgNPs-SFME進行表征,也不會影響后續實驗。
此外,AgNPs也可通過簡單的直接沉淀法制備。但是,由于缺少微乳液滴的模板效應,顆粒尺寸和形貌通常難以得到較好的控制。教學過程中可以鼓勵學生自主開展相關實驗,對比兩種方法所制備的AgNPs。
3 AgNPs催化4-硝基苯酚還原反應的動力學
3.1 實驗原理
貴金屬納米粒子因高的比表面積以及表面原子特異的化學性質而表現出較高的催化活性。研究表明AgNPs可催化4-硝基苯酚還原為4-胺基苯酚(圖5)[14]。
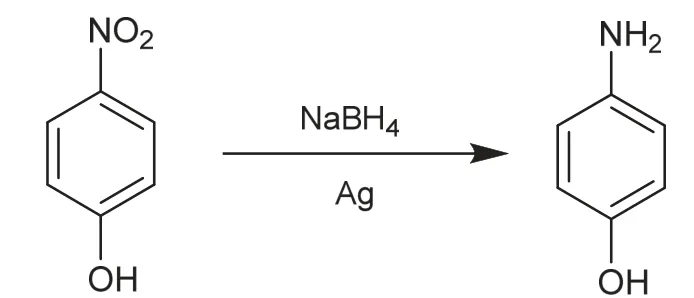
圖5 4-硝基苯酚的還原反應
堿性條件下,4-硝基苯酚在400 nm左右具有典型的UV-Vis特征吸收峰,而還原產物4-胺基苯酚的λmax則在300 nm附近,兩者互不干擾。根據Lambert-Beer定律:
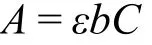
其中A為吸光度,ε為摩爾吸光系數,b為吸收池厚度,C為吸光物質的濃度,A與C成正比關系。因此,可以通過UV-Vis法對AgNPs催化還原4-硝基苯酚反應的動力學過程進行實時監測。
3.2 4-硝基苯酚的標準曲線
為了對反應過程中反應物濃度進行定量,需要先建立4-硝基苯酚的標準曲線。如圖6所示,在實驗濃度范圍內,4-硝基苯酚的濃度-吸光度顯示出優異的線性關系:y= 0.01866x- 0.01902,R2= 0.9967。
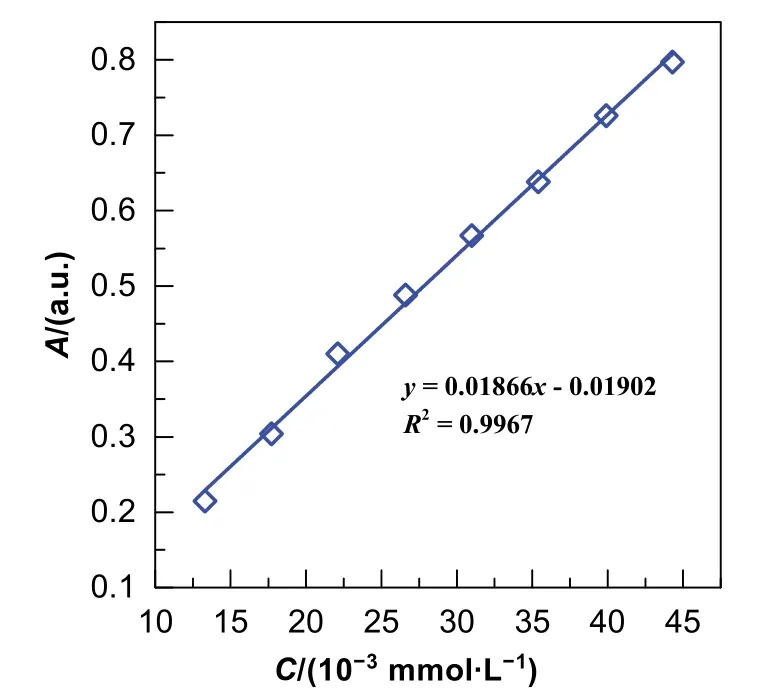
圖6 4-硝基苯酚的濃度-吸光度標準曲線
3.3 反應動力學
將15 μL AgNPs-SFME分散液和4 mL 4-硝基苯酚溶液(0.1 mmol·L-1)混合于比色皿中,超聲振蕩30 s后,加入25 μL NaBH4水溶液(0.5 mol·L-1),超聲振蕩,并開始計時。為了避免AgNPs的紫外吸收所帶來的干擾,體系中AgNPs的濃度控制在0.01 mmol·L-1以下。
宏觀上,隨著NaBH4的加入,4-硝基苯酚和NaBH4混合體系的顏色逐漸由黃色或淡黃色變為無色。通過對樣品的UV-Vis光譜掃描,可以發現4-硝基苯酚在400 nm處的特征吸收隨著AgNPs-SFME的加入迅速降低,并在35 min后達到最小(圖7A)。根據標準曲線計算4-硝基苯酚的濃度,從而可以建立反應物濃度隨時間的變化。如圖7C所示,ln[4-硝基苯酚]與反應時間呈明顯的線性關系,符合一級反應動力學特征。根據線性擬合的結果可知,以AgNPs-SFME為催化劑的反應速率常數是0.0916 min-1。
為了更好地了解界面吸附的影響,我們提供了基于SBME (16.65% (w)十六烷基三甲基溴化銨、33.16% (w)正丁醇、25.22% (w)乙酸乙酯,其余為水)制備的AgNPs-SBME分散液(2.5 mmol·L-1),平均粒徑2.0 ± 0.11 nm。相比之下,加入相同量AgNPs-SBME后,4-硝基苯酚的特征吸收下降較慢,100 min后才降至最小(圖7B),以AgNPs-SBME作催化劑的反應速率常數約為0.0309 min-1(圖7C)。
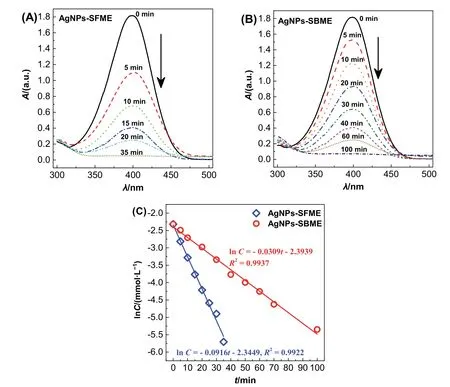
圖7 4-硝基苯酚紫外-可見吸收光譜隨時間的變化(A,B)和4-硝基苯酚濃度與反應時間的關系(C)
無論是直觀的吸光度變化,還是擬合得到的反應速率常數,均表明AgNPs-SFME的催化活性較高,而AgNPs-SBME的催化活性略低。這主要歸因于表面活性劑在AgNPs-SBME上吸附所致。
在這一環節,可鼓勵學生對由不同方法獲得的AgNPs的催化活性進行分析、思考,并設計簡單的實驗進行驗證(例如:對AgNPs-SBME離心洗滌后再評價催化活性)。若時間允許,或采取分組方式,在實際教學中可平行安排SFME和SBME的構筑及AgNPs的制備,進行組間對比。當然,也可以加入直接沉淀制備的AgNPs進行對比實驗。同時,也可安排學生考查不同溫度下的反應動力學,進而獲得不同AgNPs催化下反應活化能。
4 可行性分析
(1) 硬件可行性。本實驗所需的試劑均是化學實驗中常用試劑,廉價易得、安全隱患小、易于管理。所需儀器也較為常見,多數高校都有配置。至于TEM和XRD兩種大型儀器即使沒有配置,也不影響實驗的順利開展。
(2) 內容可行性。本實驗所涉及的內容屬于物理化學課程的核心內容,是教學大綱中要求學生熟練掌握的部分。雖然三元相圖部分高校不做要求,但本實驗的相圖屬于較為簡單的一類。即使沒有學習,也可根據二元相圖的知識進行理解。
(3) 時間可行性。本實驗可按照3-5天進行安排。根據時間長短,可自主增減相應內容,具有較高的靈活性。
(4) 滿足兩性一度要求。要完成上述實驗,學生不僅需要具備扎實的理論知識基礎,而且要能夠對相圖、膠體、界面、動力學和催化等多個物理化學理論進行靈活的綜合運用,并且需要具備從現象提出問題,做出判斷,進而設計實驗進行驗證的能力。完全達到了高等教育的兩性一度要求。
5 實驗開設建議
(1) 施教對象:本實驗面向化學化工類專業本科高年級學生開設,最佳施教對象應為修完物理化學等基礎化學課程的大二或大三學生,可作為化學化工類專業基礎化學綜合實驗教學內容。
(2) 時間安排:本實驗綜合性較強,經驗證一個實驗流程大約需要3-5個教學工作日。因此,建議在短學期的綜合實踐環節開展,時長1周。
(3) 人員安排:按照一個實驗教學班28-32人計,可分成14-16組,每組2人。
(4) 實驗內容:主要實驗內容包括,① 水-乙醇-乙酸乙酯SFME的構筑及Tyndall現象觀察(1天);② 微區劃分(0.5天);③ SFME模板法制備AgNPs及表征(1天);④ AgNPs催化4-硝基苯酚還原反應的動力學(1天);⑤ 4-硝基苯酚的標準曲線(0.5天);⑥ 其他方法制備AgNPs (1天);⑦ 活化能(0.5天)。其中①-④為每組學生必須完成項,⑤-⑦可作為選做項目,⑤-⑥也可由教師提供。
(5) 前期準備:實驗開始前一周,教師通過學生工作群將實驗目的提供給學生,鼓勵學生自主查閱相關資料,如微乳的制備、三元相圖的繪制、AgNPs的制備等,小組討論后制定實驗方案,經教師檢查后提出修改建議、注意事項等,如相界面的觀察、催化劑濃度、反應過程監測等。
(6) 實驗過程:每組學生根據教師審核通過后的實驗方案開展實驗,在實驗過程中,教師可引導學生關注實驗現象背后的本質,如Tyndall現象、催化反應中的顏色變化等。
(7) 實驗結束后,要求學生完成一份完整的實驗報告,尤其要通過對實驗現象和實驗數據的深入分析和討論,建立“現象-數據-理論”三者之間的內在關聯。
6 結語
設計了一個涉及相圖、膠體與界面化學、動力學等多個知識點的物理化學綜合實驗,搭建了熱力學與動力學之間的橋梁,融入了膠體與納米科學等前沿研究,有助于學生完善知識架構,激發科研興趣,培養創新思維。同時,該實驗也積極引導學生關注化學化工的綠色化發展問題,培養學生的環保意識與科學擔當精神。此外,該實驗也為學有余力的學生保留了進一步提升能力的空間(如:可鼓勵學生設計實驗對催化活性的差異進行分析)。總之,該綜合實驗不僅有助于提升學生的綜合實踐能力,而且有助于拓展創新思維,提高科學素養,是對“一流課程”建設的有力支撐。

