蘇州醫(yī)工所在多藥耐藥腫瘤非特異性發(fā)生機(jī)制研究中獲進(jìn)展
化療是癌癥治療的主要途徑之一,但其往往伴隨著腫瘤耐藥現(xiàn)象的出現(xiàn),并最終出現(xiàn)多藥耐藥而使絕大多數(shù)藥物失效,治療效果大大降低。經(jīng)過(guò)長(zhǎng)期探索,研究人員已揭示出眾多的耐藥現(xiàn)象發(fā)生機(jī)制,其中最廣為人知的是化療藥物對(duì)于耐藥蛋白,即腺苷三磷酸結(jié)合盒轉(zhuǎn)運(yùn)蛋白(ABC轉(zhuǎn)運(yùn)蛋白)的誘導(dǎo)作用,使其高表達(dá)并泵出化療藥物使治療失效。然而進(jìn)一步的研究發(fā)現(xiàn),不涉及藥物處理的放療同樣可導(dǎo)致耐藥腫瘤細(xì)胞的出現(xiàn),從而表明新的耐藥發(fā)生機(jī)制仍有待于探索。
中國(guó)科學(xué)院蘇州生物醫(yī)學(xué)工程技術(shù)研究所研究員殷建長(zhǎng)期從事腫瘤多藥耐藥相關(guān)機(jī)制探索,發(fā)現(xiàn)非底物型納米粒子可通過(guò)誘導(dǎo)氧化損傷引起腫瘤耐藥現(xiàn)象的發(fā)生(Yuan et al,Toxicology,2021),提示不僅是底物誘導(dǎo),過(guò)氧化環(huán)境也可推動(dòng)腫瘤獲得耐藥性。
為驗(yàn)證這一結(jié)論,該團(tuán)隊(duì)進(jìn)一步以肺癌細(xì)胞系(A549)為模型,測(cè)試了三種化學(xué)試劑(乙醇、過(guò)氧化氫和多柔比星)與ABC轉(zhuǎn)運(yùn)蛋白的相互作用。這三者中,多柔比星為ABC轉(zhuǎn)運(yùn)蛋白底物及化療藥物,乙醇和過(guò)氧化氫為小分子化合物,與ABC轉(zhuǎn)運(yùn)蛋白功能無(wú)關(guān)。當(dāng)三種物質(zhì)進(jìn)入細(xì)胞后,均可引起細(xì)胞的氧化應(yīng)激壓力升高,腫瘤細(xì)胞通過(guò)消耗細(xì)胞內(nèi)的谷胱甘肽(GSH)實(shí)現(xiàn)氧化應(yīng)激的解毒,但當(dāng)GSH被消耗過(guò)度后,所產(chǎn)生的大量氧化產(chǎn)物將誘導(dǎo)轉(zhuǎn)運(yùn)蛋白表達(dá),上升的轉(zhuǎn)運(yùn)蛋白通過(guò)外排氧化產(chǎn)物來(lái)降低細(xì)胞內(nèi)的氧化應(yīng)激壓力,進(jìn)而實(shí)現(xiàn)解毒。該過(guò)程中,孕烷X受體(PXR)起著重要的調(diào)控作用。所獲得的結(jié)果表明,非底物化學(xué)試劑同樣可在引發(fā)過(guò)氧化損傷后,產(chǎn)生與化療藥物類(lèi)似的誘導(dǎo)ABC轉(zhuǎn)運(yùn)蛋白表達(dá)的現(xiàn)象。這一現(xiàn)象可視為腫瘤細(xì)胞/ABC轉(zhuǎn)運(yùn)蛋白對(duì)外界刺激的非特異性反饋,從而揭示了腫瘤治療中耐藥腫瘤(90%以上)必然出現(xiàn)的原因。
研究結(jié)果驗(yàn)證了多藥耐藥機(jī)制與氧化應(yīng)激之間的關(guān)系,并將有助于設(shè)計(jì)如何增強(qiáng)這種機(jī)制的先進(jìn)策略,以有效對(duì)抗ABC轉(zhuǎn)運(yùn)蛋白介導(dǎo)的多藥耐藥現(xiàn)象。此外,考慮過(guò)氧化損傷是當(dāng)前環(huán)境污染物毒性的主要來(lái)源,因此,長(zhǎng)期暴露于污染環(huán)境不僅引發(fā)直觀毒性,也可通過(guò)誘導(dǎo)腫瘤耐藥,進(jìn)一步威脅人體健康。
相關(guān)研究成果以“Oxidative stress-mediated upregulation of ABC transporters in lung cancer cells”為題發(fā)表于Journal of Biochemical and Molecular Toxicology。該研究工作得到了國(guó)家自然科學(xué)基金、中科院青年創(chuàng)新促進(jìn)會(huì)等項(xiàng)目的資助。
(蘇州生物醫(yī)學(xué)工程技術(shù)研究所)
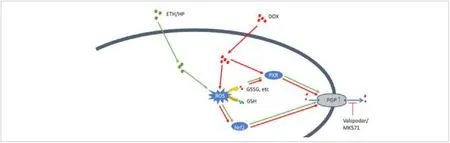
▲乙醇、過(guò)氧化氫和多柔比星誘導(dǎo)腫瘤細(xì)胞中ABC轉(zhuǎn)運(yùn)蛋白的作用機(jī)制

