泊沙康唑原料細菌內毒素檢查方法的建立
耿 雪,南紅燕,范治云,劉 娜,祝清芬,李 軍*
(1. 山東省食品藥品檢驗研究院 國家藥品監督管理局仿制藥研究與評價重點實驗室 山東省仿制藥一致性評價工程技術研究中心,山東 濟南 250101;2. 山東金城醫藥研究院有限公司,山東 淄博 255000)
泊沙康唑(posaconazole)是伊曲康唑的衍生物,商品名Noxafil,為第二代三唑類抗真菌藥物,與第一代相比具有更強、更廣的抗菌譜,適用于免疫系統嚴重受損的患者[1]。作用機制為抑制一種對真菌細胞色素P450具有依賴性的酶-羊毛甾醇14α-去甲基化酶,使麥角甾醇合成受阻從而導致真菌細胞膜上麥角甾醇缺失[2]。泊沙康唑原研廠家為原先靈葆雅公司,2005年11月其口服混懸液在歐洲首次上市,為了適用于需要靜脈給藥或不能口服用藥的患者,后又研制出不同劑型。美國FDA分別于2009年、2013年和2014年批準了Merck公司生產的泊沙康唑口服混懸液(40 mg/ml)、緩釋片劑(100 mg/片)及泊沙康唑注射液(16.7 ml:300 mg)上市,此3種劑型也已獲得我國國家藥品監督管理局(NMPA)批準進口。我國目前已有注射液仿制藥產品上市。
細菌內毒素檢查為注射劑安全性檢查的重要項目。建立泊沙康唑注射液原料的細菌內毒素檢查方法也是對其質量進行控制的重要一環。目前,各國藥典及原研產品標準對泊沙康唑原料細菌內毒素限度并無規定,國內也尚無相關文獻報道,亟需研究建立一種泊沙康唑原料的細菌內毒檢查方法。泊沙康唑的分子式為C37H42F2N8O4,相對分子質量700.78,在水和酸性介質中溶解度小[3]。建立細菌內毒素檢查方法的前提是樣品應溶于水或合適的檢查溶劑中[4],常規方法不能實現該原料的細菌內毒素檢查,故采用合適的溶劑并進行方法適用性考察是本研究的重點。本研究將為泊沙康唑原料質量標準中制定細菌內毒素檢查項提供依據,同時為其他三唑類抗菌產品的細菌內毒素檢查提供參考。
1 儀器與材料
1.1 儀器
ZH-2型自動漩渦混合器(天津藥典標準儀器廠);ET-96內毒素凝膠法測定儀(天津市天大天發科技有限公司);XSR-205DU電子天平(梅特勒-托利多公司)。
1.2 材料與試劑
鱟試劑1,批號:2010193,標示靈敏度(λ):0.25 EU/ml,湛江博康海洋生物有限公司;鱟試劑2,批號:2006281,λ:0.25 EU/ml,湛江安度斯生物有限公司; 細菌內毒素檢查用水(BET水),批號:2002180,規格:5 ml/支,湛江安度斯生物有限公司;細菌內毒素工作標準品(WSE,批號:150601-202089,效價:90 EU/支,中國食品藥品檢定研究院);泊沙康唑(批號:S07002102001,S07002103001,S07002103002,山東金城昆侖藥業有限公司);吐溫80(批號:20180420,國藥集團化學試劑有限公司);四氫呋喃(批號:20200210,國藥集團化學試劑有限公司)。
2 方法與結果
2.1 試劑靈敏度復核
按《中國藥典》2020年版四部通則1143細菌內毒素檢查法[5]項下鱟試劑靈敏度復核的要求,分別對兩批鱟試劑進行靈敏度復核,結果2010193批鱟試劑靈敏度的測定值(λc)=0.177 EU/ml,2006281批鱟試劑λc=0.125 EU/ml,兩批鱟試劑λc均在0.5λ~2.0λ之間,兩批鱟試劑均可用于試驗。
2.2 限值計算
根據泊沙康唑注射液說明書,本品用法用量為:適用于18歲及以上人群,靜脈滴注,首日300 mg/次,一天兩次;維持劑量,300 mg/次,一天一次。按下式計算細菌內毒素限值(L)。

式中,K為人每千克體重每小時最大可接受的內毒素劑量,注射劑K=5.0 EU/(kg·h);M為人用每千克體重每小時的最大供試品劑量,人均體重按60 kg計算,得M=5 mg/(kg·h),經計算得泊沙康唑的內毒素限值為1.0 EU/mg,從嚴制訂限值為0.5 EU/mg。
2.3 泊沙康唑溶解方法的確立
泊沙康唑不溶于水,可溶解于二甲基亞砜、無水乙醇等有機溶劑,但進一步用水稀釋后會形成沉淀析出。本試驗考慮采用有機溶劑加助溶劑吐溫80進行配伍溶解供試品。分別將吐溫80和四氫呋喃按1:1,1:2,1:4,1:8體積配比配制成混合溶液,作為溶劑溶解供試品,肉眼觀察供試品的溶解情況。最終確定四氫呋喃-吐溫80(4:1)溶液作為溶劑,可制備成最大濃度為50 mg/ml的供試品溶液(完全溶解),進一步用BET水稀釋至1 mg/ml后,形成白色混懸液,可用作細菌內毒素檢查。
2.4 供試品干擾試驗
2.4.1 干擾試驗預試驗 目前市售鱟試劑靈敏度一般在0.5~0.015 EU/ml之間,本品細菌內毒素限值為0.5 EU/mg。根據供試品的最小有效濃度(MVC)=鱟試劑的標示靈敏度(λ)/L,計算得到相應的供試品最小有效濃度分別為1,0.5,0.25,0.125,0.06,0.03 mg/ml。
取批號為S07002102001的供試品,批號為2010193的鱟試劑(λ為0.25 EU/ml)進行預試驗。取供試品,用四氫呋喃-吐溫80(4:1)溶液配制成濃度為50 mg/ml的供試品溶液,并進一步用BET水稀釋成為濃度為1,0.5,0.25,0.125,0.062,0.031 mg/ml的供試品溶液(稀釋過程中溶液會變渾濁);另分別取用BET水稀釋制備的濃度為2,1,0.5,0.25,0.125,0.062 mg/ml的供試品溶液,加入等體積的4.0λ內毒素標準溶液,配制成供試品陽性對照溶液。每一濃度平行做2支供試品管,2支供試品陽性對照管,另設2支陰性對照(BET水)管,2支陽性對照(2.0λ內毒素標準溶液)管。試驗結果見表1。經預試,本品在1 mg/ml及以下濃度時對試驗無干擾作用。根據預試驗結果,采用兩個生產廠家的鱟試劑對供試品進行正式干擾試驗。

表1 細菌內毒素干擾預試驗結果
2.4.2 干擾試驗 取供試品,用四氫呋喃-吐溫80(4:1)溶液配制成濃度為50 mg/ml的供試品溶液。用BET水將細菌內毒素工作標準品復溶,并稀釋制成0.50,0.25,0.125,0.0625 EU/ml細菌內毒素標準品溶液;同時取1.0,0.50,0.25,0.125 EU/ml細菌內毒素標準品溶液,分別加入等體積的2 mg/ml供試品溶液,制備含細菌內毒素的供試品溶液。使用兩個生產廠家的鱟試劑(鱟試劑1、鱟試劑2)進行試驗,觀察供試品濃度為1 mg/ml時對試驗的干擾情況。細菌內毒素標準品溶液每一濃度平行做2管,含細菌內毒素的供試品溶液每一濃度平行做4管,同時另取BET水和1 mg/ml供試品溶液各做兩支對照管。3批同法操作。
試驗結果見表2。分別計算內毒素標準溶液反應終點濃度的幾何平均值(Es)和含細菌內毒素的供試品溶液反應終點濃度的幾何平均值(Et),判斷供試品對試驗有無干擾作用。結果表明,供試品溶液和陰性對照溶液(BET水)的所有平行管均為陰性,且系列濃度供試品溶液的結果符合鱟試劑靈敏度復核試驗要求(Es均在0.5λ~2.0λ之間),該試驗有效。所有批次含細菌內毒素的1 mg/ml供試品溶液的結果符合鱟試劑靈敏度復核試驗要求(Et均在0.5λ~2.0λ之間),認為供試品濃度為1 mg/ml時對試驗無干擾作用。

表2 細菌內毒素干擾試驗結果
2.5 供試品細菌內毒素檢查
取供試品,按《中國藥典》2020年版四部通則1143細菌內毒素檢查法,采用鱟試劑1對3批供試品進行檢查。結果3批供試品內毒素含量均小于0.5 EU/mg,符合規定。結果見表3。
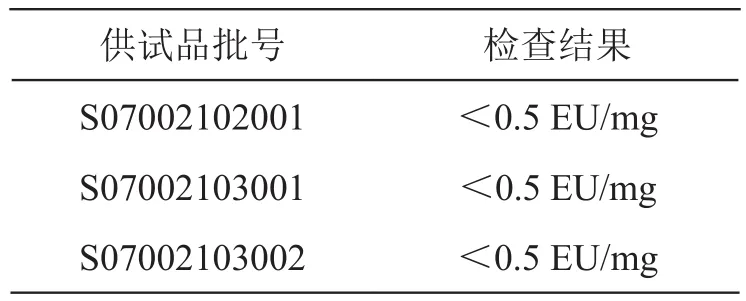
表3 泊沙康唑細菌內毒素檢查結果
3 討論
細菌內毒素作為細菌死亡或解體后才釋放出來的一種具有生物活性的物質,具有耐熱性強、可過濾的特點[6],通過注射進入血液會對人的健康甚至生命安全產生巨大影響。《藥品GMP指南》要求,在注射劑(無菌制劑)生產的各個過程都應對細菌內毒素進行控制[7],雖然在各個環節都存在內毒素被帶入藥物中的風險,但從源頭對泊沙康唑原料的細菌內毒素含量進行控制更為有效。
本研究建立了泊沙康唑原料的細菌內毒素檢查方法。因本品不溶于水、乙醇、DMSO等溶劑,采用四氫呋喃-吐溫80(4:1)溶液作為溶劑先溶解供試品后,進一步用水稀釋進行細菌內毒檢查。結果表明,泊沙康唑在1 mg/ml及以下濃度時對試驗無干擾作用。泊沙康唑原料質量標準建議制訂為:取本品,加四氫呋喃-吐溫80(4:1)溶液溶解制成每1 ml中含泊沙康唑50 mg的溶液,依法檢查(《中國藥典》2020年版四部通則1143),每1 mg泊沙康唑中含內毒素的量應小于0.5 EU(供注射用)。此外,對于不溶于水的原料建立細菌內毒素檢查方法,應充分考慮非水溶劑對供試品中內毒素的干擾情況。本研究也為其他不溶于水的原料品種建立細菌內毒素檢查方法提供了依據。

