70例卵巢癌患者治療期間外周血T淋巴細胞亞群測定的臨床意義
婁 俊 易 韻 儲小燕 鐘琳琳 王 超
卵巢癌是女性生殖系統常見惡性腫瘤,在全球患病致死率居高位[1]。目前臨床治療方案以化療藥物、手術及靶向藥物等聯合的綜合治療。本研究通過流式細胞儀檢測卵巢癌患者外周血T細胞亞群在整個治療過程中的變化,觀察其免疫功能變化規律,為臨床提供有價值的文獻資料。
1 資料與方法
1.1 一般資料
選取本院2018年3月至2021年3月收治的70例均經手術病理檢查證實的卵巢癌患者為研究對象,年齡為37~75歲,平均(57.9±8.39)歲,FIGO分期Ⅰ期6例,Ⅱ期7例,Ⅲ期38例,Ⅳ期19例。患者治療以化療加手術治療為主。本研究治療時段分為:治療早期、治療中期、治療后期;以手術為節點,手術前化療和手術為治療早期,手術后3個周期化療為治療中期,最后3個周期化療為治療后期。療效差是指患者腫瘤CA125下降不理想、上升和(或)影像學檢查提示病情進展;復發患者指再次因卵巢惡性腫瘤復發入院;療效好是指患者規范完成治療療程,定期復查病情穩定、無復發;本研究間隔時長≤2年。以上所有患者無免疫系統疾病,未服用免疫相關制劑,未行放療。
1.2 檢測方法
所有入組患者晨起空腹抽靜脈血5 ml,以肝素抗凝。紅細胞裂解液裂解紅細胞、淋巴細胞分離液分離淋巴細胞,隨后使用流式細胞儀檢測。觀察記錄CD3、CD4、CD8的數據,分析各淋巴細胞亞群情況;本實驗CD3、CD4、CD8數據正常范圍分別為:770~2860個/μl、414~1440個/μl,238~1250個/μl。操作嚴格按照試劑盒儀器說明書進行。各項數據上傳于數據庫。
1.3 治療方法
入組患者為卵巢癌初診患者,有意愿納入研究對象,經我院卵巢癌規范化治療,手術方案根據患者術中探查具體情況,中晚期患者在第2~3個周期新輔助化療后手術,化療方案以紫杉醇類加鉑類經典方案。有病理確診,如病理檢查提示其他性質腫瘤給予剔除。
1.4 統計學處理
應用SPSS 19.0軟件進行統計處理,計量資料采用均數±標準差表示,組間比較采用t檢驗,P<0.05認為差異具有統計學意義;計數資料采用χ2檢驗,P<0.05表示差異具顯著性。
2 結果
2.1 不同臨床分期卵巢癌外周血淋巴細胞亞群水平的比較
治療前早中期(Ⅰ、Ⅱ期)與晚期(Ⅲ、Ⅳ期)卵巢癌患者血CA125水平比較差異有統計學意義(P<0.05);而不同臨床分期患者在年齡、淋巴細胞亞群數值、白細胞數量、堿性磷酸酶以及C-反應蛋白水平比較無顯著性差異(P>0.05),見表1。

表1 不同臨床分期卵巢癌患者各項指標的比較
2.2 治療期間患者外周血淋巴細胞亞群水平變化
表2表明:在不同治療時期外周血CD3、CD4、CD8和白細胞數量、CA125數值,各組間均有統計學意義(P<0.05),治療前期CD4/CD8比值與治療中、后期比較存在統計學差異(P<0.05)。
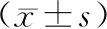
表2 治療期間CD3、CD4、CD8、CD4/CD8、白細胞、堿性磷酸酶、CA125水平對比
2.3 療效差、復發患者和療效好患者外周血淋巴細胞亞群的變化
療效差者或復發者外周血淋巴細胞數呈下降趨勢或持續低下狀態,其比例與療效好患者比較有明顯統計學意義(P<0.05),見表3。

表3 療效差、復發與療效好者淋巴細胞數變化(例,%)
3 討論
治療卵巢癌手段以化療結合手術為主綜合治療,化療作為卵巢癌必備治療方式,目前國際上公認的上皮性卵巢癌化療一線方案為TP方案,即紫杉類化合物聯合鉑類抗腫瘤化療。兩類化療藥物作用機制:前者屬于植物類細胞周期特異性藥物,作用于細胞M期,加強微管蛋白聚合作用和抑制微管解聚作用,導致形成非功能性微管束,破壞腫瘤細胞有絲分裂;后者鉑類化療藥屬于細胞周期非特異性藥物,直接破壞DNA并阻止其復制的藥物。TP化療對卵巢癌患者雖然能起到殺死腫瘤細胞和防止復發,但機體正常細胞對化療藥物的耐受性不可忽視。卵巢癌分期手術和腫瘤細胞減滅術為卵巢癌治療的首選,是有效治療手段。有文章報道[2]惡性腫瘤外周血T淋巴細胞亞群隨著腫瘤病情的進展,體內CD4、CD4/CD8比值降低,通過手術后癌細胞減少,體內可能存在的免疫抑制因子失活,CD4、CD4/CD8比值上升至正常水平。本實驗研究顯示患者治療早期因腫瘤細胞抑制和減負,機體免疫系統得已重建并提升;而治療晚期可能因多次化療導致機體整體免疫系統受損并對免疫系統產生抑制作用。
T淋巴細胞作為一種胸腺依賴性淋巴細胞,T細胞活化及其細胞因子表達在抗腫瘤免疫效應中發揮重要作用[3]。外周血T淋巴細胞目前研究多為CD3、CD4、CD8,CD3起到傳遞抗原信息并激活T細胞,CD4為協助并增強免疫能力,CD8為殺傷T細胞,直接識別、殺傷異常細胞,且具有免疫調節效應,CD4/CD8比值的恒定維持著細胞免疫反應的平衡。免疫功能低下存在于內在因素及外在因素,包括自身免疫系統缺陷,腫瘤對免疫系統的抑制及長期應用藥物對免疫細胞的殺傷。從研究資料圖表卵巢癌患者外周血T淋巴細胞亞群的變化進行分析,入院中晚期卵巢癌患者因自身條件因素免疫系統存在不同程度下降;患者經化療后,從圖表免疫系統CD3、CD4、CD8、CD4/CD8的數值來分析,前期治療過程中能有效改善及恢復免疫系統,早前階段化療能促進免疫系統修復;后期化療對患者免疫系統可能有一定損傷,大部分患者在第5個周期化療后患者免疫系統急劇下降,且臨床觀察發現多周期化療后藥物累積毒副反應加重,白細胞減少、胃腸反應程度、肝腎功能受損等相應提升。大量文獻報道[4],給予多次化療患者聯合生物免疫治療,治療效果更好,患者依從性更強,能有效提高患者治療率,對患者生活質量也能起到積極作用。因此我們可以得出結論,卵巢癌晚期患者在需要行化療同時,建議可適當予免疫支持治療,CA125下降理想且能穩定保持,在提高患者療效同時還能助于改善其機體免疫系統。
有部分研究報道[5],卵巢癌病情嚴重程度與免疫系統受損程度呈正相關,病情越晚,免疫功能越差。本實驗研究所述,入院檢測卵巢癌患者免疫功能低下,病情早晚與她們的免疫狀態無明顯相關性,治療后免疫淋巴細胞存在改變,通過測定不同治療時段的卵巢癌患者外周血免疫細胞數值,了解卵巢癌免疫功能狀態,為治療評判療效可提供參考,也為今后腫瘤免疫治療時機選擇提供數據支持。免疫治療[6]在腫瘤患者運用前景廣泛,方式多樣,目前單用免疫檢查點抑制劑單克隆治療,如PD-1或PD-L1,效果欠佳,聯合化療、靶向藥物治療已取得一些臨床數據,有部分數據是可喜的,表明免疫治療有治療意義所在;研究[7]進一步還表明,PD-1聯合PAPPi抑制劑治療發現對于BRCA突變、重組缺陷患者來說效果更好。還有更多研究實驗在探索免疫治療藥物對卵巢癌患者的療效中,我們臨床醫師期待更多驚喜。

