血清TTR 、PD-L1與復發或難治彌漫性大B細胞淋巴瘤臨床病理特征及預后的關系
周 航 王 玉 彭亞楠
彌漫性大B細胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是最常見的侵襲性非霍奇金淋巴瘤,其在遺傳學及臨床特征上均具有異質性[1,2]。對于初次治療的DLBCL,經一治療后,約80%的患者可達到治愈,但依舊有小部分患者存在耐藥情況,繼而轉復發或難治DLBCL(relapsed or refractory DLBCL,R/R DLBCL)[3]。R/R DLBCL是造成全球DLBCL高死亡率的主要原因,有效預測患者病情進展及治療效果,在指導臨床用藥,降低DLBCL轉為R/R DLBCL中具有重要意義。劉虎等[4]研究發現,R/R DLBCL患者血清甲狀腺素運載蛋白(transthyretin,TTR)水平顯著高于緩解期患者,且高水平TTR將增加患者不良預后風險。程序性細胞死亡配體1/程序性細胞死亡受體1(programmed death ligand/programmed death 1,PD-L1/PD-1)是一種免疫負調節通路,在抑制腫瘤微環境形成,促使腫瘤獲得免疫逃逸中具有重要意義。可溶性程序性死亡配體1(soluble programmed death protein ligand 1,sPD-L1)是PD-L1在血液中的存在形式,檢測方便且可反映機體整體水平[5,6]。研究TTR及sPD-L1與R/R DLBCL患者病理特征及預后的關系,可為臨床預測R/R DLBCL提供依據,基于以上背景,我院開展如下研究。
1 材料與方法
1.1 一般資料
開展前瞻性研究,將我院2017年1月至2019年1月間收治的170例初治DLBCL患者納為研究對象,抽取治療前外周靜脈血,采用R-CHOP方案化療2~8個周期,評估療效,將其中41例復發/難治性DLBCL患者納為觀察組,129例緩解DLBCL患者納為對照組。①R/R-DLBCL診斷:參照全國難治性淋巴瘤學術研討會中相關標準,復發性DLBCL為誘導治療達到完全緩解,但1個月后再次復發;難治性DLBCL為在治療初期淋巴進展,或經治療后病情還在繼續進展,并經組織活檢證實腫瘤存在與轉移。②緩解DLBCL定義:參照NHL NCCN指南2016.V2版Lugano NHL療效評估標準,經治療后達到完全緩解及部分緩解標準的患者納為緩解DLBCL者。③納入標準:所有患者均經淋巴結病理檢查證實為DLBCL;R/R-DLBCL及緩解DLBCL分別符合上述相關標準。④排除標準:排除既往腫瘤史、免疫系統疾病史患者;合并感染者;應用免疫抑制劑、細胞毒性藥物及抗腫瘤藥物者。
1.2 方法
1.2.1 血清TTR及sPD-L1水平檢測 治療前,采集被研究者外周靜脈血6 ml,3000 r/min高速離心10 min,分離上層血清,置于-60℃冰箱內保存。酶聯免疫吸附法(ELISA)檢測患者血清TTR水平,試劑盒購自上海酶遠生物科技公司,嚴格按照試劑盒相關步驟進行操作。采用雙抗體夾心ABC-ELISA法檢測sPD-L1水平,試劑盒購自中國Uscn life Science,嚴格按照試劑盒相關步驟進行操作。
1.2.2 患者資料收集 臨床特征:年齡、性別、臨床分期(參照Ann Arbor臨床分期系統)、體能狀態(ECOG評分標準)、原發病灶位置、血清乳酸脫氫酶、血清白蛋白水平、有無B癥狀。病理特征:采用Hans分型系統,免疫組化染色確定GCB或nonGCB來源,IHC法測定C-MYC、BCl-2、BCl-6及Ki67蛋白表達情況,確定是否存在雙或三表達。根據R/R DLBCL患者血清平均TTR及sPD-L1水平,將其分為高TTR組與低TTR組,高sPD-L1組與低sPD-L1組,隨訪2年,分別繪制生存曲線,分析血清TTR及sPD-L1對R/R DLBCL患者預后的影響。
1.3 統計學方法
2 結果
2.1 R/R DLBCL組與緩解組患者血清TTR及sPD-L1水平比較
R/R DLBCL組患者血清TTR及sPD-L1水平均顯著高于緩解組(P<0.05),見表1。
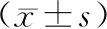
表1 兩組患者血清TTR及sPD-L1水平比較
2.2 不同臨床特征R/R DLBCL患者血清TTR及sPD-L1水平比較
分析發現,R/R DLBCL患者結外病變、血清LDH與其血清TTR及sPD-L1水平有關(P<0.05),其他臨床特征與血清TTR及sPD-L1水平無明顯相關性(P>0.05),見表2。
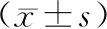
表2 不同臨床特征R/R DLBCL患者血清TTR及sPD-L1水平比較
2.3 不同病理特征 R/R DLBCL患者血清TTR及sPD-L1水平比較
Hans分型、C-MYC/BCL-2及C-MYC/BCL-2/BCL-6表達水平均與R/R DLBCL患者血清TTR及sPD-L1水平相關,其他病理特征對R/R DLBCL患者血清TTR及sPD-L1水平的影響不明顯(P>0.05),見表3。
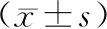
表3 不同病理特征 R/R DLBCL患者血清TTR及sPD-L1水平比較
2.4 血清不同濃度TTR及sPD-L1與R/R DLBCL患者預后的關系分析
以R/R DLBCL患者血清平均TTR及sPD-L1水平為分界點,將41例R/R DLBCL患者分為TTR高表達組(n=20)與低表達組(n=21),sPD-L1高表達組(n=16)與低表達組(n=25),繪制生存曲線發現,TTR高表達組患者生存狀況顯著優于TTR低表達組(Log Rank χ2=6.397,P<0.05)。sPD-L1高表達組患者生存狀況顯著優于sPD-L1低表達組(Log Rank χ2=9.018,P<0.05)。見圖1,圖2。

圖1 血清不同濃度TTR患者生存曲線

圖2 血清不同濃度sPD-L1患者生存曲線
3 討論
DLBCL患者通過免疫治療聯合化療后可獲得完全緩解,但有臨床統計發現,約30%~40%的患者初治即難治,或經初治后達到CR,但后來復發[7]。對于R/R DLBCL患者來說,其獲得完全緩解的幾率很低,R/R DLBCL是造成DLBCL死亡的主要原因。在治療初期便有效篩查能有效反映DLBCL病情發展及預后的敏感指標,幫助醫生判斷患者可能獲得的治療療效,進而改善治療方案及臨床用藥途徑,在避免病情發展為R/R DLBCL,降低治療難度,提高患者預后中具有重要意義。本文將170例初治DLBCL患者納為研究對象,經一線治療后統計患者治療效果,將其中41例R/R DLBCL患者納為觀察組,達到緩解效果的129例緩解患者納為對照組,比較兩組治療前血清TTR及sPD-L1水平發現,觀察組患者血清TTR及sPD-L1水平顯著高于對照組,提示初次治療前血清TTR及sPD-F1在反映患者最終治療效果及病情發展趨勢中可能具有一定的價值。
TTR是由四個相同多肽亞基組成的同源四聚體,能與視黃醇結合蛋白相結合,參與甲狀腺素T4與維生素A的轉運,其血清濃度可有效反映機體蛋白平衡狀態及營養狀態[8]。隨著研究的不斷進展,有學者發現[9,10],TTR在肺癌、卵巢癌、直腸癌等多種惡性腫瘤中均呈高表達,并被證實為卵巢癌的生物標志物[11]。提示TTR可作為多種腫瘤診斷、進展及預后的有效標志物。我院研究發現,R/R DLBCL患者血清TTR水平顯著高于緩解DLBCL患者,提示血清TTR水平在反映患者治療療效及病情進展中可能具有一定效果。
PD-L1/PD-1是免疫負調節通路,參與了抑制性腫瘤微環境形成,進而幫助腫瘤獲得免疫逃逸,促進DLBCL的進展[12-14]。尹海兵等[15]采用免疫組化法檢測184例DLBCL組織內PD-L1及PD-1水平發現,PD-L1表達水平與患者臨床病理特征間存在一定的關系,其在CD30+DLBCL微環境細胞中的陽性表達率更高,且PD-L1高表達是患者預后不良的危險因素。但免疫組化法評估患者PD-L1表達水平存在一定的局限性,首先,局部病理組織活檢并不能代表整體,其次,抗體及免疫組化技術的不同也可能影響結果判讀。而血清學指標檢測更為方便,且可對病情進行動態監測。我院研究發現,R/R DLBCL患者血清sPD-L1水平顯著高于緩解DLBCL患者。
影響DLBCL患者預后的因素較多,包括患者年齡、體能狀態、腫瘤負荷、結外受累情況、侵襲性指標、Hans分型等。本文分析發現,合并結外病變的R/R DLBCL患者血清TTR及sPD-L1水平均高于無結外病變者,血清LDH升高者血清TTR及sPD-L1水平均高于LDH水平正常者。此外,分析不同病理特征對患者血清TTR及sPD-L1水平的影響發現,nGCB患者血清TTR及sPD-L1水平顯著高于GCB患者,C-MYC/BCL-2雙表達及C-MYC/BCL-2/BCL-6三表達患者血清TTR及sPD-L1均明顯高于其他表達狀況者,提示R/R DLBCL患者血清TTR及sPD-L1水平與其臨床特征及病理特征間均存在一定的關系。 此外,本研究根據R/R DLBCL患者血清平均TTR及sPD-L1水平,將其分別劃分為TTR高表達及低表達組,sPD-L1高表達及低表達組,繪制生存曲線發現,TTR高表達組生存時間顯著低于低表達組,同時,sPD-L1高表達組生存時間顯著高于低表達組。說明初次治療前血清TTR及sPD-L1高水平在提示患者不良預后中具有一定價值。
綜上所述,初次治療前血清TTR及sPD-L1水平可有效反映DLBCL患者治療效果及疾病進展,且在預測R/R DLBCL患者預后中也具有良好的價值。

