中國醫(yī)療機構(gòu)藥品目錄管理評價指南
陳慧 蘇廣全 劉曉 田方圓 管瀅蕓 陳婷婷 趙穎楠 劉琳琳 卞曉嵐 徐珽 李曉宇 沈愛宗 劉麗宏
中圖分類號 R95 文獻標志碼 A 文章編號 1001-0408(2022)06-0641-12
DOI 10.6039/j.issn.1001-0408.2022.06.01
摘 要 為提高我國醫(yī)療機構(gòu)藥品目錄的管理水平,幫助醫(yī)療機構(gòu)構(gòu)建用藥結(jié)構(gòu)合理、調(diào)整程序規(guī)范、操作應(yīng)用便捷、評價方法科學(xué)的醫(yī)療機構(gòu)藥品目錄,從而最大限度地滿足臨床的合理用藥需求。在中國藥學(xué)會藥學(xué)服務(wù)專業(yè)委員會的支持下,中日友好醫(yī)院和中國科學(xué)技術(shù)大學(xué)附屬第一醫(yī)院(安徽省立醫(yī)院)共同發(fā)起,聯(lián)合多家醫(yī)療機構(gòu)共同參與完成了《中國醫(yī)療機構(gòu)藥品目錄管理評價指南》。本指南制定工作組嚴格根據(jù)世界衛(wèi)生組織標準指南制定方法學(xué)要求,基于德爾菲法,從醫(yī)療機構(gòu)藥品目錄的組織管理、目錄結(jié)構(gòu)、目錄調(diào)整、目錄應(yīng)用及目錄評價5個維度構(gòu)建了醫(yī)療機構(gòu)藥品目錄管理評價指標體系及量化評分表,用于幫助醫(yī)療機構(gòu)對其藥品目錄管理質(zhì)量進行評價,以期為醫(yī)療機構(gòu)藥品目錄精細化管理發(fā)揮積極作用。
關(guān)鍵詞 醫(yī)療機構(gòu);藥品目錄;管理;質(zhì)量評價;指南
Guideline for the evaluation of medicine list in Chinese medical institutions
CHEN Hui1,SU Guangquan2,LIU Xiao3,TIAN Fangyuan4,GUAN Yingyun5,CHEN Tingting6,ZHAO Yingnan3,LIU Linlin7,BIAN Xiaolan5,XU Ting4,LI Xiaoyu6,SHEN Aizong7,LIU Lihong3(1. Dept. of Pharmacy, Beijing Chao-yang Hospital, Capital Medical University, Beijing 100020, China; 2. School of Pharmacy, Anhui University of Chinese Medicine, Hefei 230012, China; 3. Dept. of Pharmacy, China-Japan Friendship Hospital, Beijing 100029, China; 4. Dept. of Pharmacy, West China Hospital, Sichuan University, Chengdu 610041, China; 5. Dept. of Pharmacy, Ruijin Hospital, Shanghai Jiaotong University School of Medicine, Shanghai 200025, China; 6. Dept. of Pharmacy, Zhongshan Hospital, Fudan University,Shanghai 200032, China; 7. Dept. of Pharmacy, the First Affiliated Hospital of University of Science and Technology of China/Anhui Provincial Hospital, Hefei 230001, China)
ABSTRACT? ?In order to improve the management level of medicine list of medical institutions in China, and help medical institutions build a medicine list of medical institutions with reasonable drug use structure, standardized adjustment procedures, convenient operation and application and scientific evaluation methods, so as to meet the needs of clinical rational drug use to the greatest extent, with the support of the Pharmaceutical Care Professional Committee of the Chinese Pharmaceutical Association, China-Japan Friendship Hospital and the First Affiliated Hospital of University of Science and Technology of China (Anhui Provincial Hospital) jointly initiate and complete Guideline for the Evaluation of Medicine List in Chinese Medical Institutions jointly with a number of medical institutions. In strict accordance with the methodological requirements of World Health Organization standard guidelines, based on the Delphi method, the guideline formulation working group has constructed the quality evaluation index system and quantitative scoring table of medicine list management in medical institutions from the 5 dimensions of organization and management, structure, adjustment, application and evaluation of the list. It is used to help medical institutions evaluate the quality of their medicine list management, so as to play a positive role in the fine management of medicine list in medical institutions.
KEYWORDS? ?medical institution; medicine list; manage- ment; quality evaluation; guideline
自1977年頒布第1版《世界衛(wèi)生組織基本藥物示范目錄》(WHO Essential Medicines List,WHO-EML)以來,WHO每隔兩年都會根據(jù)全球疾病種類分布以及藥品安全性與有效性等方面的資料對該目錄進行更新。WHO-EML嚴謹科學(xué)的更新和推廣程序成為了各國和醫(yī)療機構(gòu)管理藥品目錄的參考范例[1]。
對于醫(yī)療機構(gòu)藥品目錄的管理,我國也出臺了較多的法律法規(guī)和政策文件,如:2011年出臺的《醫(yī)療機構(gòu)藥事管理規(guī)定》指出,醫(yī)療機構(gòu)藥事管理與藥物治療學(xué)委員會的職責(zé)之一是制訂本機構(gòu)藥品處方集和基本用藥供應(yīng)目錄[2];2012年頒布的《抗菌藥物臨床應(yīng)用管理辦法》和2015年頒布的《抗菌藥物臨床應(yīng)用指導(dǎo)原則(2015年版)》規(guī)定,醫(yī)療機構(gòu)應(yīng)當(dāng)嚴格制訂本機構(gòu)的抗菌藥物目錄,加強對抗菌藥物品種和品規(guī)數(shù)量的控制,并定期調(diào)整其結(jié)構(gòu)[3-4];2019年我國發(fā)布了《第一批國家重點監(jiān)控合理用藥藥品目錄(化藥及生物制品)》,并同時要求各級各類醫(yī)療機構(gòu)應(yīng)在省級重點監(jiān)控合理用藥藥品目錄的基礎(chǔ)上形成本機構(gòu)重點監(jiān)控藥品目錄[5];2020年發(fā)布的《關(guān)于加強醫(yī)療機構(gòu)藥事管理促進合理用藥的意見》要求醫(yī)療機構(gòu)依據(jù)安全、有效、經(jīng)濟的用藥原則和本機構(gòu)治療疾病的特點,及時優(yōu)化本機構(gòu)用藥目錄,形成科學(xué)合理的用藥結(jié)構(gòu)[6];同年發(fā)布的《抗腫瘤藥物臨床應(yīng)用管理辦法(試行)》規(guī)定,醫(yī)療機構(gòu)應(yīng)當(dāng)建立抗腫瘤藥物遴選和評估制度,根據(jù)本機構(gòu)疾病診療需求制訂抗腫瘤藥物供應(yīng)目錄并定期調(diào)整[7];2021年發(fā)布的《國家重點監(jiān)控合理用藥藥品目錄調(diào)整工作規(guī)程》又進一步加強了對國家重點監(jiān)控合理用藥藥品目錄的管理,使得國家重點監(jiān)控藥品目錄制訂調(diào)整工作更加科學(xué)合理[8]。上述一系列政策的發(fā)布均提示,制訂并管理好醫(yī)療機構(gòu)藥品目錄至關(guān)重要。盡管健康中國研究中心藥品與健康產(chǎn)品專家委員會聯(lián)合8家醫(yī)療組織曾在2020年共同發(fā)布了《中國醫(yī)療機構(gòu)藥品評價與遴選快速指南》[9],為我國醫(yī)療機構(gòu)目錄內(nèi)藥品的準入與調(diào)出提供了借鑒價值,但目前仍未建立統(tǒng)一的針對醫(yī)療機構(gòu)藥品目錄管理質(zhì)量的全方位評價標準,醫(yī)療機構(gòu)仍停留在自行遴選用藥、自我管理的階段,導(dǎo)致國家各類醫(yī)藥政策的落地效果不甚理想,不合理用藥現(xiàn)象仍令人擔(dān)憂。
為提高我國醫(yī)療機構(gòu)藥品目錄的管理水平,幫助醫(yī)療機構(gòu)構(gòu)建用藥結(jié)構(gòu)合理、調(diào)整程序規(guī)范、操作應(yīng)用便捷、評價方法科學(xué)的醫(yī)療機構(gòu)藥品目錄,從而最大限度地滿足臨床合理用藥的需求,有必要探索建立醫(yī)療機構(gòu)藥品目錄管理質(zhì)量的評價標準。2021年5月,在中國藥學(xué)會藥學(xué)服務(wù)專業(yè)委員會的支持下,中日友好醫(yī)院和中國科學(xué)技術(shù)大學(xué)附屬第一醫(yī)院(安徽省立醫(yī)院)共同發(fā)起,聯(lián)合首都醫(yī)科大學(xué)附屬北京朝陽醫(yī)院、上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院、四川大學(xué)華西醫(yī)院、復(fù)旦大學(xué)附屬中山醫(yī)院等多家醫(yī)療機構(gòu)共同參與完成了《中國醫(yī)療機構(gòu)藥品目錄管理評價指南》,以期為醫(yī)療機構(gòu)藥品目錄的精細化管理發(fā)揮積極作用。
1 指南制定背景和流程
本指南基于專家德爾菲法,嚴格根據(jù)WHO標準指南制訂方法學(xué)要求進行,并已在國際實踐指南注冊平臺進行注冊,注冊號為IPGRP-2021CN195。
1.1 指南工作組的組成及職責(zé)
指南工作組由專家指導(dǎo)組、專家組、秘書組和外審組組成。專家指導(dǎo)組由具有豐富指南制定經(jīng)驗的高級職稱專家組成,主要職責(zé)是為指南確定主題和范圍、管理審核利益聲明、批準指南計劃書、監(jiān)督指南制定流程、批準推薦意見等。專家組為指南評價標準的制定提供意見,對于沒有確切證據(jù)的問題或有爭議的問題通過德爾菲法達成共識,并參與指南的起草和修訂工作。秘書組負責(zé)系統(tǒng)地檢索已有的臨床證據(jù)、系統(tǒng)綜述并提交給專家組參考、詳細記錄指南的制定過程、參與撰寫指南初稿等。外審組則由對本指南主題感興趣的人員及在指南制定過程中可能涉及的全環(huán)節(jié)工作人員構(gòu)成,其不直接參與指南制定,而在前期負責(zé)評審指南的評價范圍和相關(guān)問題,后期負責(zé)評審指南定稿文件。
1.2 指南相關(guān)證據(jù)的檢索與質(zhì)量評價
檢索內(nèi)容包括:醫(yī)療機構(gòu)藥品目錄、目錄管理、目錄結(jié)構(gòu)、目錄調(diào)整、目錄應(yīng)用、目錄評價等。
檢索文獻類型包括:(1)指南、共識;(2)由衛(wèi)生行政部門、行業(yè)協(xié)會、學(xué)術(shù)組織或科研機構(gòu)發(fā)布的文件;(3)各數(shù)據(jù)庫收錄的研究文獻及綜述。語種僅限中、英文。排除重復(fù)發(fā)表或原文無法獲取的文獻。
檢索范圍包括:(1)萬方數(shù)據(jù)、維普網(wǎng)、中國生物醫(yī)學(xué)文獻服務(wù)系統(tǒng)、中國知網(wǎng)、PubMed、Cochrane圖書館等中、英文文獻數(shù)據(jù)庫;(2)國際指南協(xié)作網(wǎng)(Guidelines International Network,GIN)、TRIP指南數(shù)據(jù)庫等指南數(shù)據(jù)庫;(3)國家各衛(wèi)生行政部門、藥監(jiān)部門或相關(guān)行業(yè)協(xié)會的官方網(wǎng)站。檢索時間為2021年10月。
由于本指南的相關(guān)證據(jù)多為國家各部委發(fā)布的最新的醫(yī)藥類相關(guān)政策文件,因此不開展證據(jù)質(zhì)量評價。當(dāng)相關(guān)證據(jù)欠缺時,由專家組形成共識意見。
1.3 利益聲明
本指南工作組成員及所在單位與評價目標均無相關(guān)利益沖突。
2 指南適用范圍
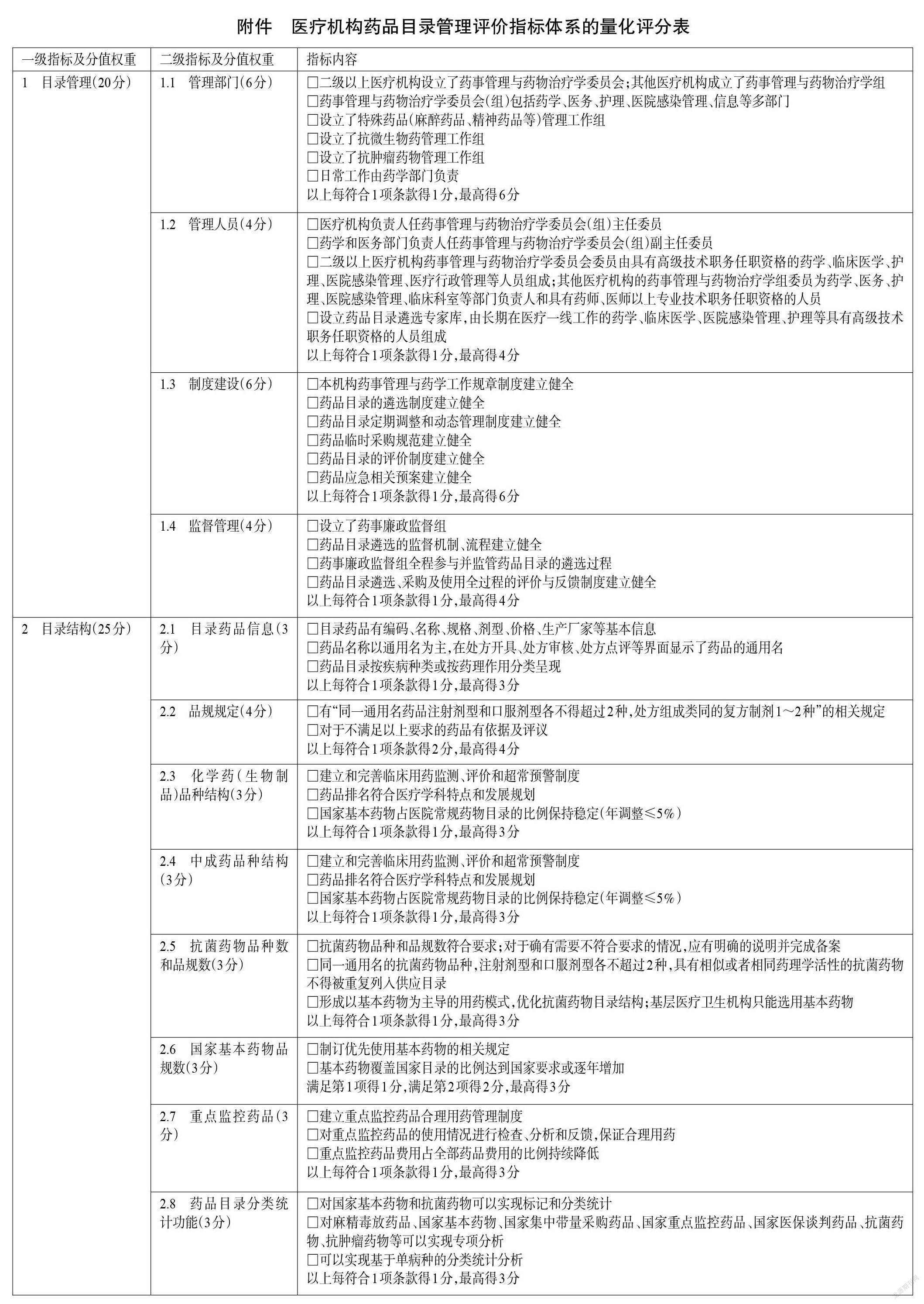
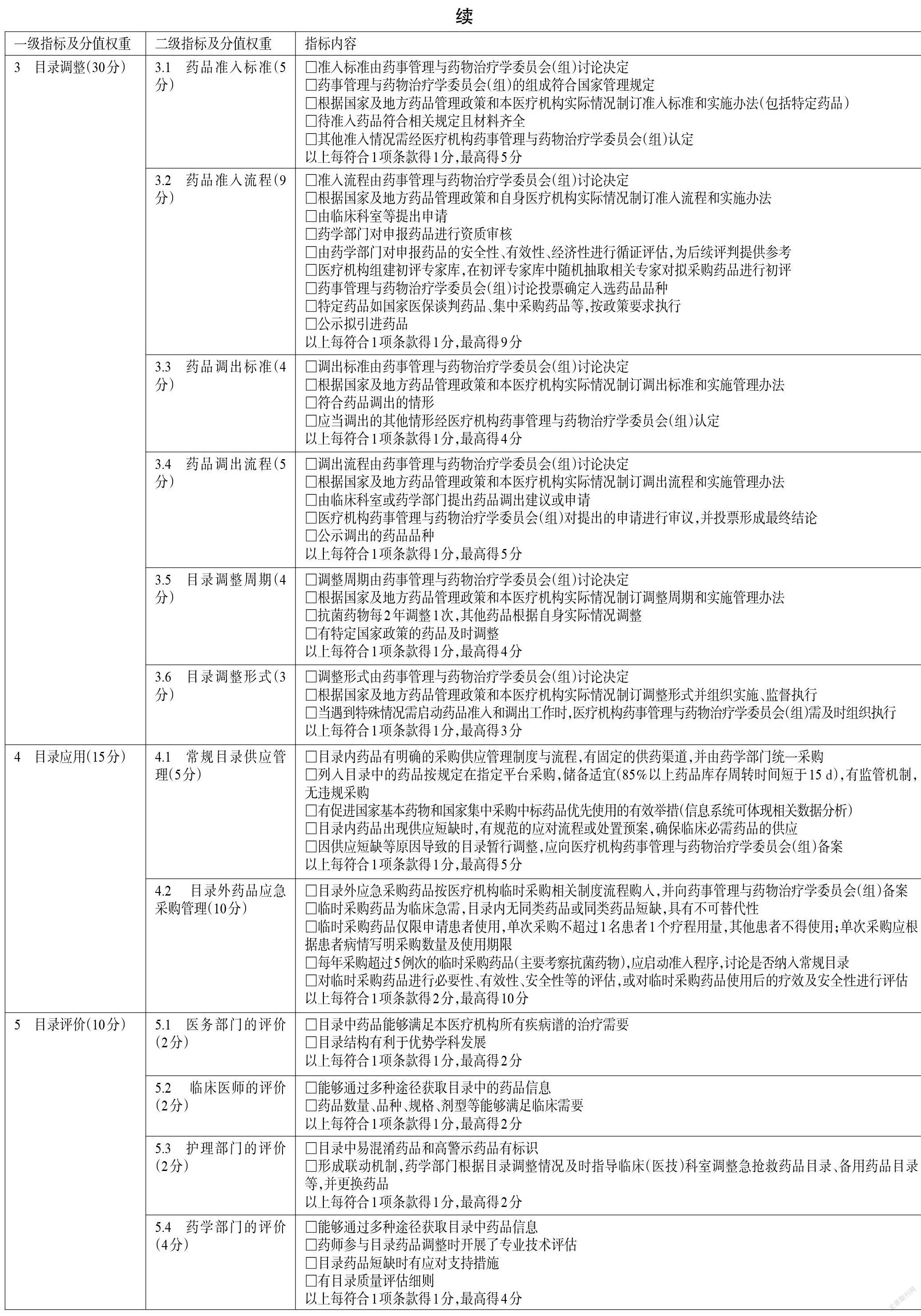
本指南是基于國家相關(guān)法律法規(guī)規(guī)定及當(dāng)前可獲得的最佳證據(jù)制定而成的,旨在為我國各級醫(yī)療機構(gòu)藥品目錄管理質(zhì)量的評價提供依據(jù)。因此,本指南主要適用于我國有藥品目錄管理需求的各級醫(yī)療機構(gòu)及各級衛(wèi)生管理部門,適用人群為各級醫(yī)療機構(gòu)及衛(wèi)生管理部門的管理人員、藥師、醫(yī)師、護師等相關(guān)醫(yī)務(wù)人員。指標體系量化評分表采用百分制,評分細則詳見附件。
該量化評分表的主要用途如下:(1)指標細則可為醫(yī)療機構(gòu)管理藥品目錄提供參考;(2)量化評分表的評分結(jié)果可用于評估醫(yī)療機構(gòu)藥品目錄的管理水平。一般情況下,醫(yī)療機構(gòu)自評得分低于60分為不及格,提示該醫(yī)療機構(gòu)藥品目錄管理工作亟需整改。
(說明:量化評分表已在參與指南制定的各家醫(yī)療機構(gòu)內(nèi)部進行過試運行,評價得分結(jié)果均較高。由于本指南制定期間所依據(jù)的相關(guān)政策在不斷調(diào)整變化,加之醫(yī)療機構(gòu)的自身情況各不相同,故各家醫(yī)療機構(gòu)的試運行得分并不具有普適性。因此,在使用本指南的過程中,各醫(yī)療機構(gòu)可側(cè)重于自身目錄管理質(zhì)量進行縱向動態(tài)提升,或者依據(jù)實際情況對本指標細則及權(quán)重作出適當(dāng)調(diào)整。)
3 評價維度、指標、目的及內(nèi)容
3.1 目錄管理
3.1.1 管理部門
評價目的包括:評價醫(yī)療機構(gòu)藥品目錄管理評價的部門建設(shè)是否健全,藥事管理與藥物治療學(xué)委員會(組)的相關(guān)制度是否落實,是否具有藥品目錄遴選及日常管理的負責(zé)部門。
《醫(yī)療機構(gòu)藥事管理規(guī)定》指出,“二級以上醫(yī)院應(yīng)當(dāng)設(shè)立藥事管理與藥物治療學(xué)委員會;其他醫(yī)療機構(gòu)應(yīng)當(dāng)成立藥事管理與藥物治療學(xué)組”[2]。基于上述政策要求,本條目的主要評價內(nèi)容包括:(1)二級以上醫(yī)療機構(gòu)是否設(shè)立了藥事管理與藥物治療學(xué)委員會,其他醫(yī)療機構(gòu)是否成立了藥事管理與藥物治療學(xué)組;(2)藥事管理與藥物治療學(xué)委員會(組)是否包括了藥學(xué)、醫(yī)務(wù)、護理、醫(yī)院感染管理、信息等多部門;(3)是否設(shè)立了特殊藥品(麻醉藥品、精神藥品等)管理工作組,負責(zé)特殊藥品目錄遴選的相關(guān)工作;(4)是否設(shè)立了抗微生物藥管理工作組,負責(zé)抗微生物藥目錄遴選的相關(guān)工作;(5)是否設(shè)立了抗腫瘤藥物管理工作組,負責(zé)抗腫瘤藥物目錄遴選的相關(guān)工作;(6)日常工作是否由藥學(xué)部門負責(zé)[2,10]。
3.1.2 管理人員
評價目的包括:評價醫(yī)療機構(gòu)藥事管理與藥物治療學(xué)委員會(組)主任委員、副主任委員及委員的組成及資質(zhì)是否符合要求;評價藥品目錄遴選專家組專家的組成及資質(zhì)是否符合要求。
本條目的主要評價內(nèi)容包括:(1)醫(yī)療機構(gòu)負責(zé)人是否擔(dān)任藥事管理與藥物治療學(xué)委員會(組)主任委員,藥學(xué)和醫(yī)務(wù)部門負責(zé)人是否擔(dān)任藥事管理與藥物治療學(xué)委員會(組)副主任委員。(2)二級以上醫(yī)療機構(gòu)的藥事管理與藥物治療學(xué)委員會委員是否由具有高級技術(shù)職務(wù)任職資格的藥學(xué)、臨床醫(yī)學(xué)、護理、醫(yī)院感染管理、醫(yī)療行政管理等人員組成;其他醫(yī)療機構(gòu)的藥事管理與藥物治療學(xué)組委員是否為該醫(yī)療機構(gòu)藥學(xué)、醫(yī)務(wù)、護理、醫(yī)院感染管理、臨床科室等部門負責(zé)人和具有藥師、醫(yī)師以上專業(yè)技術(shù)職務(wù)任職資格的人員。(3)醫(yī)療機構(gòu)是否建立了由長期在醫(yī)療一線工作的藥學(xué)、臨床醫(yī)學(xué)、醫(yī)院感染管理、護理等專業(yè)的具有高級技術(shù)職務(wù)任職資格人員組成的藥品目錄遴選專家?guī)靃2,11]。
3.1.3 制度建設(shè)
評價目的包括:評價醫(yī)療機構(gòu)藥事管理與藥物治療學(xué)委員會(組)的制度建設(shè)以及藥品目錄的遴選情況,是否定期調(diào)整和動態(tài)管理制度建設(shè)。
《醫(yī)療機構(gòu)藥事管理規(guī)定》指出,藥事管理與藥物治療學(xué)委員會(組)應(yīng)當(dāng)建立健全相應(yīng)工作制度,并由藥學(xué)部門負責(zé)日常工作[2]。基于上述政策要求,本條目的主要評價內(nèi)容包括:(1)本機構(gòu)藥事管理與藥學(xué)工作規(guī)章制度是否建立健全,且相關(guān)規(guī)章制度是否由藥事管理與藥物治療學(xué)委員會(組)監(jiān)督實施;(2)藥品目錄的遴選制度是否建立健全,包括新藥引進、品種增補和替換及藥品淘汰等的原則、范圍、方法和程序,并形成制度規(guī)范;(3)藥品目錄定期調(diào)整和動態(tài)管理制度是否建立健全;(4)藥品臨時采購規(guī)范是否建立健全,基本用藥供應(yīng)外的藥品是否按臨時采購規(guī)范采購;(5)藥品目錄的評價制度(如合理用藥點評制度等)是否建立健全;(6)藥品應(yīng)急相關(guān)預(yù)案是否建立健全,如易燃易爆危險藥品安全應(yīng)急預(yù)案、麻醉藥品/精神藥品/醫(yī)療用毒性藥品/放射性藥品(以下簡稱“麻精毒放藥品”)防丟失應(yīng)急預(yù)案、急救藥品保障應(yīng)急預(yù)案、突發(fā)公共衛(wèi)生事件藥品保障應(yīng)急預(yù)案等[2,10-11]。
3.1.4 監(jiān)督管理
評價目的包括:評價醫(yī)療機構(gòu)的藥品目錄監(jiān)督管理部門建設(shè)及制度建設(shè)是否健全。
《醫(yī)療機構(gòu)藥事管理規(guī)定》指出,醫(yī)療機構(gòu)藥事管理與藥物治療學(xué)委員會(組)負責(zé)藥品目錄相關(guān)制度的制訂并監(jiān)督實施[2]。基于上述政策要求,本條目的主要評價內(nèi)容為藥品目錄的監(jiān)督管理事項,包括:(1)醫(yī)療機構(gòu)是否設(shè)立了由專職紀檢人員組成的藥事廉政監(jiān)督組;(2)藥品目錄遴選的監(jiān)督制度、流程是否建立健全,并嚴格按此實施;(3)藥事廉政監(jiān)督組是否全程參與并監(jiān)管藥品目錄的遴選過程;(4)藥品目錄遴選、采購及使用全過程的評價與反饋制度是否建立健全,是否有合理且暢通的接受藥品目錄制訂及使用相關(guān)建議和意見的途徑,并有有效的解決和反饋措施[12]。
3.2 目錄結(jié)構(gòu)
3.2.1 目錄藥品信息
評價目的包括:評價醫(yī)療機構(gòu)信息系統(tǒng)中的藥品相關(guān)數(shù)據(jù)是否規(guī)范、完整,是否有助于藥品識別,是否能保證后續(xù)藥品采購、出入庫、處方開具、審核、收費、調(diào)劑、發(fā)藥等一系列運行數(shù)據(jù)的標準化和再利用。
根據(jù)醫(yī)療機構(gòu)藥品目錄的核心功能,醫(yī)療機構(gòu)信息系統(tǒng)中的藥品相關(guān)數(shù)據(jù)應(yīng)支持藥品采購、儲存、調(diào)配和使用,故上述相關(guān)數(shù)據(jù)應(yīng)至少包括藥品編碼、名稱、規(guī)格、劑型、包裝、價格、生產(chǎn)廠家等基本信息;同時,醫(yī)療機構(gòu)信息系統(tǒng)應(yīng)支持藥品醫(yī)囑安全、合理、合規(guī)地開具和支付,醫(yī)師開具處方應(yīng)當(dāng)使用經(jīng)藥品監(jiān)管部門批準并公布的藥品通用名、新活性化合物的專利藥品名稱和復(fù)方制劑藥品名稱。此外,醫(yī)療機構(gòu)藥品目錄應(yīng)有適宜的分類和層級架構(gòu),以幫助醫(yī)務(wù)人員更準確、高效地選用藥品。分類方式可按疾病分類,也可按藥理作用分類等[13],也可同時使用管理等級、藥物劑型、給藥途徑等多種方式。基于上述政策要求,本條目的評價內(nèi)容包括:(1)目錄藥品是否有編碼、名稱、規(guī)格、劑型、價格、生產(chǎn)廠家等基本信息;(2)藥品名稱是否以通用名為主,在處方開具、處方審核、處方點評等界面是否顯示了藥品的通用名;(3)藥品目錄是否按疾病種類或按藥理作用分類呈現(xiàn)。
3.2.2 品規(guī)規(guī)定
評價目的:評價醫(yī)療機構(gòu)是否落實有關(guān)品規(guī)的政策要求。
醫(yī)療機構(gòu)應(yīng)當(dāng)按照經(jīng)藥品監(jiān)管部門批準并公布的藥品通用名購進藥品。同一通用名藥品的品種,注射劑型和口服劑型各不得超過2種,處方組成類同的復(fù)方制劑1~2種[14]。這樣的政策限定是為了減少易混淆藥品的品規(guī),從源頭上避免藥品調(diào)劑和使用過程中可能出現(xiàn)的差錯;同時,該政策限定在保障醫(yī)療質(zhì)量與安全、控制醫(yī)藥費用不合理增長等方面亦具有積極意義。而在臨床實際工作中,由于診療的復(fù)雜性,對于醫(yī)療機構(gòu)確有配備多個品規(guī)需要的(如溶媒、胰島素、兒童制劑等),應(yīng)對其必要性和潛在風(fēng)險進行評估[14]。基于上述政策要求,本條目的評價內(nèi)容包括:(1)醫(yī)療機構(gòu)是否有“同一通用名藥品注射劑型和口服劑型各不得超過2種,處方組成類同的復(fù)方制劑1~2種”的相關(guān)規(guī)定;(2)對于不滿足以上要求的藥品是否有依據(jù)及評議。
3.2.3 化學(xué)藥(生物制品)品種結(jié)構(gòu)
評價目的包括:評價醫(yī)療機構(gòu)化學(xué)藥(生物制品)品種結(jié)構(gòu)是否落實政策法規(guī)要求,是否符合自身醫(yī)療學(xué)科特點及發(fā)展規(guī)劃。
醫(yī)療機構(gòu)要建立和完善臨床用藥監(jiān)測、評價和超常預(yù)警制度,對藥物臨床使用的安全性、有效性和經(jīng)濟性進行監(jiān)測、分析、評估;并通過持續(xù)、有效、常態(tài)化的合理用藥管理來保證藥品排名與各醫(yī)療機構(gòu)醫(yī)療特點及發(fā)展規(guī)劃相符。各級醫(yī)療機構(gòu)應(yīng)形成以基本藥物為主導(dǎo)的“1+X”用藥模式(“1”為國家基本藥物目錄、“X”為非基本藥物,由各地根據(jù)實際確定)。基本藥物品種占醫(yī)院常規(guī)品種的比例可體現(xiàn)醫(yī)療機構(gòu)在基本醫(yī)療與創(chuàng)新和個體化醫(yī)療之間的取舍與權(quán)衡[15-16]。基于上述政策要求,本條目的主要評價內(nèi)容包括:(1)醫(yī)療機構(gòu)是否建立和完善了臨床用藥監(jiān)測、評價和超常預(yù)警制度;(2)藥品排名是否符合醫(yī)療學(xué)科特點和發(fā)展規(guī)劃;(3)國家基本藥物占醫(yī)院常規(guī)藥物目錄的比例是否保持穩(wěn)定(年調(diào)整≤5%)。
3.2.4 中成藥品種結(jié)構(gòu)
評價目的包括:評價醫(yī)療機構(gòu)中成藥品種結(jié)構(gòu)是否落實法規(guī)政策要求,是否建立和完善臨床用藥監(jiān)測、評價和超常預(yù)警制度,中成藥的使用排名是否符合中醫(yī)學(xué)科特點和發(fā)展規(guī)劃,配備的中成藥國家基本藥物占醫(yī)院中成藥常規(guī)藥物目錄的比例是否保持穩(wěn)定。
中醫(yī)學(xué)科有獨立的疾病診斷體系和藥物治療理念。《國家基本藥物目錄(2018年版)》分為化學(xué)藥和生物制品、中成藥、中藥飲片3個部分。因此,本指南關(guān)于目錄結(jié)構(gòu)的評價也采取相應(yīng)的策略,將化學(xué)藥(生物制品)與中成藥分組分析。本條目對中成藥品種結(jié)構(gòu)的具體評價內(nèi)容與化學(xué)藥(生物制品)保持一致。
3.2.5 抗菌藥物品種結(jié)構(gòu)
評價目的:評價醫(yī)療機構(gòu)藥品目錄中的抗菌藥物品種數(shù)與品規(guī)數(shù)是否符合政策要求。
醫(yī)療機構(gòu)應(yīng)嚴格控制抗菌藥物購用品種、品規(guī)數(shù),保障抗菌藥物購用品種、品規(guī)結(jié)構(gòu)合理。根據(jù)相關(guān)管理規(guī)定,三級綜合醫(yī)院抗菌藥物品種原則上不超過50種,二級綜合醫(yī)院抗菌藥物品種原則上不超過35種;口腔醫(yī)院抗菌藥物品種原則上不超過35種,腫瘤醫(yī)院抗菌藥物品種原則上不超過35種,兒童醫(yī)院抗菌藥物品種原則上不超過50種,精神病醫(yī)院抗菌藥物品種原則上不超過10種,婦產(chǎn)醫(yī)院(含婦幼保健院)抗菌藥物品種原則上不超過40種。同一通用名注射劑型和口服劑型各不超過2種,具有相似或者相同藥理學(xué)特征的抗菌藥物不得重復(fù)采購。頭霉素類抗菌藥物不超過2個品規(guī);第三代及第四代頭孢菌素類抗菌藥物(含復(fù)方制劑)口服劑型不超過5個品規(guī),注射劑型不超過8個品規(guī);碳青霉烯類抗菌藥物注射劑型不超過3個品規(guī);氟喹諾酮類抗菌藥物口服劑型和注射劑型各不超過4個品規(guī);深部抗真菌類抗菌藥物不超過5個品種。對于確因臨床工作需要,抗菌藥物品種和品規(guī)數(shù)超過規(guī)定的,應(yīng)當(dāng)向核發(fā)《醫(yī)療機構(gòu)執(zhí)業(yè)許可證》的衛(wèi)生行政部門詳細說明;若說明不充分或者理由不成立的,衛(wèi)生行政部門不得接受其抗菌藥物品種和品規(guī)數(shù)的備案。同時,醫(yī)療機構(gòu)要對抗菌藥物供應(yīng)目錄進行科學(xué)合理的動態(tài)調(diào)整,及時將臨床效果確切、經(jīng)濟性好、安全風(fēng)險低的藥品納入供應(yīng)目錄,逐步淘汰藥效及藥動學(xué)特性差、不良反應(yīng)多和循證醫(yī)學(xué)證據(jù)不足的藥品,形成以基本藥物為主導(dǎo)的“1+X”用藥模式,合理優(yōu)化抗菌藥物供應(yīng)目錄。基層醫(yī)療衛(wèi)生機構(gòu)只能選用基本藥物[包括各省(區(qū)、市)增補品種]中的抗菌藥物品種[17-20]。基于上述政策要求,本條目的評價內(nèi)容包括:(1)抗菌藥物品種和品規(guī)數(shù)是否符合要求;對于確有不符合要求的情況,是否有明確的說明并完成了備案。(2)同一通用名的抗菌藥物品種,注射劑型和口服劑型是否各超過2種;具有相似或者相同藥理學(xué)活性的抗菌藥物是否被重復(fù)列入供應(yīng)目錄。(3)是否形成了以基本藥物為主導(dǎo)的用藥模式;是否優(yōu)化了抗菌藥物目錄結(jié)構(gòu);基層醫(yī)療衛(wèi)生機構(gòu)是否只選用了基本藥物。
3.2.6 國家基本藥物品規(guī)數(shù)
評價目的:評價醫(yī)療機構(gòu)藥品目錄中的國家基本藥物品規(guī)數(shù)是否符合國家政策要求。
基本藥物是適應(yīng)基本醫(yī)療衛(wèi)生需求,劑型適宜、價格合理,能夠保障供應(yīng)且公眾可公平獲得的藥品[21]。建立國家基本藥物制度是黨中央、國務(wù)院為維護人民健康、保障公眾基本用藥權(quán)益實施的一項惠民工程,是醫(yī)藥衛(wèi)生領(lǐng)域重大的體制機制改革,對保證基本藥物的足額供應(yīng)和合理使用、改革醫(yī)療機構(gòu)“以藥補醫(yī)”機制、減輕群眾基本用藥負擔(dān)具有重要意義,也是促進藥品生產(chǎn)流通企業(yè)資源進一步優(yōu)化和整合的重要途徑[22]。《國務(wù)院辦公廳關(guān)于進一步做好短缺藥品保供穩(wěn)價工作的意見》指出,“通過加強用藥監(jiān)管和考核、指導(dǎo)督促醫(yī)療機構(gòu)優(yōu)化用藥目錄和藥品處方集等措施,促進基本藥物優(yōu)先配備使用,提升基本藥物使用占比,并及時調(diào)整國家基本藥物目錄,逐步實現(xiàn)政府辦基層醫(yī)療衛(wèi)生機構(gòu)、二級公立醫(yī)院、三級公立醫(yī)院基本藥物配備品種數(shù)占比原則上分別不低于90%、80%、60%”[16]。基于上述政策要求,本條目的評價內(nèi)容包括:(1)醫(yī)療機構(gòu)是否制訂了優(yōu)先使用基本藥物的相關(guān)規(guī)定;(2)醫(yī)療機構(gòu)基本藥物覆蓋國家目錄的比例是否達到國家要求或逐年增加。
3.2.7 重點監(jiān)控藥品
評價目的:評價醫(yī)療機構(gòu)是否加強了對重點監(jiān)控藥品的臨床應(yīng)用規(guī)范化管理。
根據(jù)相關(guān)管理規(guī)定,醫(yī)療機構(gòu)要建立重點監(jiān)控藥品管理制度,加強對重點監(jiān)控藥品目錄內(nèi)藥品臨床應(yīng)用的全程管理。醫(yī)療機構(gòu)要進一步規(guī)范醫(yī)師處方行為,對納入重點監(jiān)控藥品目錄的藥品制訂用藥指南或技術(shù)規(guī)范,明確規(guī)定臨床應(yīng)用的條件和原則;已有相關(guān)用藥指南或指導(dǎo)原則的,要嚴格按照指南或原則執(zhí)行。對納入目錄中的全部藥品開展處方審核和處方點評,加強處方點評結(jié)果的公示、反饋及利用。對用藥不合理問題突出的品種,采取排名通報、限期整改、清除出本機構(gòu)藥品供應(yīng)目錄等措施,保證合理用藥[5]。基于上述政策要求,本條目的評價內(nèi)容包括:(1)醫(yī)療機構(gòu)是否建立了重點監(jiān)控藥品合理用藥管理制度;(2)是否對重點監(jiān)控藥品使用情況進行了檢查、分析和反饋,保證合理用藥;(3)重點監(jiān)控藥品費用占全部藥品費用的比例是否持續(xù)降低。
3.2.8 藥品目錄分類統(tǒng)計功能
評價目的:評價醫(yī)療機構(gòu)信息系統(tǒng)是否支持藥品的分類分析。
按照相關(guān)文件要求,醫(yī)療機構(gòu)應(yīng)對麻精毒放藥品、國家基本藥物、國家集中帶量采購中標藥品、國家醫(yī)保談判藥品、國家重點監(jiān)控藥品、抗菌藥物、抗腫瘤藥物等品種進行監(jiān)測和臨床應(yīng)用管理[22-25]。不僅全國醫(yī)療機構(gòu)及全國基層醫(yī)療衛(wèi)生機構(gòu)信息化建設(shè)標準與規(guī)范均要求醫(yī)療機構(gòu)對其國家基本藥物和抗菌藥物的使用情況進行分析[26-27],而且國家衛(wèi)生健康委也要求全國醫(yī)療機構(gòu)上報基本藥物、抗菌藥物及單病種治療藥物占比等指標數(shù)據(jù)[28];與此同時,2020年新發(fā)布的《三級醫(yī)院評審標準(2020年版)實施細則》也將住院患者靜脈輸液使用率、住院患者中藥注射劑靜脈輸液使用率、急診患者糖皮質(zhì)激素靜脈輸液使用率、住院患者質(zhì)子泵抑制劑注射劑靜脈使用率等納入了藥事管理專業(yè)醫(yī)療質(zhì)量控制指標[10]。基于上述政策要求,本條目的主要評價內(nèi)容包括:(1)醫(yī)療機構(gòu)信息系統(tǒng)是否可以實現(xiàn)對國家基本藥物和抗菌藥物的標記和分類統(tǒng)計;(2)對麻精毒放藥品、國家基本藥物、國家集中帶量采購藥品、國家重點監(jiān)控藥品、國家醫(yī)保談判藥品、抗菌藥物、抗腫瘤藥物等是否可以實現(xiàn)專項分析;(3)是否可以實現(xiàn)基于單病種的分類統(tǒng)計分析。
3.3 目錄調(diào)整
3.3.1 藥品準入標準
評價目的包括:評價醫(yī)療機構(gòu)藥品目錄準入標準是否符合國家及地方藥品管理相關(guān)政策要求,是否符合本醫(yī)療機構(gòu)診療范圍及臨床治療需求。
本條目的主要評價內(nèi)容包括:(1)藥品準入標準是否由醫(yī)療機構(gòu)藥事管理與藥物治療學(xué)委員會(組)討論決定。(2)藥事管理與藥物治療學(xué)委員會(組)的組成是否符合國家相關(guān)管理規(guī)定。(3)醫(yī)療機構(gòu)是否根據(jù)國家及地方藥品管理政策和本機構(gòu)實際情況制訂藥品準入標準和實施管理辦法,如藥品醫(yī)保屬性、是否屬于基本藥物、是否符合“一品雙規(guī)”等準入的基本原則[6]。對于國家有特別規(guī)定的藥品,如抗菌藥物、抗腫瘤藥物、國家醫(yī)保談判藥品、國家集中采購藥品等,是否符合國家藥品準入相關(guān)政策規(guī)定。如對于國家醫(yī)保談判藥品,醫(yī)療機構(gòu)應(yīng)根據(jù)功能定位、臨床需求和診療能力等及時配備,且準入流程應(yīng)按要求統(tǒng)一實施。(4)準入藥品是否按照安全、有效、經(jīng)濟、適宜的原則,即是否充分考慮藥品安全性和臨床治療效果,并兼顧了藥品價格,以滿足本醫(yī)療機構(gòu)就診人群的需要。待準入藥品是否符合國家相關(guān)規(guī)定并提供了所有資質(zhì)材料,如藥品生產(chǎn)企業(yè)營業(yè)執(zhí)照、藥品生產(chǎn)許可證、藥品生產(chǎn)質(zhì)量管理規(guī)范(good manufacturing practice of medical products,GMP)證書、藥品注冊批件、質(zhì)檢報告等。(5)其他準入情況是否經(jīng)過醫(yī)療機構(gòu)藥事管理與藥物治療學(xué)委員會(組)的認定。
3.3.2 藥品準入流程
評價目的包括:評價藥品準入流程是否符合國家及地方藥品管理相關(guān)政策要求,是否經(jīng)集體決策,是否公正透明。
本條目的主要評價內(nèi)容包括:(1)藥品準入流程是否由醫(yī)療機構(gòu)藥事管理與藥物治療學(xué)委員會(組)討論決定。(2)醫(yī)療機構(gòu)應(yīng)根據(jù)國家及地方藥品管理政策和本機構(gòu)實際情況制訂本機構(gòu)的藥品準入流程和實施管理辦法。(3)藥品準入流程是否包括以下環(huán)節(jié)——①由臨床科室等提出申請;②藥學(xué)部門對申報藥品的資質(zhì)進行審核,如營業(yè)執(zhí)照、藥品經(jīng)營許可證、GMP證書、質(zhì)檢報告、臨床研究報告以及其他可以證明該藥品優(yōu)勢的文件資料;③藥學(xué)部門對申報藥品的安全性、有效性、經(jīng)濟性進行循證評估,并依據(jù)循證評估結(jié)果形成初步的推薦意見供初評專家及藥事管理與藥物治療學(xué)委員會(組)參考;④醫(yī)療機構(gòu)組建初評專家?guī)欤诔踉u專家?guī)熘须S機抽取相關(guān)專家對擬采購藥品進行初評并提出意見;⑤藥事管理與藥物治療學(xué)委員會(組)舉行會議,結(jié)合前期初評意見和相關(guān)資料對申報藥品進行討論,投票確定入選藥品品種,并公示擬引進藥品。(4)對于國家醫(yī)保談判藥品、集中采購藥品等是否按國家政策要求執(zhí)行[28]。
3.3.3 藥品調(diào)出標準
評價目的包括:評價醫(yī)療機構(gòu)藥品目錄調(diào)出標準是否符合國家及地方藥品管理相關(guān)政策要求,是否符合本醫(yī)療機構(gòu)診療范圍及臨床治療需求。
本條目的主要評價內(nèi)容包括:(1)藥品調(diào)出標準是否由醫(yī)療機構(gòu)藥事管理與藥物治療學(xué)委員會(組)討論決定。(2)醫(yī)療機構(gòu)是否根據(jù)國家及地方藥品管理政策和本機構(gòu)實際情況制訂藥品調(diào)出標準和實施管理辦法。(3)藥品調(diào)出是否符合以下情形——①國家藥品監(jiān)管部門撤銷其藥品批準證明文件的或藥品標準被取消的;②發(fā)生嚴重不良反應(yīng),經(jīng)評估不宜再在臨床使用的;③根據(jù)藥品臨床綜合評價結(jié)果,可被風(fēng)險效益比或成本效益比更優(yōu)的品種所替代的;④其他特殊情形,如醫(yī)保屬性發(fā)生變化、不合理用藥情況突出、進入重點監(jiān)控藥品目錄、存在廉政問題等[29]。(4)其他調(diào)出情況是否經(jīng)過醫(yī)療機構(gòu)藥事管理與藥物治療學(xué)會(組)認定。
3.3.4 藥品調(diào)出流程
評價目的包括:評價藥品調(diào)出流程是否符合國家及地方藥品管理相關(guān)政策要求,是否經(jīng)集體決策,是否公正透明。
本條目的主要評價內(nèi)容包括:(1)藥品調(diào)出流程是否由醫(yī)療機構(gòu)藥事管理與藥物治療學(xué)委員會(組)討論決定。(2)醫(yī)療機構(gòu)是否根據(jù)國家及地方藥品管理政策和本醫(yī)療機構(gòu)實際情況制訂調(diào)出流程和實施管理辦法。(3)藥品調(diào)出流程是否包括以下環(huán)節(jié)——①由臨床科室或藥學(xué)部門向藥事管理與藥物治療學(xué)委員會(組)提出藥品調(diào)出建議或申請,并提供相關(guān)證明材料;②藥事管理與藥物治療學(xué)委員會(組)進行審議,并投票形成最終結(jié)論;③對藥品調(diào)出相關(guān)決議進行公示[6]。
3.3.5 目錄調(diào)整周期
評價目的包括:評價目錄調(diào)整周期是否符合國家及地方的藥品管理相關(guān)政策,是否符合本醫(yī)療機構(gòu)相關(guān)管理規(guī)定或臨床藥物治療需求。
本條目的主要評價內(nèi)容包括:(1)藥品目錄調(diào)整周期是否由醫(yī)療機構(gòu)藥事管理與藥物治療學(xué)委員會(組)討論決定;(2)醫(yī)療機構(gòu)是否根據(jù)國家及地方藥品管理政策和本醫(yī)療機構(gòu)實際情況制訂調(diào)整周期和實施管理辦法;(3)目錄調(diào)整周期的制訂是否符合國家及地方的藥品管理規(guī)定,如抗菌藥物每2年調(diào)整1次,其他藥品由醫(yī)療機構(gòu)根據(jù)自身實際情況制訂合適的調(diào)整周期[20];(4)有特定國家政策的藥品(如國家醫(yī)保談判藥品、集中采購藥品等)是否及時啟動調(diào)整,并在規(guī)定時間(如藥品政策發(fā)生重大改變、基本藥物目錄發(fā)布、醫(yī)保藥物目錄變更等)及時啟動調(diào)整[30]。
3.3.6 目錄調(diào)整形式
評價目的:評價目錄調(diào)整形式是否符合國家及地方藥品管理相關(guān)政策要求。
本條目的主要評價內(nèi)容包括:(1)藥品目錄調(diào)整形式是否由醫(yī)療機構(gòu)藥事管理與藥物治療學(xué)委員會(組)討論決定;(2)藥事管理與藥物治療學(xué)委員會(組)是否根據(jù)國家及地方藥品管理政策和本醫(yī)療機構(gòu)實際情況制訂藥品準入、調(diào)出的各項標準和流程,并組織實施、監(jiān)督執(zhí)行;(3)當(dāng)遇到特殊情況需啟動藥品準入和調(diào)出工作時,藥事管理與藥物治療學(xué)委員會(組)是否及時組織執(zhí)行[6]。
3.4 目錄應(yīng)用
3.4.1 常規(guī)目錄供應(yīng)管理
評價目的:評價醫(yī)療機構(gòu)藥品目錄內(nèi)藥品的供應(yīng)管理情況,以促進醫(yī)療機構(gòu)藥品的規(guī)范供應(yīng)和合理使用,切實保障臨床治療需求。
根據(jù)相關(guān)規(guī)定,醫(yī)療機構(gòu)應(yīng)當(dāng)制訂藥品采購工作流程,嚴格執(zhí)行藥品購入檢查、驗收制度,不得購入和使用不符合規(guī)定的藥品[2]。醫(yī)療機構(gòu)必須通過各省(區(qū)、市)政府建立的非營利性藥品集中采購平臺開展采購,實行統(tǒng)一組織、統(tǒng)一平臺和統(tǒng)一監(jiān)管[31]。醫(yī)療機構(gòu)不僅應(yīng)將基本藥物和國家集中采購中標藥品納入藥品目錄,而且應(yīng)有相應(yīng)措施促進基本藥物和國家集中采購中標藥品的規(guī)范使用,以保障人民群眾用藥的基本需求。醫(yī)療機構(gòu)應(yīng)對發(fā)生或預(yù)計可能發(fā)生短缺的藥品開展信息評估、替代藥品遴選,并規(guī)范替代藥品的使用;可根據(jù)短缺藥品分類分級情況,組織相關(guān)專業(yè)人員遴選替代藥品,若替代藥品不在醫(yī)療機構(gòu)藥品目錄內(nèi),藥事管理與藥物治療學(xué)委員會(組)應(yīng)根據(jù)本醫(yī)療機構(gòu)相關(guān)規(guī)定啟動應(yīng)急采購,當(dāng)短缺藥品恢復(fù)正常供應(yīng)后,應(yīng)當(dāng)提出替代藥品處置方案,并上報醫(yī)療機構(gòu)藥事管理與藥物治療學(xué)委員會(組)備案[32-33]。基于上述政策要求,本條目的評價內(nèi)容包括:(1)目錄內(nèi)藥品是否有明確的采購供應(yīng)管理制度與流程,是否有固定的供藥渠道,是否由藥學(xué)部門統(tǒng)一采購;(2)列入目錄的藥品是否按規(guī)定在指定平臺采購,是否儲備適宜(85%以上藥品的庫存周轉(zhuǎn)時間短于15 d),是否有監(jiān)管機制,有無違規(guī)采購;(3)醫(yī)療機構(gòu)是否采取各種有效措施促進國家基本藥物和國家集中采購中標藥品的優(yōu)先使用;(4)目錄內(nèi)藥品出現(xiàn)供應(yīng)短缺時,是否有規(guī)范的應(yīng)對流程或處置預(yù)案以確保臨床必需藥品的供應(yīng);(5)因供應(yīng)短缺等原因?qū)е碌哪夸洉盒姓{(diào)整,是否向醫(yī)療機構(gòu)藥事管理與藥物治療學(xué)委員會(組)備案。
3.4.2 目錄外藥品應(yīng)急采購管理
評價目的:通過考察目錄外藥品應(yīng)急采購管理的規(guī)范性、合理性,考量目錄的科學(xué)性和客觀性,杜絕過度使用臨時采購來規(guī)避目錄的審批流程。
2003年,WHO藥物和治療學(xué)委員會指出,藥事管理與藥物治療學(xué)委員會的職能應(yīng)包括評估和選用未列入醫(yī)療機構(gòu)藥品供應(yīng)目錄的藥品等[11]。目錄外藥品(或稱“臨時采購藥品”)是指未列入醫(yī)療機構(gòu)藥品目錄且不常規(guī)采購,但在臨床緊急搶救、特殊病種治療需要或其他特殊需要時,可經(jīng)臨床科室申請,按醫(yī)院臨時采購相關(guān)流程進行采購的藥品[3,7]。由于目錄外藥品不屬于醫(yī)療機構(gòu)藥品正常保障的范疇,因此其采購量可從另一個側(cè)面反映醫(yī)療機構(gòu)的藥品目錄是否科學(xué)、合理,藥事管理與藥物治療學(xué)委員會(組)是否權(quán)威、有效。
根據(jù)相關(guān)規(guī)定,醫(yī)療機構(gòu)因特殊治療需要確需使用本醫(yī)療機構(gòu)抗菌藥物供應(yīng)目錄外抗菌藥物的,可以啟動臨時采購程序,但應(yīng)當(dāng)嚴格控制臨時采購抗菌藥物的品種和數(shù)量:同一通用名抗菌藥物品種啟動臨時采購程序原則上每年不得超過5例次;如果超過5例次,則需討論該藥品是否應(yīng)被列入至本醫(yī)療機構(gòu)抗菌藥物供應(yīng)目錄[3]。醫(yī)療機構(gòu)因特殊治療需要確需使用本醫(yī)療機構(gòu)抗腫瘤藥物供應(yīng)目錄外抗腫瘤藥物的,可以啟動臨時采購程序,由臨床科室提出申請,經(jīng)本醫(yī)療機構(gòu)抗腫瘤藥物管理工作組審核同意后,由藥學(xué)部門臨時一次性購入使用[6]。我國仍在不斷完善藥品臨時采購的相關(guān)政策制度,各醫(yī)療機構(gòu)也在不斷探索藥品臨時采購的相應(yīng)規(guī)范,但可以達成共識的是:臨時采購藥品應(yīng)符合必要性,即通過橫向?qū)Ρ韧愃幤坊蛲m應(yīng)證藥品的藥理作用機制和藥動學(xué)參數(shù)等,評定該藥品的臨床使用必要性;臨時采購藥品應(yīng)具有有效性,即通過重點查看推薦該藥品的臨床指南、專家共識,以及應(yīng)用該藥品的文獻及證據(jù)等級等,結(jié)合專家論證意見,評定該藥品的臨床治療效果;此外,還應(yīng)考察臨時采購藥品的安全性、經(jīng)濟性、醫(yī)保屬性和基本藥物屬性等,綜合評定該藥品的適宜性。
基于上述政策要求和文獻,本條目的主要評價內(nèi)容包括:(1)目錄外應(yīng)急采購藥品是否按醫(yī)療機構(gòu)臨時采購相關(guān)制度流程購入,并向醫(yī)療機構(gòu)藥事管理與藥物治療委員會(組)備案。(2)臨時采購藥品是否為臨床急需,目錄內(nèi)是否無同類藥品或同類藥品短缺,是否具有不可替代性。(3)臨時采購藥品是否僅限申請患者使用,其他患者不得使用;單次采購是否根據(jù)患者病情寫明采購數(shù)量及使用期限。(4)每年采購超過5例次的臨時采購藥品(主要考察抗菌藥物),是否啟動準入程序,討論是否納入常規(guī)目錄。(5)是否進一步發(fā)揮臨床藥師作用,對臨時采購藥品進行必要性、有效性、安全性等評估,或?qū)εR時采購藥品使用后的療效及安全性進行評估,以保障臨床合理用藥。
3.5 目錄評價
3.5.1 醫(yī)務(wù)部門的評價
醫(yī)務(wù)部門根據(jù)臨床科室的用藥需求、患者的治療需要,結(jié)合醫(yī)療機構(gòu)自身的發(fā)展特色,對藥品目錄進行相關(guān)評價,有助于保證醫(yī)療機構(gòu)藥品目錄滿足廣大患者不斷增長的臨床治療需求,實現(xiàn)常用藥品的全覆蓋,并有利于醫(yī)療機構(gòu)優(yōu)勢學(xué)科的發(fā)展。
醫(yī)療機構(gòu)藥品目錄是基于《國家基本藥物目錄》,結(jié)合本醫(yī)療機構(gòu)的醫(yī)療特色和臨床需要所制訂的藥品目錄。醫(yī)療機構(gòu)藥品目錄不僅僅是一個目錄,其調(diào)整將引發(fā)醫(yī)療機構(gòu)醫(yī)療服務(wù)和醫(yī)保報銷等一系列變化。因此,本條目的主要評價內(nèi)容包括:(1)目錄中的藥品是否能夠滿足本醫(yī)療機構(gòu)所有疾病譜的治療需要;(2)目錄結(jié)構(gòu)是否有利于優(yōu)勢學(xué)科發(fā)展[34]。
3.5.2 臨床醫(yī)師的評價
臨床醫(yī)師對藥品的使用具有決策權(quán),可以根據(jù)患者的疾病進程、個體差異和經(jīng)濟水平選擇個體化治療藥物。臨床醫(yī)師對于藥品目錄的評價可幫助醫(yī)療機構(gòu)豐富用藥層次,以保障患者用藥及時、安全、有效。
公立醫(yī)療機構(gòu)根據(jù)自身功能定位和診療范圍,基于《國家基本藥物目錄》合理配備基本藥物,并結(jié)合醫(yī)療機構(gòu)的特色,制訂本醫(yī)療機構(gòu)的藥品目錄,以保障臨床用藥需求。醫(yī)療機構(gòu)藥品目錄的相關(guān)藥品信息應(yīng)能支持臨床醫(yī)師通過多種渠道查閱獲取。基于上述政策要求,本條目的主要評價內(nèi)容包括:(1)臨床醫(yī)師是否能夠通過多種途徑獲取目錄中的藥品信息;(2)藥品數(shù)量、品種、規(guī)格、劑型等是否能夠滿足臨床需要。
3.5.3 護理部門的評價
作為住院醫(yī)囑的主要執(zhí)行者,護士對醫(yī)療機構(gòu)藥品目錄的評價有助于優(yōu)化目錄中有關(guān)急搶救藥品、病區(qū)備用藥品、麻精毒放藥品、高警示藥品、易混淆藥品的結(jié)構(gòu)設(shè)置,為臨床安全、準確、及時用藥助力。
根據(jù)《三級綜合醫(yī)院評審標準(2020年版)實施細則》,備用藥品管理工作的好壞將直接影響藥品的質(zhì)量和患者的用藥安全[10]。易混淆藥品概念復(fù)雜,包括具有相同(或相近)藥品名稱但不同劑型不同規(guī)格的藥品,或成分相近名稱不同的藥品,或可能由其他因素導(dǎo)致混淆的藥品。減少目錄中易混淆藥品的數(shù)量將有助于保障臨床準確用藥。對于麻精毒放等特殊管理藥品,應(yīng)當(dāng)按照有關(guān)法律、法規(guī)、規(guī)章的相關(guān)規(guī)定進行管理和監(jiān)督使用[2]。高警示藥品目錄的制訂將有助于醫(yī)護人員及時掌握高警示藥品信息。基于上述政策要求,本條目的主要評價內(nèi)容包括:(1)目錄中易混淆藥品和高警示藥品是否有標識;(2)是否能夠形成聯(lián)動機制,藥學(xué)部門是否根據(jù)目錄調(diào)整情況及時指導(dǎo)臨床(醫(yī)技)科室調(diào)整急搶救藥品目錄、備用藥品目錄等,并更換藥品。
3.5.4 藥學(xué)部門的評價
藥品目錄是保障醫(yī)療機構(gòu)合理用藥的基礎(chǔ)。藥師依據(jù)藥品的藥效學(xué)特點、制劑學(xué)特點、藥動學(xué)特點、藥物安全風(fēng)險、藥物經(jīng)濟學(xué)評價、藥物循證證據(jù),以及醫(yī)療機構(gòu)處方評價等信息,及時發(fā)現(xiàn)藥品目錄中存在的問題,并推動目錄調(diào)整和更新,有助于確保醫(yī)療機構(gòu)藥品目錄管理質(zhì)量的持續(xù)提升。
根據(jù)相關(guān)規(guī)定,藥學(xué)部門應(yīng)發(fā)揮管理職能,會同其他職能部門和臨床科室,切實加強對藥品遴選、采購、處方審核、處方調(diào)劑、臨床應(yīng)用和評價等各個環(huán)節(jié)的全過程管理;臨床藥師要對藥品臨床使用的安全性、有效性和經(jīng)濟性進行監(jiān)測、分析、評估[14]。基于上述政策要求,本條目的主要評價內(nèi)容包括:(1)藥師能否通過多種途徑獲取目錄中的藥品信息;(2)藥師參與目錄藥品調(diào)整時是否開展了專業(yè)技術(shù)評估;(3)目錄藥品短缺時是否有應(yīng)對支持措施;(4)是否有目錄質(zhì)量評估細則。
4 指南的更新
指南發(fā)布后,計劃在未來3~5年內(nèi)按照國際指南更新方法和流程對本推薦意見進行更新。
參考文獻
[ 1 ] 周瑞瑞,謝曉慧,陳哲,等.第5版和第6版《WHO兒童基本藥物標準清單》及其與《國家基本藥物目錄》(2012年版)的對比分析及啟示[J].中國新藥雜志,2018,27(19):2222-2226.
[ 2 ] 衛(wèi)生部,國家中醫(yī)藥管理局,總后勤部衛(wèi)生部.醫(yī)療機構(gòu)藥事管理規(guī)定:衛(wèi)醫(yī)政法〔2011〕11號[EB/OL]. [2021-03-
30]. http://www.nhc.gov.cn/cms-search/xxgk/getManuscript-
Xxgk.htm?id=0149ba1f66bd483995bb0ea51a354de1.
[ 3 ] 衛(wèi)生部.抗菌藥物臨床應(yīng)用管理辦法:衛(wèi)生部令第84號[EB/
OL].(2012-04-24)[2021-07-01]. http://www.nhc.gov.cn/fzs/s3576/201808/f5d983fb5b6e4f1ebdf0b7c32c37a368.shtml.
[ 4 ] 國家衛(wèi)生計生委辦公廳,國家中醫(yī)藥管理局辦公室,解放軍總后勤部衛(wèi)生部藥品器材局.關(guān)于印發(fā)抗菌藥物臨床應(yīng)用指導(dǎo)原則(2015年版)的通知:國衛(wèi)辦醫(yī)發(fā)〔2015〕43號[EB/OL].(2015-08-27)[2021-12-31]. http://www.gov. cn/xinwen/2015-08/27/content_2920799.htm.
[ 5 ] 國家衛(wèi)生健康委.關(guān)于印發(fā)第一批國家重點監(jiān)控合理用藥藥品目錄(化藥及生物制品)的通知:國衛(wèi)辦醫(yī)函〔2019〕558號[EB/OL].(2019-07-01)[2021-07-01]. http://www.nhc.gov.cn/yzygj/s7659/201907/d356ce8a4ba1461ca-
66c544724dffc5e.shtml.
[ 6 ] 國家衛(wèi)生健康委,教育部,財政部,等.衛(wèi)生健康委教育部財政部人力資源社會保障部醫(yī)保局藥監(jiān)局關(guān)于印發(fā)加強醫(yī)療機構(gòu)藥事管理促進合理用藥的意見的通知:國衛(wèi)醫(yī)發(fā)〔2020〕2號[EB/OL].(2020-02-21)[2021-07-11]. http:// www.gov.cn/gongbao/content/2020/content_5522549.htm.
[ 7 ] 國家衛(wèi)生健康委.國家衛(wèi)生健康委關(guān)于印發(fā)抗腫瘤藥物臨床應(yīng)用管理辦法(試行)的通知:國衛(wèi)醫(yī)函〔2020〕487號[EB/OL].(2020-12-28)[2021-07-11]. http://www.nhc.gov.cn/yzygj/s7659/202012/a7600740bed44d1db7015ca5a-
1be2cc0.shtml.
[ 8 ] 國家衛(wèi)生健康委辦公廳.國家衛(wèi)生健康委辦公廳關(guān)于印發(fā)國家重點監(jiān)控合理用藥藥品目 錄調(diào)整工作規(guī)程的通知:國衛(wèi)辦醫(yī)函〔2021〕474號[EB/OL].(2021-09-03)[2021-
07-11]. http://www.nhc.gov.cn/yzygj/s7659/202109/5162-
329bf12d40ea9327b4e8db5103dc.shtml.
[ 9 ] 趙志剛,董占軍,劉建平.中國醫(yī)療機構(gòu)藥品評價與遴選快速指南[J].醫(yī)藥導(dǎo)報,2020,39(11):1457-1465.
[10] 國家衛(wèi)生健康委辦公廳.國家衛(wèi)生健康委辦公廳關(guān)于印發(fā)《三級醫(yī)院評審標準(2020年版)實施細則》的通知:國衛(wèi)辦醫(yī)發(fā)﹝2021﹞19號[EB/OL].(2021-10-21)[2021-12-31].
http://www.nhc.gov.cn/yzygj/s7657/202110/b9fceda9371-
84f259ecae7ece8522d24.shtml.
[11] KATHLEEN H,TERRY G. Drug and therapeutics committees:a practical guide[EB/OL].[2021-12-31]. https://apps.who.int/iris/handle/10665/68553.
[12] 國家衛(wèi)生健康委.關(guān)于印發(fā)2018年糾正醫(yī)藥購銷領(lǐng)域和醫(yī)療服務(wù)中不正之風(fēng)專項治理工作要點的通知:國衛(wèi)醫(yī)函﹝2018﹞186號[EB/OL].(2018-08-23)[2021-12-31].http://www.nhc.gov.cn/cms-search/xxgk/getManuscript-
Xxgk.htm?id=f7ec7ea4f4e34417a0d15da0079a1826.
[13] 陳新謙,金有豫,湯光.新編藥物學(xué)[M]. 18版.北京:人民衛(wèi)生出版社,2018.
[14] 衛(wèi)生部.處方管理辦法[EB/OL].(2006-02-14)[2021-12-31].
http://www.nhc.gov.cn/yzygj/s3572/200602/dd4277bbf37-
84ff589b9f12b6a0422ab.shtml?from=singlemessage.
[15] 國家衛(wèi)生計生委辦公廳,國家中醫(yī)藥管理局.關(guān)于加強藥事管理轉(zhuǎn)變藥學(xué)服務(wù)模式的通知:國衛(wèi)辦醫(yī)發(fā)〔2017〕26號[EB/OL].(2017-07-12)[2021-12-31]. http://www.nhc.gov.cn/yzygj/s7659/201707/b44339ebef924f038003e1b7d-
ca492f2.shtml.
[16] 國務(wù)院辦公廳.國務(wù)院辦公廳關(guān)于進一步做好短缺藥品保供穩(wěn)價工作的意見:國辦發(fā)〔2019〕47號[EB/OL].(2019-10-11)[2021-12-31]. http://www.nhc.gov.cn/bgt/gwywj2/201910/7d2b39c6f68d46bd82f184731de80dcc.shtml.
[17] 衛(wèi)生部辦公廳.關(guān)于繼續(xù)深入開展全國抗菌藥物臨床應(yīng)用專項整治活動的通知:衛(wèi)辦醫(yī)政發(fā)〔2012〕32號[EB/OL].(2012-03-06)[2021-12-31]. http://www.nhc.gov.cn/cms-search/xxgk/getManuscriptXxgk.htm?id=54251.
[18] 國家衛(wèi)生健康委辦公廳.關(guān)于持續(xù)做好抗菌藥物臨床應(yīng)用管理工作的通知:國衛(wèi)辦醫(yī)發(fā)〔2018〕9號[EB/OL].(2018-05-10)[2021-12-31]. http://www.nhc.gov.cn/cms-
search/xxgk/getManuscriptXxgk.htm?id=c79c998bdf8f47-
44858051cdfd1e6818.
[19] 國家衛(wèi)生健康委辦公廳.關(guān)于持續(xù)做好抗菌藥物臨床應(yīng)用管理工作的通知:國衛(wèi)辦醫(yī)發(fā)〔2019〕12號[EB/OL].(2019-03-29)[2021-12-31]. http://www.nhc.gov.cn/yzygj/s7659/201903/1d487eb7b7c74abc9fcb104f8b0905f2.shtml.
[20] 國家衛(wèi)生健康委辦公廳.關(guān)于持續(xù)做好抗菌藥物臨床應(yīng)用管理工作的通知:國衛(wèi)辦醫(yī)發(fā)〔2020〕8號[EB/OL].(2020-07-23)[2021-12-31]. http://www.nhc.gov.cn/yzygj/s3593/202007/8311bda4cf2443dfae4d719f1d0d72da.shtml.
[21] 國家衛(wèi)生健康委,國家中醫(yī)藥管理局.關(guān)于國家藥物基本藥物目錄(2018年版)的通知:國衛(wèi)藥政發(fā)〔2018〕31號[EB/OL].(2018-09-30)[2021-12-31]. http://www.gov.cn/zhengce/zhengceku/2018-12/31/content_5435470.htm.
[22] 國家衛(wèi)生健康委,國家中醫(yī)藥局.關(guān)于進一步加強公立醫(yī)療機構(gòu)基本藥物配備使用管理的通知:國衛(wèi)藥政發(fā)〔2019〕
1號[EB/OL].(2019-01-17)[2021-12-31]. http://www.nhc. gov.cn/yaozs/s7657/201901/b3f6fb3f55314a7faff9738690-
8bd4f4.shtml.
[23] 國家衛(wèi)生健康委辦公廳.關(guān)于加強醫(yī)療機構(gòu)麻醉藥品和第一類精神藥品管理的通知:國衛(wèi)辦醫(yī)發(fā)〔2020〕13號[EB/OL].(2020-09-15)[2021-12-31]. http://www.nhc.gov.cn/yzygj/s7659/202009/ee4a21c2756f440e98f78d253-
3d7539a.shtml.
[24] 國務(wù)院辦公廳.關(guān)于推動藥品集中帶量采購工作常態(tài)化制度化開展的意見:國辦發(fā)〔2021〕2號[EB/OL].(2021-01-
28)[2021-12-31]. http://www.nhc.gov.cn/bgt/gwywj2/
202102/a8c4cf2af4aa48ba9ea42d1bf3b0f5f0.shtml.
[25] 國家醫(yī)療保障局,國家衛(wèi)生健康委.關(guān)于適應(yīng)國家醫(yī)保談判常態(tài)化、持續(xù)做好談判藥品落地工作的通知:醫(yī)保函〔2021〕182號[EB/OL].(2021-09-09)[2021-12-31]. http://www.gov.cn/zhengce/zhengceku/2021-09/11/content_5636762.htm.
[26] 國家衛(wèi)生健康委.關(guān)于印發(fā)全國醫(yī)院信息化建設(shè)標準與規(guī)范(試行)的通知:國衛(wèi)辦規(guī)劃發(fā)〔2018〕4號[EB/OL].(2018-04-13)[2021-12-31]. http://www.nhc.gov.cn/cms- search/xxgk/getManuscriptXxgk.htm?id=5711872560ad4-
866a8f500814dcd7ddd.
[27] 國家衛(wèi)生健康委,國家中醫(yī)藥管理局.關(guān)于印發(fā)全國基層醫(yī)療衛(wèi)生機構(gòu)信息化建設(shè)標準與規(guī)范(試行)的通知:國衛(wèi)規(guī)劃函〔2019〕87號[EB/OL].(2019-04-28)[2021-12-31].
http://www.nhc.gov.cn/cms-search/xxgk/getManuscriptXx-
gk.htm?id=9d346a5ef0134e6a82c79c5c9ab96b77.
[28] 國家衛(wèi)生健康委辦公廳.國家衛(wèi)生健康委辦公廳關(guān)于印發(fā)全國醫(yī)院上報數(shù)據(jù)統(tǒng)計分析指標集(試行)的通知:國衛(wèi)辦規(guī)劃函〔2019〕383號[EB/OL].(2019-05-07)[2021-12-
31]. http://www.nhc.gov.cn/guihuaxxs/gongwen12/201905/20b748ccaa0443039ede499a0a7dab09.shtml.
[29] 國家醫(yī)療保障局.國家醫(yī)療保障局關(guān)于國家組織藥品集中采購和使用試點醫(yī)保配套措施的意見:醫(yī)保發(fā)〔2019〕18號[EB/OL].(2019-03-05)[2021-12-31]. http://www.nhsa.gov.cn/art/2019/3/5/art_53_1016.html.
[30] 國家藥品監(jiān)督管理局.關(guān)于發(fā)布個例藥品不良反應(yīng)收集和報告指導(dǎo)原則的通告:國家藥監(jiān)局2018年第131號[EB/OL].(2020-09-24)[2021-12-31]. https://www.cdr- adr.org.cn/drug_1/zcfg_1/zcfg_zdyz/202009/t20200924_47831.html.
[31] 國務(wù)院辦公廳.國務(wù)院辦公廳關(guān)于完善公立醫(yī)院藥品集中采購工作的指導(dǎo)意見:國辦發(fā)〔2015〕7號[EB/OL].(2015-02-28)[2021-12-31]. http://www.nhc.gov.cn/cms- search/xxgk/getManuscriptXxgk.htm?id=7d0741e719e24-
9689ec12d62c7936513.
[32] 國家衛(wèi)生計生委,國家發(fā)展改革委,工業(yè)和信息化部,等.關(guān)于改革完善短缺藥品供應(yīng)保障機制的實施意見:國衛(wèi)藥政發(fā)〔2017〕37號[EB/OL].(2017-06-28)[2021-12-31].http://www.nhc.gov.cn/yaozs/s3581/201706/ec2c5910ba4-
341559e0176e5e237d5e6.shtml.
[33] 國家衛(wèi)生健康委辦公廳.國家衛(wèi)生健康委辦公廳關(guān)于印發(fā)醫(yī)療機構(gòu)短缺藥品分類分級與替代使用技術(shù)指南的通知:國衛(wèi)辦藥政函〔2019〕625號[EB/OL].(2019-07-25)
[2021-12-31]. http://www.nhc.gov.cn/cms-search/xxgk/
getManuscriptXxgk.htm?id=495842935554402baf6470a7-
c6244343.
[34] 國務(wù)院辦公廳.國務(wù)院辦公廳關(guān)于完善國家基本藥物制度的意見:國辦發(fā)〔2018〕88號[EB/OL].(2018-09-19)[2021-
12-31]. http://www.gov.cn/zhengce/content/2018-09/19/
content_5323459.htm.
專家指導(dǎo)組
劉麗宏 中日友好醫(yī)院 ? ? ? ? ? 沈愛宗 中國科學(xué)技術(shù)大學(xué)附屬第一醫(yī)院(安徽省立醫(yī)院)
卞曉嵐 上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院 徐 珽 四川大學(xué)華西醫(yī)院
李曉宇 復(fù)旦大學(xué)附屬中山醫(yī)院 陳 慧 首都醫(yī)科大學(xué)附屬北京朝陽醫(yī)院
專家組(執(zhí)筆人)
概述部分
劉琳琳 中國科學(xué)技術(shù)大學(xué)附屬第一醫(yī)院(安徽省立醫(yī)院)
馮鈺斌 中國科學(xué)技術(shù)大學(xué)附屬第一醫(yī)院(安徽省立醫(yī)院)
目錄管理部分
劉 曉 中日友好醫(yī)院 孔旭東 中日友好醫(yī)院
趙穎楠 中日友好醫(yī)院
目錄結(jié)構(gòu)部分
陳 慧 首都醫(yī)科大學(xué)附屬北京朝陽醫(yī)院 于曉佳 首都醫(yī)科大學(xué)附屬北京朝陽醫(yī)院
目錄調(diào)整部分
田方圓 四川大學(xué)華西醫(yī)院 金朝輝 四川大學(xué)華西醫(yī)院
目錄應(yīng)用部分
管瀅蕓 上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院 房 嫣 上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院
目錄評價部分
陳婷婷 復(fù)旦大學(xué)附屬中山醫(yī)院 周 殷 復(fù)旦大學(xué)附屬中山醫(yī)院
外審組(排名不分先后)
曹俊嶺 北京中醫(yī)藥大學(xué)東方醫(yī)院 蔡本志 哈爾濱醫(yī)科大學(xué)附屬第二醫(yī)院
杜書章 鄭州大學(xué)第一附屬醫(yī)院 范國榮 上海交通大學(xué)附屬第一人民醫(yī)院
封衛(wèi)毅 西安交通大學(xué)第一附屬醫(yī)院 封宇飛 北京大學(xué)人民醫(yī)院
方晴霞 浙江省人民醫(yī)院 菅凌燕 中國醫(yī)科大學(xué)附屬盛京醫(yī)院
葛衛(wèi)紅 南京鼓樓醫(yī)院 郭 澄 上海交通大學(xué)附屬第六人民醫(yī)院
黃品芳 福建醫(yī)科大學(xué)附屬第一醫(yī)院 侯銳鋼 山西醫(yī)科大學(xué)第二醫(yī)院
蔣志濤 北京好藥師大藥房連鎖有限公司 羅 璨 江蘇省婦幼保健院
劉國強 河北醫(yī)科大學(xué)第三醫(yī)院 李冬梅 青島大學(xué)附屬醫(yī)院
李國輝 中國醫(yī)學(xué)科學(xué)院腫瘤醫(yī)院 陸叢笑 煙臺毓璜頂醫(yī)院
路 云 中國藥科大學(xué) 歐陽華 廈門大學(xué)附屬中山醫(yī)院
沈承武 山東省立醫(yī)院 王延風(fēng) 中國醫(yī)學(xué)科學(xué)院腫瘤醫(yī)院
王婧雯 空軍軍醫(yī)大學(xué)第一附屬醫(yī)院 吳 晶 天津大學(xué)
魏 理 廣州醫(yī)科大學(xué)附屬第一醫(yī)院 肖 勇 中國人民解放軍第五醫(yī)院
袁 洪 中南大學(xué)湘雅三醫(yī)院 楊 麗 北京大學(xué)第三醫(yī)院
楊建華 新疆醫(yī)科大學(xué)第一附屬醫(yī)院 翟光喜 山東大學(xué)
鄒麗穎 首都醫(yī)科大學(xué)附屬北京婦產(chǎn)醫(yī)院 張 波 北京協(xié)和醫(yī)院
張 峻 昆明醫(yī)科大學(xué)第一附屬醫(yī)院 趙 飛 北京醫(yī)院
趙立波 北京大學(xué)第三醫(yī)院 趙環(huán)宇 首都醫(yī)科大學(xué)附屬北京同仁醫(yī)院
栗世鈾 北京啟辰生生物科技有限公司
秘書組(排名不分先后)
馮鈺斌 中國科學(xué)技術(shù)大學(xué)附屬第一醫(yī)院(安徽省立醫(yī)院)
胡世林 中國科學(xué)技術(shù)大學(xué)附屬第一醫(yī)院(安徽省立醫(yī)院)
蘇 丹 中國科學(xué)技術(shù)大學(xué)附屬第一醫(yī)院(安徽省立醫(yī)院)
蘇廣全 安徽中醫(yī)藥大學(xué)

