毛萼乙素調控lncRNA CPS1-IT1表達抑制膀胱癌T24細胞增殖、遷移、侵襲的機制研究
熊濤 王慧 黃夢婷 陳錚銳
膀胱癌是與泌尿生殖道癌癥相關死亡的主要原因,也是男性治療中最昂貴的惡性腫瘤[1]。外科手術、放射療法和化學療法是膀胱癌患者的主要治療方法[2]。然而,這些推薦療法的治療效果仍然有限,并且在過去的幾十年中,膀胱癌患者的5年總生存率一直處于較低水平,死亡率并未發生明顯變化[3]。因此,迫切需要早期診斷標記和新的治療策略來治療膀胱癌。毛萼乙素(Eriocalyxin)是從傳統中草藥毛萼香茶菜(Isodon eriocalyx)提取的對映體-月桂烯二萜類化合物,具有多種功能,如抗癌和抗炎[4]。研究表明,毛萼乙素可抑制宮頸癌細胞C-33A的增殖[5],降低乳腺癌細胞的生存能力,誘導細胞凋亡[6]。毛萼乙素可通過升高促凋亡蛋白Bcl-2相關X蛋白(Bcl-2 Associated X Protein,Bax)的表達,促進肝癌細胞HepG2的凋亡,從而抑制其增殖[7]。長鏈非編碼RNA(long noncoding RNA,lncRNA)氨甲酰磷酸合成酶1-內含子轉錄本1(carbamoyl-phosphate synthase 1 intronic transcript 1,CPS1-IT1)在上皮性卵巢癌組織和細胞中下調表達,過表達lncRNA CPS1-IT1可促進卵巢癌細胞的增殖,誘導細胞凋亡[8]。lncRNA CPS1-IT1在肺癌組織中低表達,過表達lncRNA CPS1-IT1抑制肺癌細胞的增殖和侵襲[9]。lncRNA CPS1-IT1在結直腸癌組織和細胞中下調表達,可抑制結直腸癌細胞的增殖、遷移和侵襲,促進細胞凋亡[10]。但毛萼乙素和lncRNA CPS1-IT1對膀胱癌T24細胞增殖、遷移和侵襲的影響,且毛萼乙素是否通過調控lncRNA CPS1-IT1的表達影響膀胱癌T24細胞的增殖、遷移和侵襲能力,目前仍然未知。本研究探討毛萼乙素在膀胱癌細胞增殖和轉移行為中的作用,并結合lncRNA CPS1-IT1評估其在膀胱癌中的生物學調控機制。
1 材料與方法
1.1 材料 膀胱癌細胞株T24(美國典型培養物保藏中心ATCC),毛萼乙素、二甲基亞砜(Dimethyl sulphoxide,DMSO)(上海源葉生物),lncRNA DNA-CPS1-IT1過表達質粒pcDNA-CPS1-IT1、空載質粒pcDNA、LipofectamineTM2000(美國Invitrogen),針對lncRNA DNA-CPS1-IT1小干擾RNA si-CPS1-IT1、其陰性對照si-NC、Dulbecco’s Modified Eagle’s Medium(DMEM培養基)、TRIzol試劑(美國Thermo Fisher Scientific),PrimeScript RT、SYBR Premix ExTaq II試劑盒(北京Takara),四甲基偶氮唑藍(methyl thiazolyl tetrazolium,MTT)(上海Bio Basic),硝酸纖維素膜(英國Amersham Bioscience),ECL檢測試劑(美國Millipore)。
1.2 細胞培養與處理 T24細胞在含有10%胎牛血清、100 U/ml青霉素和100 μg/ml鏈霉素的DMEM培養基中培養,在5% CO2濕潤的環境中于37℃孵育。在對數生長期的T24細胞中加入2.5 μmol/L、5 μmol/L、10 μmol/L濃度的毛萼乙素[7],分別記為ERB-L組、ERB-M組、ERB-H組。同時設立未給藥的T24細胞為對照(Con組)。配制不同濃度的毛萼乙素時,以少量的DMSO助溶,以DMEM培養基稀釋成2.5 μmol/L、5 μmol/L、10 μmol/L的濃度備用。
1.3 細胞轉染與分組 在6孔板中培養T24細胞(1×106個/孔)以達到80%融合度,然后使用LipofectamineTM2000試劑用pcDNA、pcDNA-CPS1-IT1、si-NC、si-CPS1-IT1轉染T24細胞,根據具體的說明進行操作。轉染孵育24 h后,通過qRT-PCR分析轉染效率,然后用于進一步的測定。其中,轉染si-NC和si-CPS1-IT1的T24細胞加入10 μmol/L毛萼乙素作用24 h。轉染后的T24細胞分別記為pcDNA組、pcDNA-CPS1-IT1組、ERB+si-NC組、ERB+si-CPS1-IT1組。
1.4 細胞增殖測定 使用MTT測定法測定T24細胞增殖抑制率。在96孔板中培養T24細胞,每孔約5×103個細胞,T24細胞粘附在培養皿壁上,根據1.2和1.3方法進行毛萼乙素或轉染處理。孵育48 h后,在每個孔中將10 μl MTT(5 μg/ml)與培養基混合,再培養4 h形成甲瓚結晶,并再次溶于100 μl DMSO中。最后,使用BioTek自動酶標儀在490 nm處測量吸光度OD值,計算抑制率(%)。
1.5 免疫印跡法(Western blot) 將不同分組的T24細胞在200 μl RIPA裂解液中裂解,裂解液中含有蛋白酶抑制劑。然后,用10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離蛋白質,轉移到硝酸纖維素膜上,脫脂奶封閉后,將膜與抗細胞核相關抗原Ki-67(nuclear associated antigen Ki67,Ki-67),基質金屬蛋白酶(matrix metalloproteases,MMP)-2,MMP-9和甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的一抗(均為1∶1 000稀釋)孵育過夜。與二抗(為1∶2 000稀釋)孵育后,化學發光信號使用ECL檢測試劑可視化,GAPDH用作對照,ImageJ軟件分析Ki-67、MMP-2和MMP-9蛋白表達。
1.6 細胞遷移、侵襲檢測 通過Transwell測定法確定不同分組的T24細胞遷移和侵襲。在Transwell底部腔室中裝入600 μl含10%胎牛血清的DMEM培養基。將T24細胞重懸于不含胎牛血清的培養基中,并將100 μl T24細胞(1×104)置于上腔室中。溫育24 h后,將細胞用PBS洗滌3次,并用甲醇固定10 min,然后用結晶紫染色5 min。 通過計數穿過過濾器向腔室下表面遷移的細胞來量化細胞遷移。在顯微鏡下計算5個隨機視野的平均值為遷移細胞數。為進行侵襲測定,將腔室的上表面在37℃的培養箱中用Matrigel預處理6 h。之后的步驟同遷移測定。
1.7 RNA分離和qRT-PCR 使用TRIzol試劑從膀胱癌T24細胞(2×106個)中提取總RNA。按照說明,使用帶有gDNA Eraser的PrimeScript RT試劑盒,將每個RNA(1 μg)逆轉錄為互補DNA(cDNA)。之后,在ABI 7900實時PCR系統上使用SYBR Premix ExTaq II試劑盒進行PCR,以定量lncRNA CPS1-IT1的相對表達。GAPDH用作內部對照。2-ΔΔCt方法分析數據并計算lncRNA CPS1-IT1的相對表達。引物序列為lncRNA CPS1-IT1 正向5’-CAC AGA TGA TCC ACGCGCGTT-3’和反向5’-GCG TGC ATC AAT GAC ACT TCA-3’;GAPDH 正向5’-CGG AGT CAA CGG ATT TGG TCG TAT TGG-3’和反向5’-GCT CCT GGA AGA TGG TGA TGG GAT TTC C-3’。
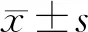
2 結果
2.1 毛萼乙素對膀胱癌T24細胞增殖的影響 MTT和Western blot檢測結果顯示,2.5 μmol/L、5 μmol/L、10 μmol/L濃度的毛萼乙素作用于膀胱癌T24細胞后,ERB-L組、ERB-M組、ERB-H組T24細胞的增殖抑制率均高于Con組,Ki-67蛋白表達量低于Con組(P<0.05);與ERB-L組比較,ERB-M組、ERB-H組T24細胞的增殖抑制率升高,Ki-67蛋白的表達量降低;ERB-H組較ERB-M組提高T24細胞的增殖抑制率,降低Ki-67蛋白的表達量,差異均有統計學意義(P<0.05)。見圖1,表1。

圖1 Ki-67蛋白表達

表1 毛萼乙素對膀胱癌T24細胞增殖的影響
2.2 毛萼乙素對膀胱癌T24細胞遷移、侵襲的影響 Transwell和Western blot檢測結果顯示,2.5 μmol/L、5 μmol/L、10 μmol/L濃度的毛萼乙素作用于膀胱癌T24細胞后,ERB-L組、ERB-M組、ERB-H組T24細胞的遷移、侵襲細胞數、MMP-2、MMP-9蛋白的表達量均低于Con組(P<0.05);與ERB-L組比較,ERB-M組、ERB-H組T24細胞的遷移、侵襲細胞數、MMP-2、MMP-9蛋白的表達量減少(P<0.05);ERB-H組較ERB-M組降低T24細胞的遷移、侵襲細胞數、MMP-2、MMP-9蛋白的表達量(P<0.05)。見圖2,表2。
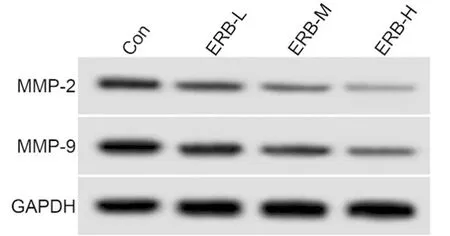
圖2 遷移侵襲相關蛋白表達

表2 毛萼乙素對膀胱癌T24細胞遷移、侵襲的影響
2.3 毛萼乙素對膀胱癌T24細胞中lncRNA CPS1-IT1表達的影響 qRT-PCR檢測結果顯示,ERB-L組、ERB-M組、ERB-H組T24細胞中lncRNA CPS1-IT1表達量均高于Con組(P<0.05);與ERB-L組比較,ERB-M組、ERB-H組T24細胞的lncRNA CPS1-IT1表達量增加(P<0.05);ERB-H組較ERB-M組提高T24細胞內lncRNA CPS1-IT1表達量,差異均有統計學意義(P<0.05)。見表3。

表3 毛萼乙素對膀胱癌T24細胞中lncRNA CPS1-IT1表達的影響
2.4 lncRNA CPS1-IT1過表達對膀胱癌T24細胞增殖、遷移侵襲的影響 qRT-PCR檢測轉染pcDNA-CPS1-IT1后的效率,發現pcDNA-CPS1-IT1組T24細胞中lncRNA CPS1-IT1的表達量高于pcDNA組(P<0.05),提示成功構建lncRNA CPS1-IT1過表達的T24細胞。MTT、Transwell和Western blot檢測結果表明,pcDNA-CPS1-IT1組T24細胞的抑制率高于pcDNA組,遷移、侵襲細胞數、Ki-67、MMP-2和MMP-9蛋白表達量低于pcDNA組,差異均有統計學意義(P<0.05)。見表4,圖3。

表4 lncRNA CPS1-IT1過表達對膀胱癌T24細胞增殖、遷移侵襲的影響
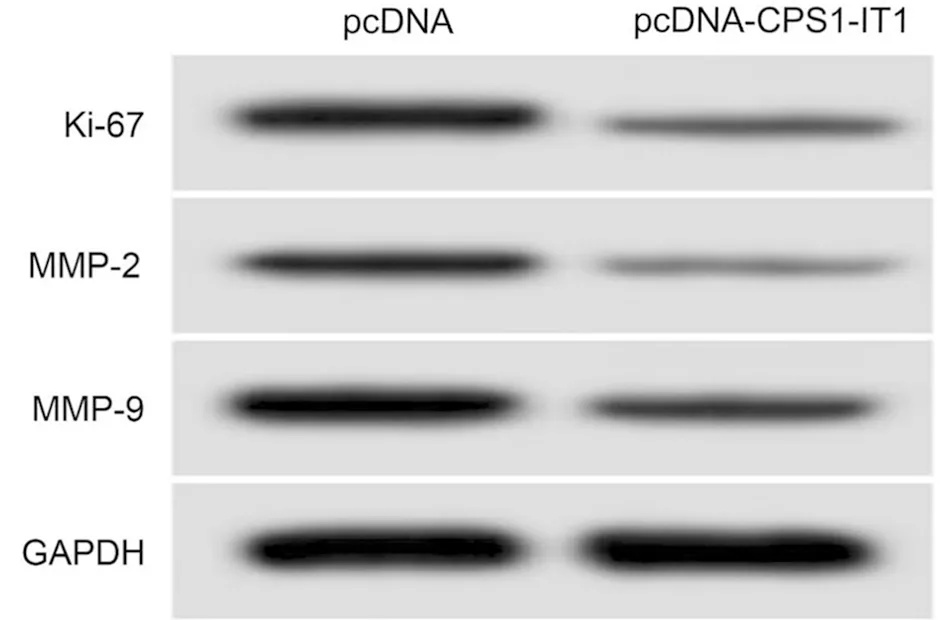
圖3 增殖、遷移侵襲相關蛋白表達
2.5 抑制lncRNA CPS1-IT1表達逆轉了毛萼乙素(10 μmol/L)對膀胱癌T24細胞增殖、遷移、侵襲的作用 qRT-PCR、MTT、Transwell和Western blot檢測顯示,與ERB+si-NC組比較,ERB+si-CPS1-IT1組T24細胞的CPS1-IT1表達量、抑制率降低,遷移、侵襲細胞數、Ki-67、MMP-2和MMP-9蛋白表達量升高,差異均有統計學意義(P<0.05)。見圖4,表5。

圖4 增殖、遷移侵襲相關蛋白表達

表5 抑制lncRNA CPS1-IT1表達逆轉了毛萼乙素對膀胱癌T24細胞增殖、遷移、侵襲的作用
3 討論
膀胱癌是常見的惡性腫瘤之一,發病率和死亡率較高。吸煙是膀胱癌的最強危險因素,占所有病例的50%~65%[11]。盡管近年來全球膀胱癌死亡率有所降低,但膀胱癌患者容易發生癌癥轉移,轉移性膀胱癌的預后仍然很差[12]。目前,尚未闡明膀胱癌的發生和發展的分子機制。因此,描述膀胱癌發展中涉及的分子機制,以發現潛在的新穎和重要的診斷標志物和治療策略。
毛萼乙素具有許多藥理活性,包括抑制炎性反應,調節免疫細胞分化,抑制腫瘤細胞增殖,引起細胞周期停滯,影響血管生成并促進癌細胞凋亡[4]。毛萼乙素已被證實可有效對抗多種癌癥,例如在前列腺癌PC-3和22RV1細胞中,毛萼乙素以時間和劑量依賴性的方式抑制細胞增殖并誘導其凋亡和自噬,潛在機制與抑制蛋白激酶B(protein kinase B,Akt)和雷帕霉素靶蛋白(mTOR)的磷酸化有關[13]。毛萼乙素可增強吉西他濱對胰腺癌的細胞毒性和凋亡作用[14]。毛萼乙素通過抑制核轉錄因子-κB p65,信號轉導與轉錄因子3(signal transducers and activators of transcription 3,STAT3)磷酸化來誘導三陰性乳腺癌MDA-MB231細胞凋亡[15]。但是,毛萼乙素的詳細作用及其在膀胱癌中涉及的機制尚不清楚。本研究顯示毛萼乙素對膀胱癌T24細胞增殖和轉移的抑制能力,即2.5 μmol/L、5 μmol/L、10 μmol/L濃度的毛萼乙素顯著增加T24細胞的增殖抑制率,減少遷移、侵襲細胞數、Ki-67、MMP-2、MMP-9蛋白的表達量,并呈一定的濃度依賴性,表現出一定的抗膀胱癌增殖和轉移活性。這些為進一步開展毛萼乙素體內研究提供了依據,毛萼乙素也被證明是開發針對膀胱癌的新型療法的潛在候選藥物。
lncRNA代表一類新穎的非編碼RNA,其長度超過200個核苷酸,并且不具有蛋白質編碼潛能。研究發現lncRNA失調,并參與多種癌癥生物學過程,例如增殖,凋亡,遷移和侵襲[16]。越來越多的lncRNA已被證明在癌癥的發生和發展中起癌基因或抑癌作用[17]。lncRNA CPS1-IT1最近被鑒定多種癌癥類型發展和進程的基因調節劑。研究顯示,與配對的正常腦組織和人星形膠質細胞相比,神經膠質瘤組織和細胞中的lncRNA CPS1-IT1水平分別降低;lncRNA CPS1-IT1表達的上調導致神經膠質瘤細胞的增殖,遷移和侵襲能力下降[18]。Zhou等[19]觀察到lncRNA CPS1-IT1在人黑素瘤組織和細胞系中低表達,與轉移和腫瘤分期顯著相關。此外,還指出lncRNA CPS1-IT1的過度表達抑制黑素瘤細胞的細胞遷移、侵襲,上皮-間質轉化和血管生成,揭示了lncRNA CPS1-IT1作為預后預測者的潛力。lncRNA CPS1-IT1在結直腸癌組織和細胞系中低表達,可能通過抑制缺氧誘導因子1α的激活來抑制缺氧誘導的自噬,從而抑制結直腸癌轉移和上皮間質轉化[20]。本研究進行細胞增殖測定,細胞遷移和侵襲測定,來揭示lncRNA CPS1-IT1在膀胱癌中的功能。結果顯示,lncRNA CPS1-IT1的過表達顯著抑制了膀胱癌T24細胞的增殖、遷移和侵襲,以及相關蛋白Ki-67、MMP-2和MMP-9的表達,意味著lncRNA CPS1-IT1可以抑制膀胱癌的發展。同時也表明,lncRNA CPS1-IT1是一種潛在的生物標志物,可作為膀胱癌的腫瘤抑制基因。
有證據表明,lncRNA介導一些中藥活性成分的抗腫瘤功能,例如白藜蘆醇苷、黃芩素[21]等。根據報道,冬凌草甲素下調lncRNA AFAP1-AS1抑制胰腺癌細胞上皮向間充質轉化、遷移、侵襲和增殖[22]。lncRNA癌癥易感性候選物2(CASC2)通過在轉錄后水平上抑制B細胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)表達來介導小檗堿誘導的促大腸癌細胞凋亡作用[23]。本研究首先發現,2.5 μmol/L、5 μmol/L、10 μmol/L毛萼乙素以濃度依賴方式顯著上調lncRNA CPS1-IT1表達,由此猜想lncRNA CPS1-IT1可能參與毛萼乙素的抗膀胱癌T24細胞增殖和轉移進程。進一步的功能實驗檢測到,si-CPS1-IT1與毛萼乙素共同作用時,膀胱癌T24細胞的增殖抑制率減少,遷移、侵襲細胞數、Ki-67、MMP-2和MMP-9蛋白表達量增加,可見抑制lncRNA CPS1-IT1表達可以逆轉毛萼乙素對T24細胞增殖、遷移、侵襲的影響。這些結果表明,膀胱癌中lncRNA CPS1-IT1是毛萼乙素機制的關鍵靶標,介導毛萼乙素抗膀胱癌發生發展過程。
綜上所述,毛萼乙素可降低膀胱癌T24細胞增殖、遷移和侵襲。此外,毛萼乙素通過增加lncRNA CPS1-IT1的表達水平發揮其在膀胱癌中的抗癌作用。因此,毛萼乙素可能是膀胱癌患者的一種潛在的替代治療藥物,而lncRNA CPS1-IT1可以作為改善毛萼乙素抗癌作用的重要治療靶點。

