纖枝短月蘚BeLEA2基因的克隆及表達分析
李雪寶 王琦 鄢波



摘 要:? 為探究纖枝短月蘚LEA2基因的結構和表達特征,該研究以纖枝短月蘚為材料,首次利用PCR克隆技術得到纖枝短月蘚BeLEA2基因序列,并對該基因進行分析。結果表明:(1)該基因序列中含有2個外顯子和1個內含子,其開放閱讀框(ORF)為 456 bp,編碼151個氨基酸,預測其相對分子質量為16 515.96 Da。(2)將纖枝短月蘚與其他植物LEA2基因氨基酸序列進行比對,構建系統進化樹,結果顯示纖枝短月蘚與小立碗蘚的親緣關系最近。(3)利用HiTail-PCR技術克隆獲得1 072 bp的BeLEA2啟動子序列,用PlantCARE在線工具對該啟動子的順式作用元件進行預測,結果表明該啟動子除了含有核心啟動子元件TATA-box和CAAT-box外,還含有ABRE、MYB、MYC、MYB結合位點(MBS)等其他順式元件。(4)實時熒光定量PCR分析表明,BeLEA2基因在纖枝短月蘚不同發育時期和不同組織中都有表達,且對脫水脅迫有響應。以上結果為進一步探究LEA2基因在苔蘚植物中的功能及作用機制奠定了基礎。
關鍵詞: 纖枝短月蘚, LEA2基因, 啟動子, 脫水脅迫, 表達
中圖分類號:? Q943
文獻標識碼:? A
文章編號:? 1000-3142(2022)02-0277-09
Cloning and expression analysis of? BeLEA2 gene from Brachymenium exile
LI Xuebao1,3, WANG Qi2, YAN Bo1,3*
( 1. College of Landscape Architecture and Horticulture Sciences, Southwest Forestry University, Kunming, 650224; 2. College of Life Sciences, Sichuan University, Chengdu 610065;
3. Southwest Research Center for Landscape Architecture
Engineering, State Forestry and
Grassland Administration, Kunming 650224 )
Abstract:? The purpose of this study was to explore the structural and expression characteristics of LEA2 genes from Brachymenium exile. BeLEA2 gene was firstly isolated and analyzed by polymerase chain reaction (PCR). The results were as follows: (1) Gene structure analysis showed that BeLEA2 gene contained 2 exons and 1 intron and contained an open reading frame (ORF) of 456 bp encoding a protein of 151 amino acids, and its molecular mass was predicted to be 16 515.96 Da. (2) The phylogenetic analysis of LEA2 with other LEA2 in different plants revealed that BeLEA2 from B. exile and LEA2 from Physcomitrella patens belonged to the same branch of evolutionary distance. (3) The promoter sequence of the BeLEA2 gene of? 1 072 bp was isolated from Brachymenium exile by high-efficiency hermal asymmetric interlaced polymerase chain reaction (HiTail-PCR) and analyzed by PlantCARE, the results showed that it had TATA-box, CAAT-box, ABRE, MYB, MYC, MYB binding site and other cis-acting elements. (4) Quantitative real-time PCR analysis indicated that BeLEA2 expressed in different stages and tissues of B. exile, and BeLEA2 responded to dehydration stress. These results lay a foundation for further study on the function of LEA2 gene in bryophytes.
Key words: Brachymenium exile, LEA2 gene, promoter, dehydration stress, expression
水分是植物體生長所必需的重要組成部分,缺水會干擾植物正常的生理活動,而干旱、高溫、鹽堿等逆境都會使植物體細胞大量失水(潘瑞熾, 2012)。同時我國也是世界上鹽堿地面積最多的國家之一,干旱和荒漠化問題非常嚴重(張建鋒等, 2002)。到2014年底,我國土地荒漠化面積約為26 115.93萬hm2,約占我國國土面積的27.20%(屠志方等, 2016)。鹽堿和干旱不僅減緩了我國林業的高速發展,同時也會給我國的生態環境造成很大的破壞。因此,進行耐鹽/耐干旱的研究非常重要。
纖枝短月蘚(Brachymenium exile)屬于真蘚科短月蘚屬(黎興江, 2006),生長在裸露的巖壁和極端干旱的環境中,具有較強的耐干旱能力。苔蘚植物中存在抗氧化防御系統,可以有效地應對外界的干旱脅迫,在面對一些極端的外界環境時可以表現出極強的抗逆性(張萍等, 2005)。通過研究植物的抗逆型基因,探究植物的耐鹽/耐旱機理,培養耐鹽/耐旱作物或林木對保持我國農業生態的可持續發展,改善我國生態環境具有極大的作用。
LEA蛋白(late embryogenisis abundant proteins),即胚胎發育后期豐富蛋白,是植物胚胎發育后期種子中大量積累的一類蛋白,最早發現于棉花胚胎發育后期的子葉中(Dure et al., 1981)。隨后,在擬南芥(Arabidopsis thaliana)、小麥(Triticum aestivum)、番茄(Solanum lycopersicum)、水稻(Oryza sativa)和油菜(Brassica napus)等植物中也同樣發現了LEA蛋白的存在(Wang et al., 2006;Hundertmark & Hincha, 2008;Cao & Li, 2015;Yu et al., 2016;Bhattacharya et al., 2019)。盡管LEA蛋白在植物界中具有較為廣泛的分布,但它并不是植物界所特有的一類蛋白,在真菌、細菌和某些無脊椎動物中也同樣存在LEA蛋白(Tunnacliffe et al., 2005; Shinozaki & Yamaguchi-Shinozaki, 2006; Hand et al., 2007)。
到目前為止,已從多種不同植物中分離出LEA基因的啟動子序列,分析結果表明LEA基因的啟動子中具有不止一種壓力響應相關的順式作用元件,表明LEA 基因與干旱等非生物脅迫的調控密切相關(Huang et al., 2016; I·brahime et al., 2019; Nagaraju et al., 2019)。通過分析LEA基因結構得出,其內含子數目的差異較小,同時內含子數目通常不多于3個,基因結構的保守性較高(Huang et al., 2016; Wu et al., 2018)。
本研究對纖枝短月蘚BeLEA2啟動子基因進行了分離,將纖枝短月蘚與其他植物LEA2基因氨基酸序列加以比對,構建系統進化樹;對纖枝短月蘚進行脫水脅迫處理,并對LEA2基因進行實時熒光定量分析,以期為 LEA2基因的表達特性及其功能研究奠定理論基礎。
1 材料與方法
1.1 植物材料
研究所需纖枝短月蘚采于昆明市郊區,保存于西南林業大學實驗室內。清洗后進行DNA的提取,用于BeLEA2基因和啟動子的克隆。
分別選取兩組長勢相同且良好的纖枝短月蘚,分別選取有性世代和無性世代的配子體部分和孢子體部分。一組采用新鮮植株不予以處理,另一組洗凈后,給予脫水脅迫2 h處理,進行RNA的提取,逆轉錄為cDNA,用于表達分析。
1.2 纖枝短月蘚BeLEA2基因的克隆
采用 TIANGEN公司的小量植物(葉)總DNA抽提試劑盒來提取纖枝短月蘚的基因組DNA,采用OMEGA公司的總RNA提取試劑盒提取纖枝短月蘚的總RNA,選用逆轉錄試劑盒(全式金),將上一步所得的RNA逆轉錄為cDNA。
根據本實驗室的轉錄組測序結果(未公布),設計出該基因特異性引物LEA2-F:ATGGCGGGGTTGT
TGAACAAAG;LEA2-R:TTAGAAGATGTCGGACAGT
GTG。分別以cDNA和DNA為模板,進行PCR擴增。反應體系為2×Taq PCR Master Mix 20 μL:正向引物 1 μL、反向引物1 μL、ddH2O 16 μL、DNA模板2 μL。PCR擴增程序:預變性,95 ℃,3 min;變性,95 ℃,15 s,退火,60 ℃,30 s,延伸,72 ℃,90 s,35個循環;延伸,72 ℃, 10 min;4 ℃保存。PCR產物回收后,將其連接到克隆載體PMD18-T中,送生工生物工程股份有限公司進行測序。
1.3 纖枝短月蘚BeLEA2基因啟動子的克隆
將纖枝短月蘚的DNA作為模板,依照BeLEA2基因DNA全長序列設計出三輪的特異性引物:LEA2-1R:CGAAGACGGTAGGTGATCTCG;LEA2-2R:ACGAT
GGACTCCAGTCCGGCCGTTGTGGATCATGACGTTACT
C;LEA2-3R:GGTGACGTTCCCGATGTCCAC。參照Liu & Chen(2007)的辦法,使用HiTail-PCR方法進行啟動子的擴增分離。
1.4 生物信息學分析
利用ExPASy-ProtParam分析氨基酸的理化性質;使用在線軟件GSDS 2.0分析基因的結構信息;利用NetPhos 3.1 Server軟件預測磷酸化位點;利用NetOGlyc 1.1 Server軟件預測O-糖基化位點;利用NetNGlyc 1.0 Server 預測N-糖基化位點(徐志文等,2019);利用Prot Scale軟件得到蛋白質親疏水性圖;利用SOPMA軟件進行二級結構預測分析;利用Swiss-Model通過同源建模建立三級模型;利用DNAMAN 6.0軟件獲得多序列結構域比對圖;利用MEGA X軟件構建系統進化樹;利用PlantCARE軟件分析基因的啟動子區域中所包括的轉錄調控元件。
1.5 實時熒光定量PCR分析
根據所獲得的BeLEA2基因的序列,設計熒光定量專用引物,L2-F:GCGACAGGGAGATTACCTCC、L2-R:GTCGTAGTCGATATCCCAGTC。內參基因為Actin基因,設計引物A-F:CTGTACGGCAACATCGTGCTG,A-R:CCAGACACTGTACTTCCTCTC,以cDNA為模板,按照TB Green Premix Ex TaqTM Ⅱ說明書進行操作,反應體系為SYBR Premix Ex Taq 10 μL:ROX Reference Dye 0.4 μL、正向引物 0.8 μL、反向引物0.8 μL、ddH2O 6 μL、cDNA模板2 μL。反應程序:預變性,95 ℃,30 s;變性,95 ℃,5 s,退火,60 ℃,30 s,40個循環。每個樣品設置3次重復,使用2-△△Ct 法計算BeLEA2基因的相對變量值。
2 結果與分析
2.1 BeLEA2基因的克隆與結構分析
以纖枝短月蘚cDNA為模板,結合引物LEA2-F和LEA2-R進行PCR擴增,經測序得到456 bp的序列。以DNA為模板,結合引物LEA2-F和LEA2-R進行PCR擴增,經測序得到1 168 bp的序列,得到兩條序列的長度不一致,表明序列中有內含子。
根據轉錄組序列分析表明,該基因包含82 bp 5’UTR和266 bp 3’UTR,其開放閱讀框長度為456 bp,編碼151個氨基酸(圖1)。其基因組序列全長長度為1 168 bp,同時含有1個內含子和2個外顯子(圖2)。經Pfam分析得出,LEA2蛋白在45~140氨基酸位點含有LEA2結構域,表明該基因屬于LEA2家族,將該基因命名為BeLEA2。
2.2 BeLEA2基因的生物信息學分析
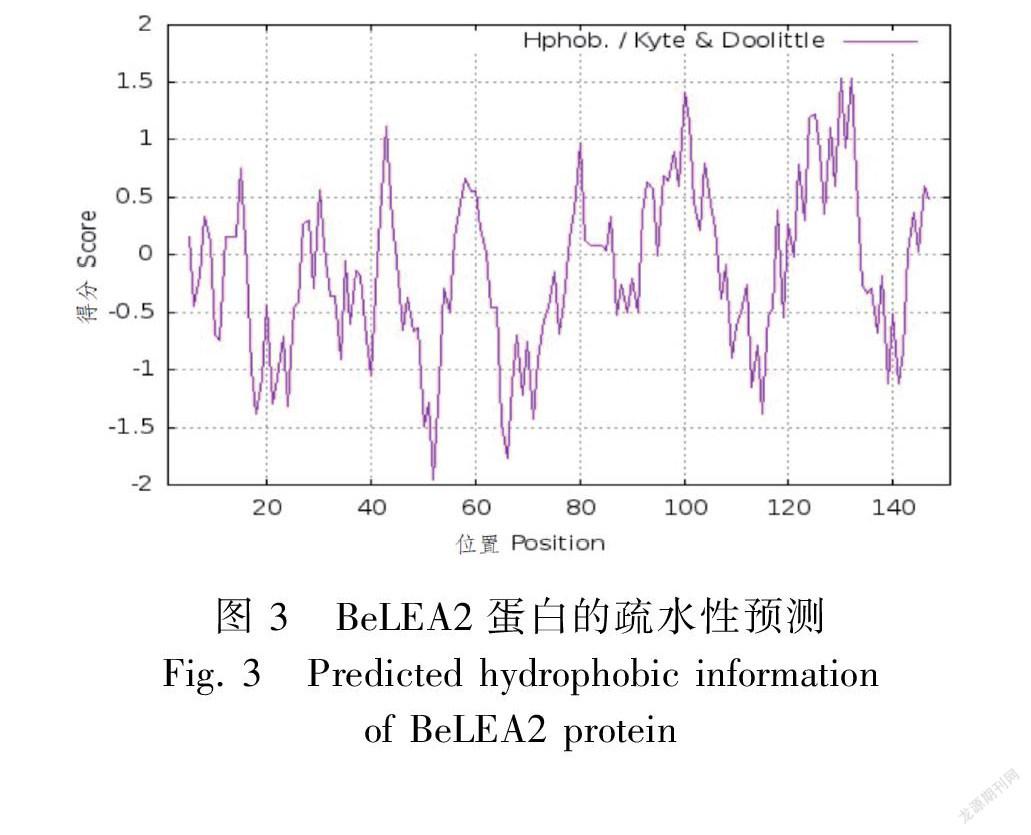
使用ProtParam軟件預測BeLEA2編碼蛋白質的相對分子質量為16 515.96 Da,理論等電點為5.74,分子式為C732H1179N197O224S6。BeLEA2所編碼蛋白的氨基酸組成中,亮氨酸含量最高,占到了總氨基酸的9.9%;其次為纈氨酸和天冬氨酸,分別占總氨基酸的8.6%和9.3%。脂肪系數為101.32,平均親水性為-0.071,是親水蛋白(圖3);不穩定指數為17.01,屬于穩定性蛋白。
預測發現BeLEA2蛋白發生磷酸化修飾的位點共有10個,其中絲氨酸的磷酸化位點和蘇氨酸的磷酸化位點各4個,而酪氨酸的磷酸化位點最少,為2個。BeLEA2蛋白中不含有發生O-糖基化和N-糖基化的位點。
使用SOPMA軟件預測BeLEA2蛋白的二級結構。結果表明,該蛋白二級結構主要由無規則卷曲(Random coil)、β轉角(Beta turn)、延伸鏈(Extended strand)和α螺旋(Alpha helix)構成。其中:無規則卷曲最多,占氨基酸序列的45.03%;其次為延伸鏈和α螺旋,分別占29.80%和21.19%;β轉角最少(3.97%)。通過Swiss-Model對纖枝短月蘚BeLEA2蛋白的三級結構進行預測分析,以擬南芥LEA14蛋白為模板進行同源建模,預測的BeLEA2蛋白三級結構中含有1個α螺旋和10個β折疊。
2.3 BeLEA2基因的啟動子元件
以纖枝短月蘚DNA為模板,通過HiTail-PCR擴增BeLEA2基因啟動子序列,得到了1 072 bp的BeLEA2基因啟動子序列。
通過對啟動子元件進行分析,結果顯示BeLEA2基因啟動子具有典型的CAAT-box和TATA-box元件。在BeLEA2基因啟動子區含大量非生物脅迫響應順式作用元件, 主要包括茉莉酸甲酯響應元件(methyl jasmonate response element,CGTCA-motif);
脫落酸響應元件(abscisic acid responsive element,ABRE);還含有光響應作用元件Sp1和與分生組織有聯系的作用元件CAT-box;與啟動子響應調控或活性有關的元件CCAAT-box;MYB結合位點(MYB binding site,MBS);MYC和MYB元件,這兩類元件都是轉錄因子作用元件,都和ABA或干旱誘導的表達調控有聯系;除此之外,還含有G-box、F-box、A-box、I-box、TCT-motif、TCCC-motif、TGACG-motif、CCGTCC-motif、GATA-motif、GT1-motif等元件,其中ABRE元件含量較高。說明BeLEA2的轉錄將受到這些元件的影響和調控。
2.4 BeLEA2氨基酸序列比對分析
將BeLEA2編碼的氨基酸序列在NCBI數據庫中進行Blastp對比,結果表明其與小立碗蘚(Physcomitrella patens,XP_024360796.1)、海棗(Phoenix dactylifera,XP_008795021.1)、花旗松(Pseudotsuga menziesii,CAA10047.1)、玉米(Zea mays,NP_001142311.1)、甘蔗(Saccharum officinarum,ACT53873.1)、北美云杉(Picea sitchensis,ADM74314.1)、菠蘿(Ananas comosus,OAY80542.1)、高粱(Sorghum bicolor,XP_002441588.1)、黍(Panicum miliaceum,RLN27694.1)、木槿(Hibiscus syriacus,KAE8699781.1)、阿月渾子(Pistacia vera,XP_031249202.1)、月季(Rosa chinensis,XP_024175981.1)的LEA2蛋白同源,并且它們之間的相似性較高。利用DNAMAN 6.0軟件將LEA2和其他物種的氨基酸序列進行多序列比對,結果顯示,BeLEA2蛋白與其他物種LEA2蛋白具有高度的相似性,總體表現為C端較保守,N端保守性較差(圖4)。
2.5 LEA2蛋白系統進化分析
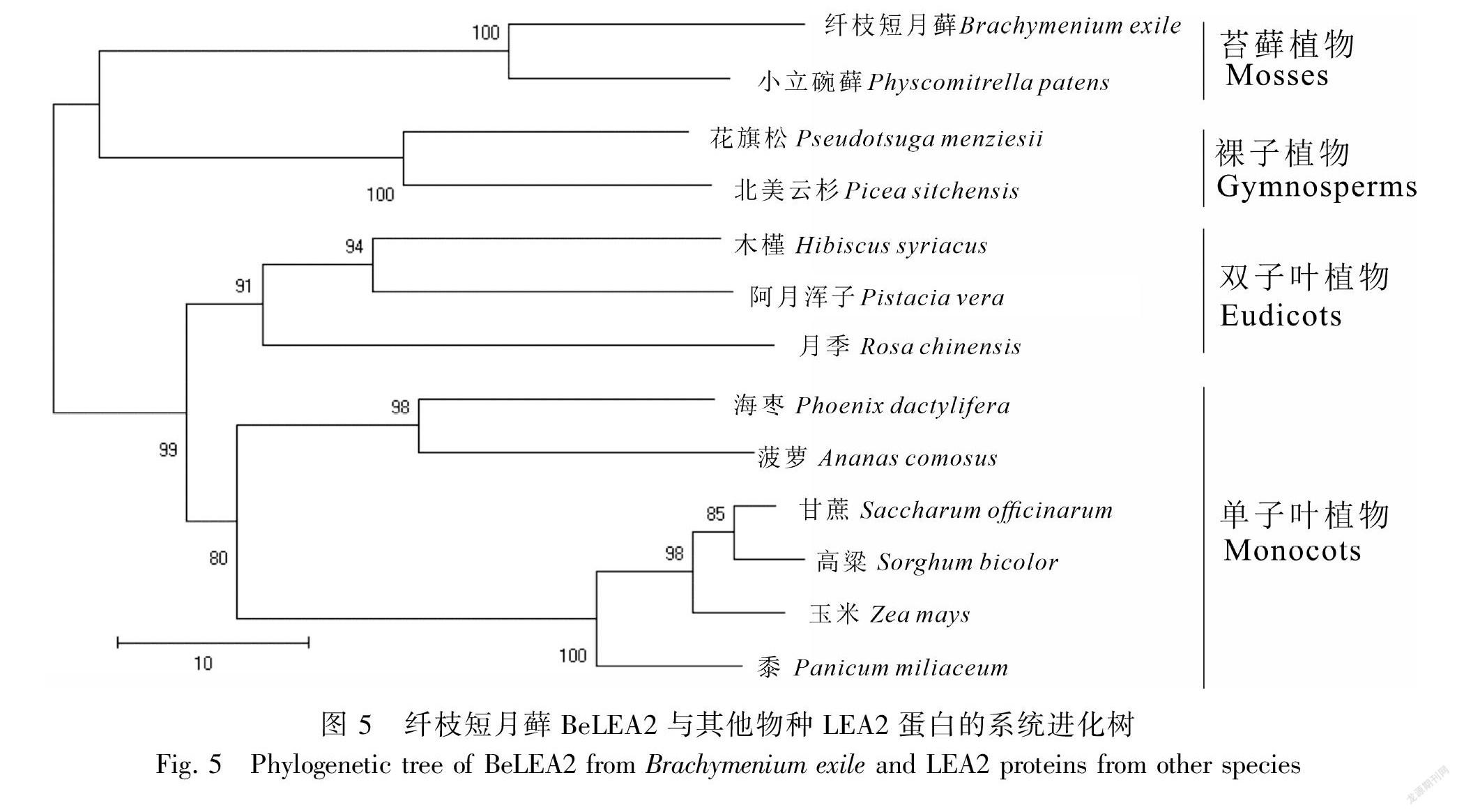
使用MEGA X軟件的近鄰相接法構建纖枝短月蘚LEA2蛋白的系統進化樹,進一步探究BeLEA2蛋白與其他物種的LEA2蛋白的進化關系。由圖5可知,整個系統發育樹分為2個大的分支,纖枝短月蘚首先與小立碗蘚聚為一支,其進化關系最為接近;裸子植物與苔蘚植物聚在一支,其親緣關系比較接近;而單子葉植物和雙子葉植物的LEA2蛋白同屬于兩個不同的分支,同時與纖枝短月蘚有較遠的親緣關系。
2.6 BeLEA2基因實時熒光定量分析
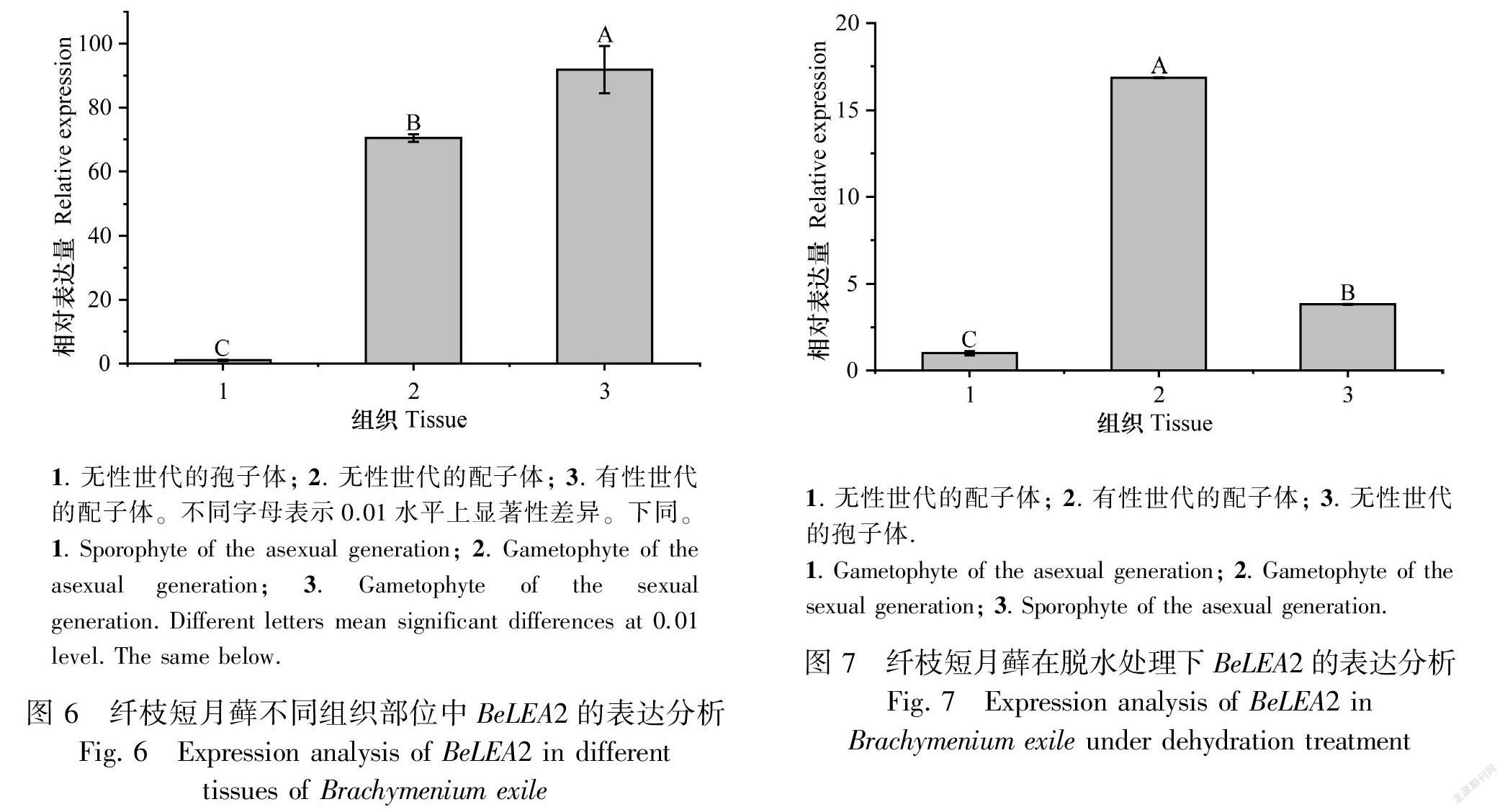
實時熒光定量分析的結果表明,在未作處理的條件下,BeLEA2基因在纖枝短月蘚不同的發育時期和部位中都有表達,特別是在有性世代的配子體中表達量最多, 其次是無性世代的配子體,無性世代的孢子體最低,差異極顯著(圖6)。為了分析BeLEA2是否受到脫水脅迫的誘導,本研究將纖枝短月蘚植株各部位都進行了2 h的自然脫水處理。在脫水脅迫條件下,BeLEA2基因在有性世代的配子體中表達量最高,其次是無性世代的孢子體,無性世代的配子體最低,差異極顯著(圖7)。分析結果證明,不管是正常條件還是脫水脅迫處理,BeLEA2蛋白都在有性世代時期表達量最高,表明BeLEA2基因可能在有性世代的生長發育過程中具有關鍵作用。
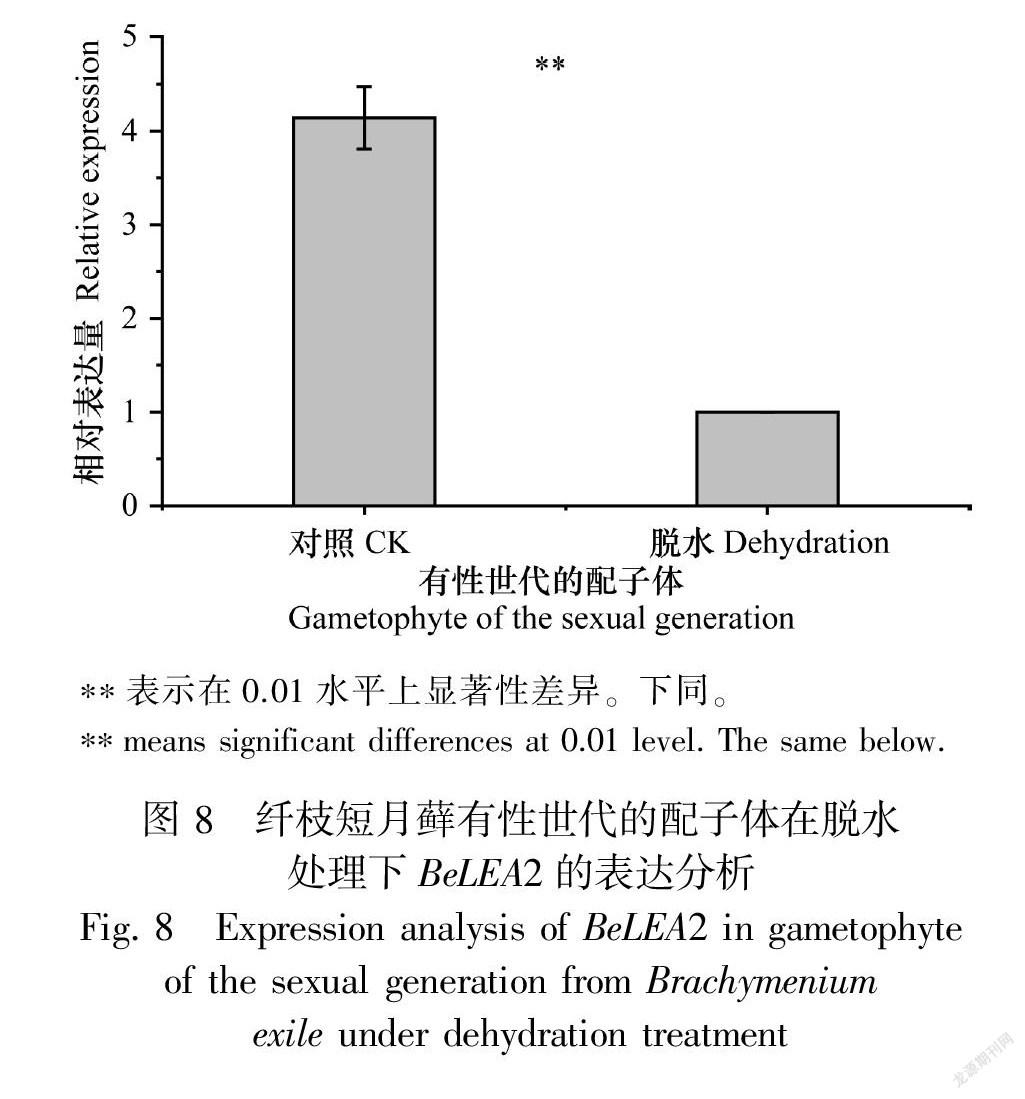
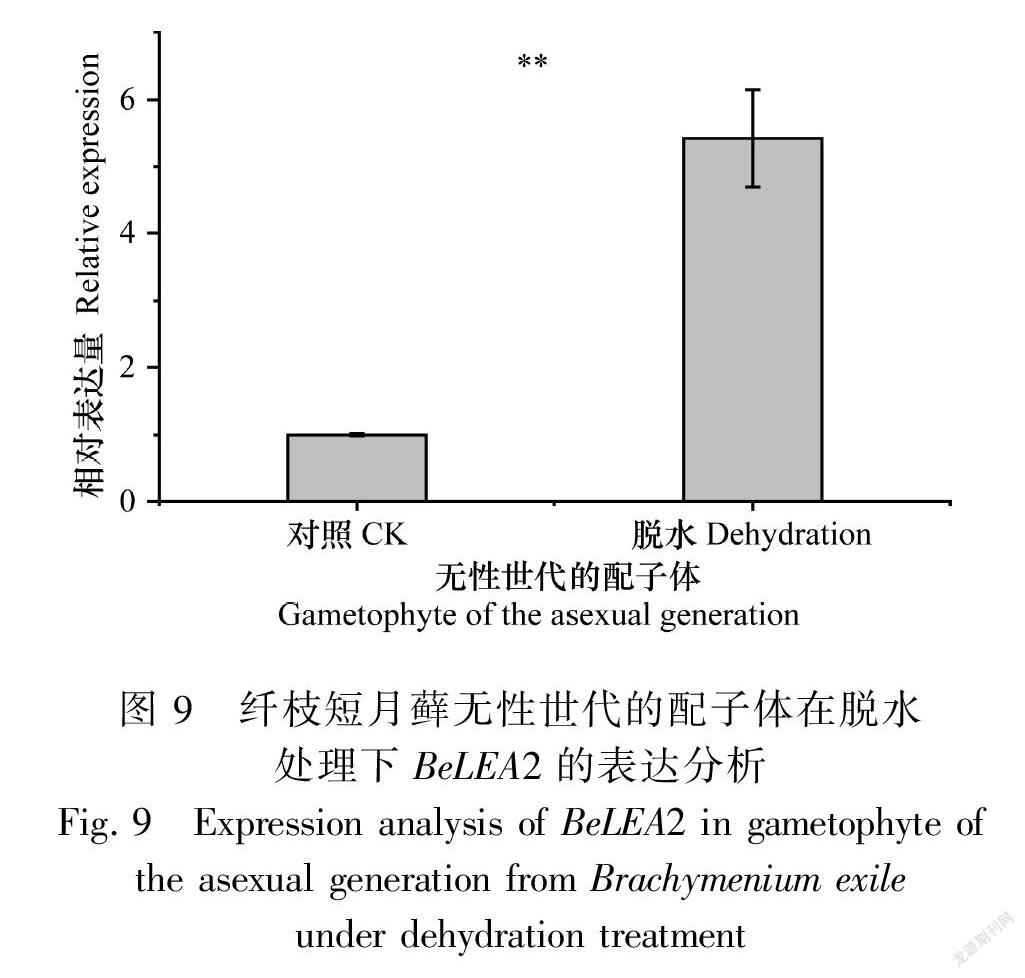
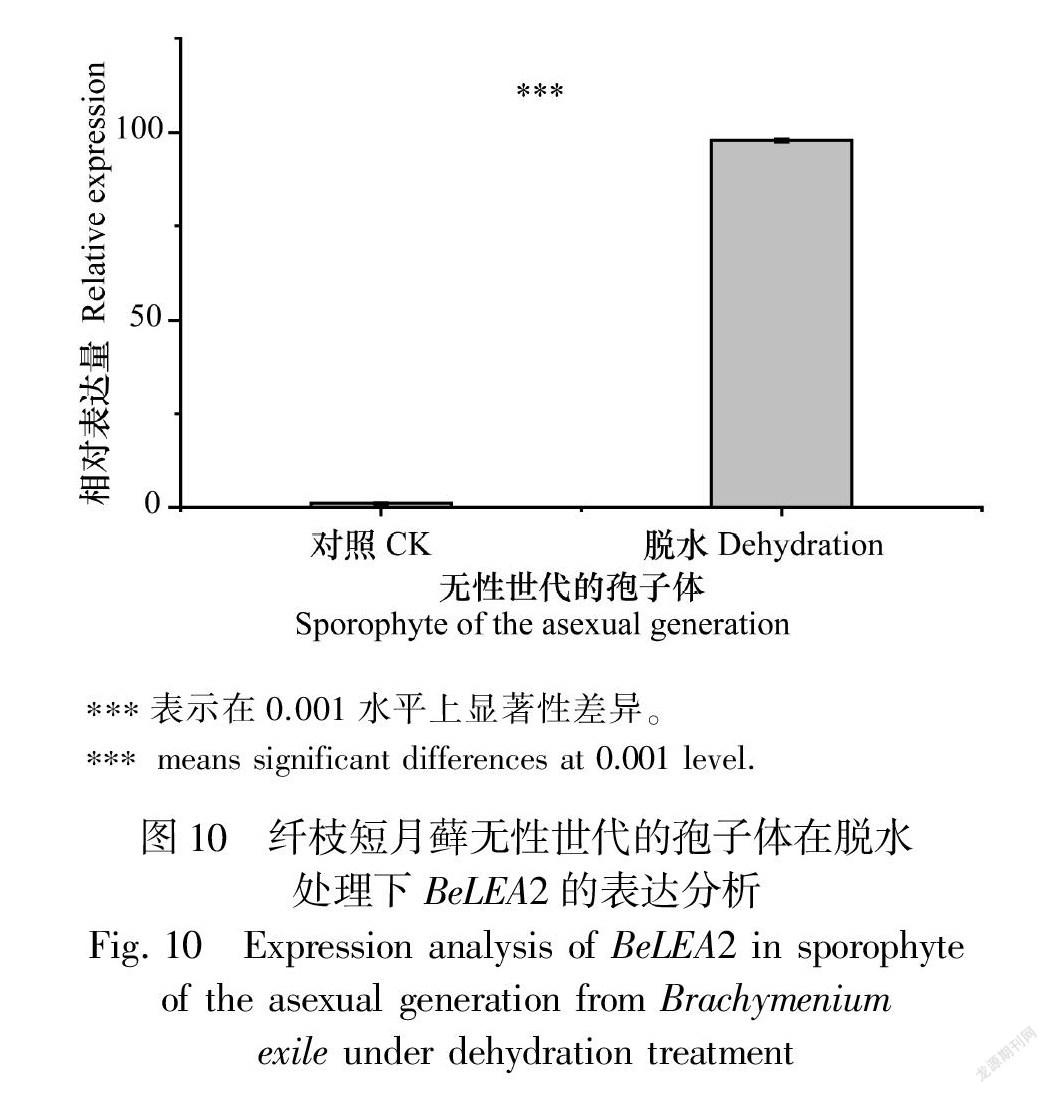
在脫水脅迫下,有性世代時期的配子體表達量降低(圖8),差異顯著;而無性世代時期的配子體表達量增加,約為正常植株的5.4倍(圖9),差異顯著;無性世代時期的孢子體表達量有所上升,約為正常植株的98倍(圖10),差異極為顯著。表明BeLEA2基因可能參與干旱脅迫的響應基因,這與啟動子區順式作用元件預測結果一致,揭示BeLEA2蛋白在脫水條件下可能對孢子體的發育具有重要作用。
3 討論與結論
苔蘚植物是一種結構簡單的小型綠色植物,一直以來都以其特殊的生理結構在植物體的進化研究方面占據著重要地位。苔蘚植物在世界各地均有著廣泛的分布,在潮濕陰暗的地區尤為常見,在高溫、干旱等惡劣環境中仍能夠正常存活。目前,我國土地荒漠化現象日趨嚴重,由于地理特征、氣候環境因素等影響,極易發生干旱、高溫等極端天氣,極大影響了植物的正常生長,甚至造成植物大面積枯萎、死亡。但在某些植物中存在著大量的抗逆機制,在植物面臨脅迫時,可以通過一些功能性蛋白直接參與脅迫響應(Campo et al., 2014)。而LEA蛋白就屬于此類功能性蛋白。根據相關研究和資料表明,LEA基因與干旱等非生物脅迫的調控密切相關(Hundertmark & Hincha, 2008; Magwanga et al., 2017; Muvunyi et al., 2018; I·brahime et al., 2019)。
水稻 (Oryza sativa) 幼苗中,OsLEA19a基因在受到干旱脅迫下會大量表達(胡廷章等,2011);小麥 (Triticum aestivum) 中的TaLEA5基因只有在干旱脅迫時才會表達(劉露露等,2014);將大豆 (Glycine max)LEA基因轉化至大腸桿菌 (Escherichia coli)中,在高鹽脅迫下的存活率大幅度提高(Lan et al., 2005)。綜上所述,LEA基因參與了植物體干旱、高鹽等脅迫的響應,這與本研究結果保持一致。
通過分析可知,BeLEA2基因ORF序列為456 bp,編碼151個氨基酸,根據Pfam數據庫對于LEA蛋白家族的分類,該基因屬于LEA2家族。纖枝短月蘚BeLEA2基因啟動子中不僅含有CAAT-box和TATA-box等基本的元件,同時還有和壓力響應相關的順式作用元件,例如,逆境激素ABA的主要調控元件(ABRE、MYC和MYB)以及MYB的結合位點和茉莉酸甲酯響應元件等元件。推測BeLEA2基因可能會受這些非生物脅迫的調控(Yamaguchi-Shinozaki & Shinozaki, 2005; Du et al., 2013; Huang et al., 2016;李莎莎等,2018; Nagaraju et al., 2019)。這說明BeLEA2在纖枝短月蘚的抗逆性中有非常重要的作用,具有深入研究的價值。
從纖枝短月蘚LEA2建立的系統發育樹分析可以得出:LEA2基因在不同的分類單元中都可以明顯地區分開,傳統分類的系統進化樹和基于LEA2構建的結果一致。值得關注的是,苔蘚植物LEA2基因與裸子植物LEA2基因的系統位置較為接近,這是否反映了它們的LEA2基因很可能具有相近的共同祖先,還需更多的研究資料查證。
實時熒光定量分析表明,不管是未經處理還是經脫水脅迫處理,BeLEA2基因在不同時期及不同部位中皆有表達,且在有性世代時期表達量最高,揭示BeLEA2基因可能在有性世代的生長發育過程中起重要作用。脫水脅迫后,BeLEA2基因表達量變化差異明顯,在有性世代發育時期的表達下降,而在無性世代發育時期表達上升,揭示了該基因在纖枝短月蘚不同生長發育時期對脫水脅迫的響應機制可能不同。
本研究首次從纖枝短月蘚中克隆分析了BeLEA2基因,并進行了初步表達分析,結果顯示纖枝短月蘚中BeLEA2基因在脫水脅迫時有較高的表達,表明BeLEA2基因參與了纖枝短月蘚脫水脅迫的響應。本研究對深入了解LEA2基因在苔蘚植物生長發育過程中的功能,分析LEA2蛋白植物抗逆的分子機制以及深入探究苔蘚植物的抗逆機制具有重要意義。
參考文獻:
BHATTACHARYA S, DHAR S, BANERJEE A, et al., 2019. Structural, functional, and evolutionary analysis of late embryogenesis abundant proteins (LEA) in Triticum aestivum: A detailed molecular level biochemistry using in silica approach [J]. Comput Biol Chem, 82: 9-24.
CAO J, LI X, 2015. Identification and phylogenetic analysis of late embryogenesis abundant proteins family in tomato (Solanum lycopersicum) [J]. Planta, 241(3): 757-772.
CAMPO S, BALDRICH P, MESSEGUER J, et al., 2014 Overexpression of a calcium-dependent protein kinase confers salt and drought tolerance in rice by preventing membrane lipid peroxidation [J]. Plant Physiol, 165(2): 688.
DU DL, ZHANG QX, CHENG TR, et al., 2013. Genome-wide identification and analysis of late embryogenesis abundant (LEA) genes in Prunus mume [J]. Mol Biol Rep, 40(2): 1937-1946.
DURE L, GREENWAY SC, GALAU GA, 1981. Developmental biochemistry of cottonseed embryogenesis and germination: changing messenger ribonucleic acid populations as shown by in vitro and in vivo protein synthesis [J]. Biochemistry-USA, 20(14): 4162-4168.
HAND S, JONES D, MENZE M, et al., 2007. Life without water: expression of plant LEA genes by an anhydrobiotic arthropod [J]. J Exp Zool, 307(1): 62-66.
HU YZ, WU YM, CHEN ZG, et al., 2011. Molecular cloning, expression character and bioinformatics analysis of OsLEA19a from rice [J]. Acta Agric Boreal-Sin, 26(6): 73-78.?? [胡廷章, 吳應梅, 陳再剛, 等, 2011. 水稻OsLEA19a基因的克隆、表達及生物信息學分析 [J]. 華北農學報, 26(6): 73-78.]
HUANG Z, ZHONG XJ, HE J, et al., 2016. Genome-wide identification, characterization, and stress-responsive expression profiling of genes encoding LEA (late embryogenesis abundant) proteins in Moso Bamboo (Phyllostachys edulis) [J]. PLoS ONE, 11(11): e0165953.
HUNDERTMARK M, HINCHA DK, 2008. LEA (Late Embryogenesis Abundant) proteins and their encoding genes in Arabidopsis thaliana [J]. BMC Genet, 9(1): 118.
I·BRAHIME M, KIBAR U, KAZAN K, et al., 2019. Genome-wide identification of the LEA protein gene family in grapevine (Vitis vinifera L.) [J]. Tree Genetics & Genomes, 15(4): 55.
LAN Y, CAI D, ZHENG YZ, 2005. Expression in Escherichia coli of three different soybean late embryogenesis abundant (LEA) genes to investigate enhanced stress tolerance [J]. J Integr Plant Biol, 47(5): 613-621.
LIANG Y, XIONG ZY, ZHENG JX, et al., 2016. Genome-wide identification,structural analysis and new insights into late embryogenesis abundant (LEA) gene family formation pattern in Brassica napus [J]. Sci Rep, 6(1): 24265.
LI SS, DU TZ, AN KL, et al., 2018. Identification and expression analysis of SmLEA gene family in Salvia miltiorrhiza [J]. J Agric Biol Biotechnol, 26(9): 1514-1526.? [李莎莎, 杜堂志, 安克莉, 等, 2018. 丹參SmLEA家族基因的鑒定和表達分析 [J]. 農業生物技術學報, 26(9): 1514-1526.]
LI XJ, 2006. Flora bryophtorum Sinicorum [M]. Beijing: Science Press.? [黎興江,2006. 中國苔蘚志 [M]. 北京: 科學出版社.]
LIU LL, CHEN L, ZHANG CY, et al., 2014. Characterization of two LEA genes and their response to abiotic stresses in wheat [J]. Chin Agric Sci, 47(19): 3736-3745.? [劉露露,陳雷,張春艷,等,2014. 兩個小麥LEA基因的特征及其對非生物脅迫的響應 [J]. 中國農業科學, 47(19): 3736-3745.]
LIU YG, CHEN Y, 2007. High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences? [J]. Biol Technique, 43(5): 649-656.
MAGWANGA R, LU P, KIRUNGU J, et al., 2017. Characterization of the late embryogenesis abundant (LEA) protein family and their role in drought stress tolerance in upland cotton [J]. BMC Genet, 19(1): 6.
MUVUNYI BP, YAN Q, WU F, et al., 2018. Mining late embryogenesis abundant (LEA) family genes in Cleistogenes songorica, a xerophyte perennial desert plant [J]. Int J Mol Sci, 19(11): 6.
NAGARAJU M, KUMAR SA, REDDY PS, et al., 2019.Genome-scale identification, classification, and tissue specific expression analysis of late embryogenesis abundant (LEA) genes under abiotic stress conditions in Sorghum bicolor L. [J]. PLoS ONE, 14(1): e0209980.
PAN RZ, 2012. Plant physiology [M]. Beijing: Higher Education Press.? [潘瑞熾, 2012. 植物生理學 [M]. 北京: 高等教育出版社.]
SHINOZAKI K, YAMAGUCHI-SHINOZAKI K, 2006. Gene networks involved in drought stress response and tolerance [J]. J Exp Bot, 58(2): 221-227.
TU ZF, LI MX, SUN T, 2016. The status and trend analysis of desertification and sandification [J]. For Resourc Manag, (1): 1-5.? [屠志方, 李夢先, 孫濤, 2016. 第五次全國荒漠化和沙化監測結果及分析 [J]. 林業資源管理, (1): 1-5.]
TUNNACLIFFE A, LAPINSKI J, MCGEE B, 2005. A putative LEA protein, but no trehalose, is present in anhydrobiotic bdelloid rotifers [J]. Hydrobiologia, 546(1): 315-321.
WANG XS, ZHU HB, JIN GL, et al., 2006. Genome-scale identification and analysis of LEA genes in rice (Oryza sativa L.) [J]. Plant Sci, 172(2): 414-420.
WU CL, HU W, YAN Y, et al., 2018. The late embryogenesis abundant protein family in cassava (Manihot esculenta Crantz): genome-wide characterization and expression during abiotic stress [J]. Molecules, 23(5): 1196.
XU ZW, REN XM, ZHAO M, et al., 2019. Cloning and expression analysis of storage protein hexamerin genes in Tenebrio molitor [J]. J SW For Univ (Nat Sci Ed), 39(4): 96-102.? [徐志文, 任雪敏, 趙滿, 等, 2019. 黃粉甲儲存蛋白hexamerin基因的克隆及表達分析 [J]. 西南林業大學學報(自然科學版), 39(4): 96-102.]
YAMAGUCHI-SHINOZAKI K, SHINOZAKI K, 2005. Organization of cis-acting regulatory elements in osmotic- and cold-stress-responsive promoters [J].Trends Plant Sci, 10(2): 88-94.
ZHANG JF, SONG YM, XING SJ, et al., 2002. Saline soil amelioration and forestation techniques [J]. J NE For Univ, 30(6): 124-129.? [張建鋒, 宋玉民, 邢尚軍, 等, 2002. 鹽堿地改良利用與造林技術 [J]. 東北林業大學學報, 30(6): 124-129.]
ZHANG P, BAI XL, ZHONG XL, 2005. Advances in the desiccation tolerance of mosses [J]. Bull Bot, 22(1): 107-114.? [張萍, 白學良, 鐘秀麗, 2005. 苔蘚植物耐旱機制研究進展 [J]. 植物學通報, 22(1): 107-114.]
(責任編輯 周翠鳴)
收稿日期:? 2020-07-22
基金項目:? 國家自然科學基金(31160177);云南省高校科技創新團隊支持計劃項目 [Supported by National Natural Science Foundation of China(31160177); Project for Innovative Research Team (in Science and Technology) in Colleges and Universities of Yunnan Province]。
第一作者: 李雪寶(1994-),碩士研究生,研究方向為植物分子生物學,(E-mail)421043791@qq.com。
*通信作者:? 鄢波,博士,教授,主要從事植物分子生物方向研究工作,(E-mail)yanbodr@aliyun.com。
2404501186214

