農桿菌介導的香榧幼胚遺傳轉化體系
周佳君,胡恒康,龔 麗,干安格,喻衛武,吳家勝,黃堅欽,張啟香
(1. 浙江農林大學 林業與生物技術學院,浙江 杭州 311300;2. 浙江農林大學 省部共建亞熱帶森林培育國家重點實驗室,浙江 杭州 311300)
香榧Torreya grandis ‘Merrillii’ 隸屬于紅豆杉科Taxaceae榧樹屬Torreya常綠喬木,是中國特有的珍稀堅果植物,具有重要的經濟、社會和生態價值[1]。由于香榧生物學周期長,性狀易受環境等因子影響,限制了其育種工作的開展。目前,有關香榧體胚誘導、增殖和離體器官培養再生植株的研究已有一定進展,但關于利用基因工程改良香榧育種的研究尚未見報道[2]。基因工程是生物技術的核心,利用基因工程進行林木遺傳改良,以提高作物產量、改善品質、增強抗性是林木分子育種的最有效途徑之一[3]。1986年,研究人員通過農桿菌Agrobacterium tumefaciens介導法在楊樹Populus trichocarpa×deltoides中成功開展遺傳轉化,開創了林木遺傳轉化研究的先河[4]。目前,林木基因轉化方法已達10余種,其中,農桿菌介導法因具有操作簡單、拷貝數低、轉化效率高、重復性好、發生基因沉默率低等優點而被廣泛應用[5]。隨著木本植物遺傳轉化研究的不斷發展,蘋果Malus pumila等重要果樹農桿菌介導的遺傳轉化體系也相繼建立,為經濟林果樹種定向育種提供了高效的方法和手段。1989年,率先成功實現蘋果轉基因[6],包括早花、矮化、抗病等基因的轉化,且有多個品種已成功獲得轉基因植株。1996年,梨Pyrus communis的遺傳轉化首見報道[7]。目前,在豆梨P. calleryanana和砂梨P. pyrifolia等均有報道。此外,櫻桃Prunus cerasus、李P. salicina等其他水果也實現了遺傳轉化。然而,果樹的遺傳轉化研究大多數集中于水果,對于堅果樹種遺傳轉化的研究尚處于起步階段[8]。堅果為包裹著堅硬外殼的植物種子統稱[9]。堅果類食品富含不飽和脂肪酸,具有較好的抗氧化和抗衰老活性,對心腦血管等疾病具有良好的預防作用[10]。堅果分為樹堅果和籽堅果。樹堅果是指具有堅硬外殼的木本植物的籽粒,包括核桃Juglans regia、巴旦木Amygdalus communis、榛子Corylus heteropylla、山核桃Carya cathayensis、香榧等。堅果樹種多數為多年生木本植物,組織細胞中含有大量的酚類化合物和單寧等物質,導致采用基因工程技術進行種質資源創新難度較大[11]。目前,樹堅果中核桃的基因工程技術研究進展最為深入。自從MCGRANAHAN等[12]1988年成功開展了農桿菌介導的核桃遺傳轉化以來,科學家已對多個核桃樹種進行了基因組測序[13?14],構建了良好的遺傳轉化體系[15],并對多個重要基因開展了功能驗證,獲得了多份創新種質資源,開創了果樹基因工程的新局面[16]。香榧作為一種重要的樹堅果,基因工程研究進展緩慢,遺傳轉化體系尚不成熟,限制了香榧種質創新和產業發展。本研究以香榧幼胚為轉基因受體材料,從幼胚胚齡的選擇、農桿菌侵染濃度和時間、羧芐青霉素質量濃度以及陽性篩選時潮霉素質量濃度對香榧遺傳轉化條件進行探索和優化,利用綠色熒光蛋白(GFP)信號檢測分析轉化效率,并通過聚合酶鏈式反應(PCR)檢測進行陽性鑒定,以期初步建立農桿菌介導的香榧遺傳轉化體系,為香榧重要基因功能驗證及種質創新提供重要技術體系。
1 材料與方法
1.1 材料
1.1.1 植物材料 于 2018年 7月 5—26日 (種子突破種鱗后第 8~11周,以下簡稱第 8~11周)采集生長健壯的香榧種子,經消毒后,用無菌修枝剪從種子榧眼端(珠孔端)縱向剪開,剝取完整幼胚(圖1A~D)待用。具體消毒步驟參照龔麗等[17]的方法。

圖1 香榧種子及幼胚發育表型動態Figure 1 Characters of seeds and immature embryos of T. grandis ‘Merrillii’
1.1.2 載體及農桿菌菌株 采用攜帶 GFP 報告基因的 pCAMBIA1300-GFP載體,內含卡那霉素抗性基因和潮霉素抗性基因[18];農桿菌菌株GV3101。
1.2 方法
1.2.1 農 桿 菌 介 導 香 榧 幼 胚 遺 傳 轉 化 ① 農 桿 菌 的 活 化 與 培 養 。 將 ?80 ℃ 冰 箱 中 保 存 的 攜帶pCAMBIA1300-GFP載體的GV3101農桿菌菌株接種至含有50 mg·L?1卡那霉素的LB固體培養基中劃線培養,28 ℃恒溫培養箱活化培養2 d。挑取若干單菌落分別放置于盛有附加50 mg·L?1卡那霉素和50 mg·L?1利福平的LB液體培養基的無菌離心管中,28 ℃恒溫振蕩培養箱繼續培養,至菌液混濁。②侵染液的制備。取上述適量菌液稀釋10倍,分光光度計下測定吸光度[D(600)]。侵染液制備所需菌液體積按照如下公式計算:所需菌液量(mL)=[所需侵染量(mL)×所需菌液D(600)]/[實測D(600)×10]。計算得出所需菌液體積后,在超凈工作臺上用移液槍吸取所需菌液至無菌帶蓋離心管中6 000 r·min?1轉速下離心10 min,棄上清液,加入 2 mL 含有 0.1 mg·L?1萘乙酸和 40.0 mg·L?1乙酰丁香酮的 1/2 SH 液體共培養基,吸打混勻成懸浮液后,再加液體共培養基至所需菌液侵染量,將離心管放回至28 ℃恒溫振蕩培養箱繼續培養1~2 h,待用。
1.2.2 香榧幼胚遺傳轉化條件優化 ①香榧幼胚最佳胚齡篩選。采用第8~11周的香榧幼胚,用農桿菌侵染[D(600)為0.5],并添加乙酰丁香酮共培養后接種至農桿菌脫菌培養基(1/2 SH+0.1 mg·L?1萘乙酸+2.0 g·L?1活性炭+30.0 g·L?1蔗糖+200.0 mg·L?1羧芐青霉素+12.0 g·L?1瓊脂)培養 4周,分別統計篩選過程中香榧幼胚的污染率、成活率、愈傷組織誘導率以及體細胞胚(簡稱體胚)發生率。每個處理重復3次,每次處理30個幼胚。②最佳農桿菌侵染吸光度篩選。將農桿菌菌液吸光度設置為4個水平[D(600)為0.3、0.5、0.8、1.0],對香榧幼胚侵染15 min,乙酰丁香酮共培養3 d后接種至脫菌培養基(同①)培養4周,統計幼胚污染率、成活率、愈傷組織誘導率和體胚發生率,確定適宜轉化用的菌液濃度。每個處理重復3次,每次處理30個幼胚。③最佳農桿菌侵染時間篩選。采用 D(600)為0.5的農桿菌菌液對幼胚分別侵染5、10、15、20、30 min,共培養3 d后轉接至脫菌培養基(同①)培養4周,統計污染率、成活率、愈傷組織誘導率以及體胚發生率,以確定適宜轉化用的菌液濃度。每個處理重復3次,每次處理30個幼胚。④最佳羧卞青霉素質量濃度篩選。將共培養后的香榧幼胚接種在含有 0.1 mg·L?1萘乙酸和不同質量濃度羧卞青霉素(100、200、300、400 mg·L?1)的1/2 SH固體培養基中進行抗生素質量濃度篩選。每個處理重復3次,3 d繼代培養1次,4周后統計污染率、成活率、愈傷組織誘導率以及體胚發生率,以確定適宜的羧芐青霉素質量濃度。
1.2.3 農桿菌介導香榧幼胚遺傳轉化和抗性篩選 選取生長良好的香榧幼胚在最佳濃度農桿菌侵染液中,懸浮培養最佳侵染時間后,將幼胚轉接至附加萘乙酸(0.1 mg·L?1)和乙酰丁香酮(40 mg·L?1)的1/2 SH固體培養基中共培養3 d后,再轉接至脫菌培養基(1.2.2節④篩選出的最佳培養基)中培養至無菌。具體步驟參照ZHANG等[8]的方法。將脫菌后的香榧幼胚接種至附加0.1 mg·L?1萘乙酸和質量濃度分別為 50、80、100、200 mg·L?1潮霉素的 1/2 SH 固體培養基中進行篩選培養,2周后轉接至附加 0.1 mg·L?1萘乙酸和100 mg·L?1潮霉素的1/2 SH固體培養基中進行篩選培養,隔2 d轉接1次至完全脫菌并獲得潮霉素抗性幼胚。
1.2.4 綠色熒光蛋白基因GFP 熒光信號陽性檢測和PCR鑒定 將經潮霉素篩選的抗性幼胚置于體式顯微鏡(SteREO Discovery V1)下進行450~490 nm藍光激發,表面能觀察到明亮綠色熒光的幼胚為GFP熒光信號陽性幼胚。選取潮霉素基因和GFP綠色熒光鑒定均為陽性的幼胚培養材料,利用TPS法提取DNA。利用 GFP 基因引物 (GFP-F: 5′-GACGCACAATCCCACTATCCTT-3′, GFP-R: 5′-AACCGATGATAC GAACGAAAGC-3′),以上述提取的DNA為模板進行GFP基因的PCR擴增[PCR程序為:94 ℃ 2 min;98 ℃ 10 s;68 ℃ 45 s (32個循環);72 ℃ 10 min;4 ℃ 保存 ],目的片段大小為 750 bp。PCR 程序結束后,10 g·kg?1瓊脂糖凝膠電泳檢測,條帶符合預期大小的確定為轉化成功的香榧幼胚培養物。
1.3 數據統計與圖像處理
受體材料污染率、成活率及GFP陽性率等數據采用SPSS 20.0軟件進行統計分析,其中包括平均值和方差分析。計算公式如下:污染率=污染幼胚數/侵染總體胚數×100%;成活率=成活幼胚數/侵染總體胚數×100%; GFP陽性率=GFP陽性幼胚數/成活幼胚數×100%。
2 結果與分析
2.1 香榧幼胚遺傳轉化條件的優化
2.1.1 香榧幼胚胚齡對遺傳轉化的影響 本研究采用處于第8~11周的香榧幼胚為材料進行農桿菌介導的遺傳轉化(圖1E~H)。第8~11周分別為胚胎選擇初期、胚胎選擇中期、胚胎選擇晚期和優勢胚完全發育期。結果表明(表1):4個胚齡的幼胚轉化過程中污染率和成活率均存在顯著差異(P<0.05)。隨著香榧幼胚齡的增加,抗逆性增強,污染率降低,成活率提高。第10周和第11周成活率分別為52.1%和52.3%。香榧幼胚胚性感受態具有較大差異,第10周時愈傷組織誘導率下降為17.9%,但體胚發生率最高,達17.3%;第11周時愈傷組織誘導率和體胚發生率均下降,分別為10.7%和5.6%。盡管香榧第8~11周幼胚均可用于農桿菌介導的遺傳轉化,但綜合污染率、成活率、愈傷組織誘導率和體胚發生率均表明采用第10周香榧幼胚進行農桿菌介導的遺傳轉化效果最佳。
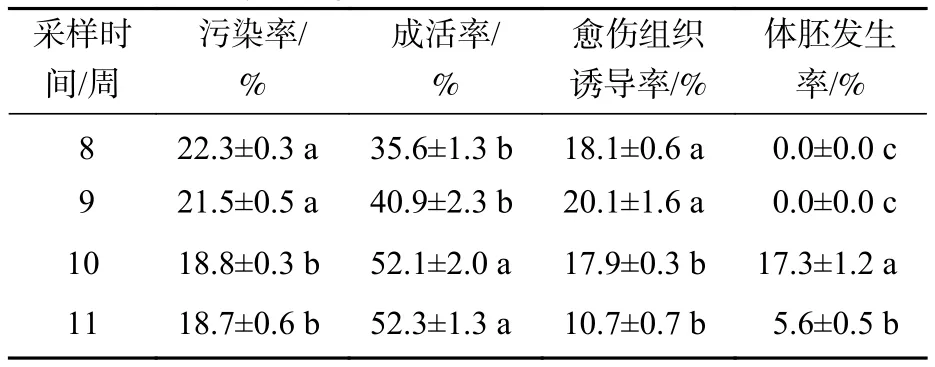
表1 香榧幼胚胚齡對遺傳轉化的影響Table 1 Different growth stages of embryos on the transformation efficiency in T. grandis ‘Merrillii’
2.1.2 農桿菌菌液吸光度對香榧幼胚遺傳轉化的影響 表2表明:隨著菌液D(600)的升高,污染率逐漸上升,成活率逐漸下降。過高的污染率會增加大量的前期采樣、滅菌、侵染、共培養及后期脫菌培養的工作量。當菌液D(600)=0.3時,污染率最低,成活率最高,但愈傷組織誘導率和體胚發生率都比D(600)=0.5時低。隨著D(600)的升高,愈傷組織誘導率和體胚發生率先上升后下降。當D(600)=0.5時,愈傷組織誘導率和體胚發生率最高,分別為17.9%和17.3%。因此,綜合考慮,D(600)=0.5時是最佳侵染濃度(表2)。

表2 農桿菌菌液濃度對香榧幼胚遺傳轉化的影響Table 2 Different concentrations of bacteria on the impact of transformation in T. grandis ‘Merrillii’
2.1.3 農桿菌菌液侵染時間對香榧幼胚轉化的影響 表3表明:隨著侵染時間的延長,污染率逐漸升高,成活率逐漸下降,侵染5 min時,污染率最低,成活率最高;當侵染30 min時,污染率最高,達100%。不同侵染時間下,各處理間愈傷組織誘導率和體胚發生率均存在顯著差異(P<0.05),侵染10 min時,愈傷組織誘導率和體胚發生率均為最高,分別達17.5%和17.1%;侵染20~30 min時,愈傷組織誘導率和體胚發生率均下降至0。綜合以上指標,選擇10 min為最佳侵染時間。
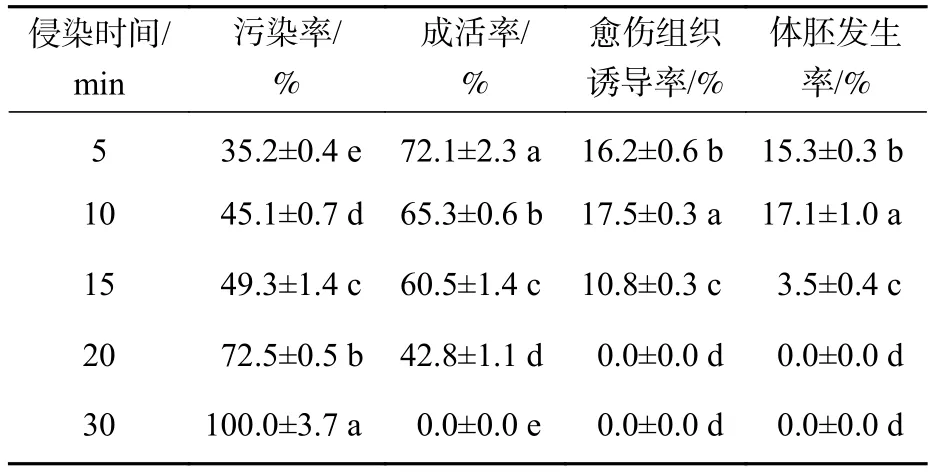
表3 農桿菌菌液不同侵染時間對香榧幼胚遺傳轉化的影響Table 3 Effect of different infection times on transformation in T.grandis ‘Merrillii’
2.1.4 羧芐青霉素質量濃度對香榧幼胚攜帶農桿菌抑制的影響 本研究選用的農桿菌種類為堿型GV3101菌株,因此,在前期研究的基礎上,選用羧芐青霉素為農桿菌脫菌抗生素。表4表明:香榧幼胚成活率隨著羧芐青霉素質量濃度的升高先上升后下降,當羧芐青霉素質量濃度為300 mg·L?1時成活率最高,為60.5%。隨著羧芐青霉素質量濃度的升高,愈傷組織誘導率和體胚發生率均呈先上升后下降的趨勢,當質量濃度為300 mg·L?1時,愈傷組織誘導率和體胚發生率最高,分別為15.8%和17.5%。因此,最佳羧芐青霉素質量濃度為 300 mg·L?1。

表4 羧芐青霉素質量濃度對香榧幼胚農桿菌脫除的影響Table 4 Effects of carboxypenicillin concentration on the removal of Agrobacterium tumebii from T. grandis ‘Merrillii’ embryos
2.2 香榧陽性幼胚鑒定
2.2.1 香榧陽性幼胚培養物潮霉素鑒定 表5表明:隨著潮霉素質量濃度的升高,幼胚成活率逐漸下降,當潮霉素質量濃度為50 mg·L?1時,成活率最高,為62.1%;當潮霉素質量濃度升高至100 mg·L?1時,成活率下降至30.5%,但當潮霉素質量濃度繼續升高至 200 mg·L?1,香榧幼胚培養物的成活率基本不變。當潮霉素質量濃度為 50~100 mg·L?1時,各處理間愈傷組織誘導率和體胚發生率無顯著性差異;當潮霉素質量濃度升高至200 mg·L-1時,愈傷組織誘導率和體胚發生率均顯著下降(P<0.05)。因此, 100 mg·L?1為篩選抗性幼胚培養物的潮霉素最佳質量濃度。

表5 潮霉素質量濃度對香榧幼胚培養物潮霉素陽性篩選的影響Table 5 Effect of hygromycin concentration on positive screening of T.grandis ‘Merrillii’ embryo culture
2.2.2 香榧遺傳轉化幼胚GFP熒光表達 將通過篩選的潮霉素抗性幼胚置于體式顯微鏡下進行藍光激發(490 nm)。結果發現:潮霉素抗性幼胚培養物中,白光視野下,胚胎選擇期(第8~10周)幼胚培養物呈現乳白色至淡黃色,藍光視野下呈現明亮的綠色熒光,各胚齡間GFP熒光陽性率無顯著性差異,為75.5%~78.3%;優勢胚完全發育期(第11周)GFP熒光陽性率較低,為53.0%,且幼胚不同部位的熒光表達量不一致,其中相對成熟的部位熒光表達量較低,生長旺盛單位熒光表達量較高,呈現明亮的綠色;對照幼胚培養物在白光下呈現乳白色至淡黃色,藍光視野中無熒光激發,呈現黑色(圖2)。
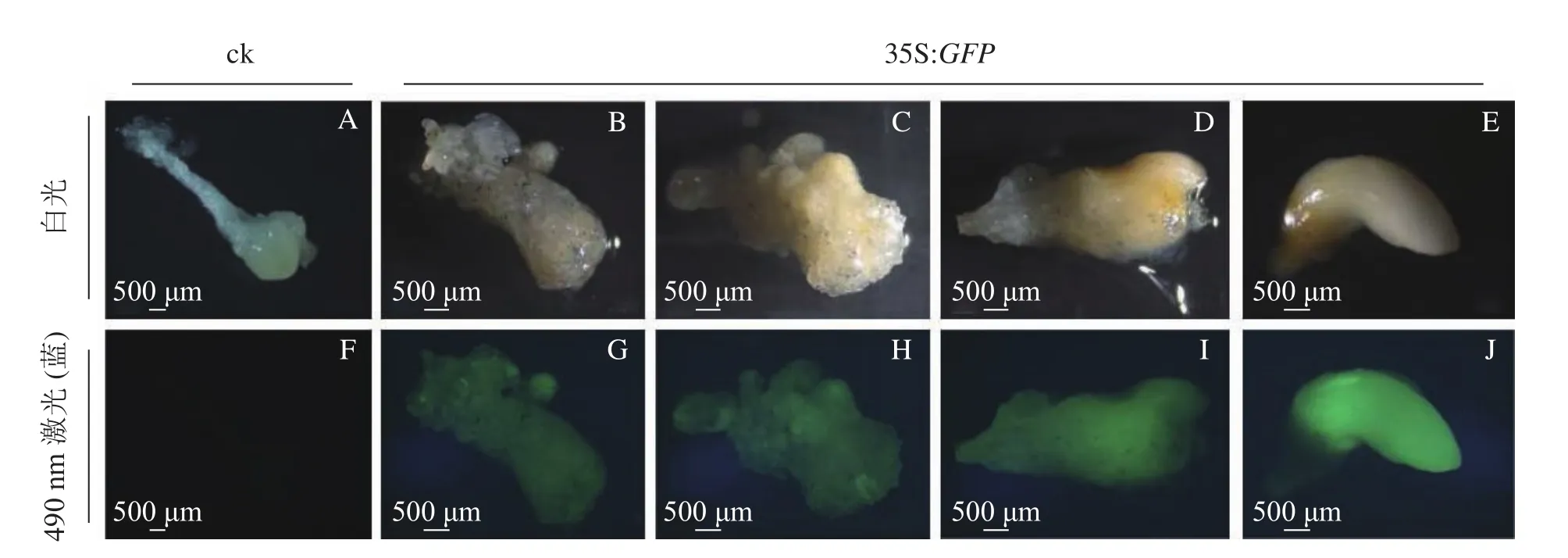
圖2 綠色熒光蛋白在香榧潮霉素抗性幼胚培養物中表達Figure 2 Green fluorescent protein GFP gene expressed stably in T. grandis ‘Merrillii’
2.2.3 香榧陽性幼胚 GFP 基 因鑒定 為進一步排除GFP綠色熒光假陽性,本研究選取具有潮霉素抗性且GFP強熒光信號表達的香榧幼胚培養物提取DNA并進行PCR擴增,并以同時接種未轉化的幼胚為對照。香榧GFP熒光陽性幼胚培養物提取DNA進行PCR檢測結果表明(圖3):75%的攜帶潮霉素抗性且GFP熒光陽性香榧幼胚培養物可擴增出目的條帶,長度約750 bp,符合預期大小(泳道3~8),而對照幼胚培養物相應無條帶(泳道1~2),表明GFP基因已成功轉入香榧幼胚。

圖3 香榧培養物 DNA 的 PCR 擴增產物電泳圖Figure 3 PCR amplification products of transgenic somatic and control somatic embryos DNA in T. grandis ‘Merrillii’
3 討論
3.1 受體材料對農桿菌介導遺傳轉化的影響
在木本植物遺傳轉化中,常用的受體材料一般有花序、葉片、體細胞胚、胚性愈傷組織、合子胚、下胚軸、原生質體、莖尖及花粉等[19]。目前,林木遺傳轉化研究多以胚性愈傷組織、合子胚和體細胞胚為受體材料[20]。
有研究表明:同一外植體的不同部位對農桿菌轉化效率也不同[21],胡楊Populus euphratica在遺傳轉化時使用葉片的轉化率高達80%,而莖段轉化率只有20%[22]。受體材料的生長發育階段對遺傳轉化效率具有重要影響[23]。處于旺盛分裂期的林木細胞或組織是農桿菌轉化成功的基礎。一般來說,發育早期的組織細胞分裂能力較強[24]。方宏筠等[25]在研究黑核桃Juglans nigra體胚遺傳轉化時發現:球形胚、魚雷胚等有較高的轉化效率,而發育晚期的子葉胚很難誘導出抗性體細胞胚狀體,這可能與其分裂能力低有關。DAI等[26]選用葡萄Vitis vinifera胚胎發育過程中的3個階段(胚性愈傷組織、原胚團、體胚)為遺傳轉化的受體材料,結果顯示:僅原胚團樣品得到了32個轉基因株系。選擇幼胚作為外植體,易產生胚性愈傷組織,且分化和再生能力較強,縮短了再生所需時間,提高了遺傳轉化效率[27]。香榧胚性愈傷組織結構特殊,胚性細胞團結構疏松脆弱,在農桿菌侵染過程中極易受到不可逆的損害,大大影響了后續發育的活力。因此,本研究以種子突破種鱗后第8~11周的香榧幼胚為農桿菌介導的遺傳轉化受體材料,發現處于胚胎選擇期的香榧幼胚遺傳轉化能力較強,GFP熒光陽性率高于優勢胚完全發育期,與該時期幼胚具有較強的胚性感受態有關[17]。
3.2 轉化條件對農桿菌介導遺傳轉化的影響
菌液侵染是農桿菌介導的遺傳轉化的第1步,涉及諸多影響因子,包括農桿菌菌液濃度、侵染時間等。一般來講,菌液濃度過高,脫菌時抗生素不能抑制農桿菌生長,而且易使外植體產生過敏反應;當菌液濃度較低時,外植體表面的菌液不足以侵染植物組織細胞[28]。劉曉晨[15]在研究核桃體胚轉化條件時發現:在侵染時間相同情況下,陽性率隨著侵染液濃度提高呈上升趨勢,但污染率也隨之提高;仝鑄等[29]在建立檸檬Citrus limon遺傳轉化體系時發現:菌液D(600)為0.6時胚軸再生率達到最高,D(600)高于0.6胚軸再生率隨之下降。因此,選擇合適的菌液吸光度是高效轉化體系的關鍵。本研究中,農桿菌D(600)為0.5時香榧幼胚轉化效率最高。
農桿菌侵染時間的長短也因植物材料不同而異,適宜的時間可以確保農桿菌對植物細胞充分穩定的吸附,時間過短不能完成農桿菌有效侵染,導致轉化效率過低甚至轉化失敗,而過長的侵染時間容易導致材料過度污染甚至死亡。杜麗等[30]研究樟樹Cinnamomum camphora胚性愈傷組織遺傳轉化時發現:轉化效率在侵染時間超過40 min后呈下降趨勢。糜瑤琦[31]在研究美國山核桃Carya illinoinensis遺傳轉化條件時發現:侵染15 min時β-葡萄糖苷酸酶(GUS)表達率最高,達61.52%,超過15 min后呈下降趨勢。在本研究的香榧幼胚轉化中,最佳侵染時間為10 min,且不同農桿菌菌液吸光度和侵染時間處理下,污染率、成活率、愈傷組織誘導率以及體胚發生率均具顯著性差異。
農桿菌介導遺傳轉化的另一個重要環節為脫菌培養。篩選出適合的抑菌抗生素對于農桿菌介導的遺傳轉化至關重要[32]。林木遺傳轉化中常用的抑菌劑有頭孢霉素和羧芐青霉素等[33]。黃建[34]研究棗Ziziphus jujuba遺傳轉化時發現,低濃度的羧芐青霉素促進葉片外植體形成愈傷組織,而濃度過高有抑制作用。MONDAL等[35]在研究茶Camellia sinensis遺傳轉化中發現:頭孢霉素和羧芐青霉素協同使用,可有效抑制農桿菌的活性。堅果樹種對農桿菌脫菌抗生素非常敏感,在加有抗生素壓力的抑菌培養基上生長能力較差。優化核桃體胚遺傳轉化條件時,使用250 mg·L?1羧芐青霉素時體胚轉化率最高,達28.0%,隨后體胚轉化率逐漸下降[36]。在本次香榧幼胚的轉化中,300 mg·L?1羧芐青霉素為最佳脫菌質量濃度。
目前,堅果類樹種的遺傳轉化仍存在較多問題需要進一步探究和解決。堅果樹種轉化方法單一是限制其遺傳轉化體系建立的一個重要因素[19]。此外,堅果類樹種體胚再生頻率低、重復性差的自身特性是影響轉化效率的主要原因,甚至有些堅果樹種難以建立再生體系,致使轉化無法進行。這一特性是導致堅果類樹種遺傳轉化研究和應用滯后的主要原因[37]。本研究在受體材料選擇、農桿菌侵染時間、侵染濃度、抗生素質量濃度等方面進行了初步研究,成功獲得了香榧轉化幼胚培養物。研究結果可為香榧重要基因遺傳轉化和功能驗證打下良好基礎,同時也為香榧種質創新提供重要技術平臺。

